脊髓背角神经元STAT3/SDF-1 信号通路在大鼠术后慢性疼痛形成中的作用
孙扬 张璎 张海良 李静 孙文艳
西安医学院第二附属医院1康复医学科,2医务处,3院办,4耳鼻喉科(西安 710038)
随着人类平均寿命逐年增加,恶性肿瘤、器官移植、复杂创伤等需要进行手术治疗的疾病发病率呈逐年上升趋势。由于该类手术耗时较长,术中固定牵拉较久,慢性术后疼痛综合征(chronic postsurgical pain syndromes,CPSP)发生率非常高,主要临床症状为操作部位及与其相邻组织持续数月甚至数年的痛觉过敏或出现不同程度触诱发痛情况[1-2],当前治疗挑战极大,相关的病理生理机制仍有待明确。皮肤肌肉切口牵拉术(skin/muscle incision and retraction,SMIR)可导致成年大鼠术后3~22 d 机械痛阈显著下调,是一种术后急慢性疼痛转化常用动物模型[3],可有助于揭示CPSP 的深层病理生理机制。
趋化因子家族成员基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)可介导多种因中枢神经损伤、炎症等导致的痛觉过敏的产生[4-5]。笔者前期研究发现,SMIR 手术可能通过上调脊髓背角SDF-1 的表达诱导中枢敏感化及痛觉过敏,提示脊髓背角SDF-1 上调可能具有潜在的干预价值[6]。然而,术后脊髓背角SDF-1 的上调机制尚不明确。近期研究显示信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)参与介导SMIR 术后CX3CL1 上调和痛觉过敏[7]。以往研究表明,抑制STAT3 可以下调编码趋化因子如CCL2 和CXCL5 的mRNA 的表达,提示STAT3 调节趋化因子的转录[8]。基于此,笔者推测脊髓背角STAT3 与SDF-1 可能在术后急慢性疼痛转化过程中具有重要作用。本研究拟通过SMIR 大鼠模型明确脊髓背角STAT3 参与SDF-1 上调和疼痛过敏的潜在机制。
1 材料与方法
1.1 动物来源选用体质量为220~240 g 的雄性SD 大鼠饲养于规范标准环境中。所有实验程序均已获得第二军医大学动物护理和使用委员会的批准(SMMU,许可证号:2011023),全部实验步骤均按照实验动物护理与应用指南实施。
1.2 方法
1.2.1 分组将SD 大鼠分为sham(假手术)组、SMIR 组、SMIR+anti-SDFI 组和SMIR+S3I-201 组,每组12 只大鼠。
1.2.2 SMIR 模型构建按规范建立大鼠皮肤肌肉切口牵拉术持续性疼痛模型[9]。sham(假手术)组除了不牵拉神经,其余操作与SMIR 组相同。
1.2.3 鞘内置管及给药方法如先前所述进行鞘内注射[10]。在4%水合氯醛(0.4 g/kg,腹腔麻醉)下行椎板切除术。然后将聚乙烯10(PE-10)导管通过L4/L5 椎间隙植入蛛网膜下腔中,并将导管尖端置于腰膨大处。进行SMIR手术之前,允许大鼠至少恢复7 d。SMIR+anti-SDFI 组和SMIR+S3I-201 组大鼠在SMIR 手术前30 min 分别在鞘内给予SDF-1 中和性抗体(50 μg/10 μL,Torrey Pines Biolabs)和STAT3抑制剂S3I-201(100 μg/10 μL,Selleckchem),此后连续给药10 d。
1.2.4 痛行为学监测用up-down 法监测大鼠撤足反射阈值有无变化,观测大鼠痛阈改变情况与持续时间。用Von Frey hair(0.8、1.12、1.68、3.2、4.89、6.3、8.6、12.6 和20.2 g)刺激大鼠后爪底部皮肤。计算50%阳性反应阈值为大鼠的撤足反射阈值PWT[11]。前期实验提示,通常SMIR 后第10 天时测得大鼠痛阈最低,并能持续至第20 天,故该实验所确定取样时间为术前1 d 及术后第1、5、10、20 天。
1.2.5 蛋白免疫印迹SMIR手术后第1、5、10、20天取大鼠脊髓,Western blot 方法检测SDF-1 蛋白水平、磷酸化STAT3 水平及总蛋白水平。脊髓局部应用SDF-1 中和性抗体及STAT3 抑制剂S31-201,观察SDF-1 蛋白水平。操作如下:取脊髓背角组织,添加Tris 裂解缓冲液低温下匀浆、破碎并低温离心,取上清。BCA 法检测蛋白质浓度。进行SDS-PAGE 后转移至PVDF 膜后TBST 封闭液室温下封闭1 h。4 ℃过夜孵育SDF-1 一抗(稀释比例为1∶1 000)、STAT3(稀释比例为1∶1 000)、磷酸化STAT3(稀释比例为1∶1 500),第2 天用TBST 洗膜3 次,共30 min。用辣根过氧化物酶标记的二抗孵育1 h,洗3次后进行ECL显色,暗室曝光拍照。
1.2.6 免疫组化免疫组化方法检测SDF-1、STAT3表达的细胞类型。戊巴比妥钠(50 mg/kg)麻醉大鼠,并在升主动脉中灌注生理盐水,然后在4 ℃下于0.1 mol/L 磷酸盐缓冲液(pH 7.2~7.4)中加入4%多聚甲醛。取出L3/4 脊髓,在相同的固定剂中固定1 h 后转移到30%的蔗糖中2 d。在低温恒温器(Leica CM1900)中切开脊髓切片(25 μm),并使用SDF-1(1∶300,Abcam)、磷酸化STAT3(Tyr705)(1∶100,Abcam)、NeuN(1∶500,Chemicon)、GFAP(1∶800,Chemicon)、Iba1(1∶200,Abcam)或OX-42(1∶250,Chemicon)的一抗进行免疫组化。4 ℃孵育过夜后,将切片与Cy3 偶联和Alexa 488 偶联的二抗在黑暗中于室温孵育1 h。然后立即检查荧光染色的切片,并使用荧光显微镜及共焦显微镜观察。
1.2.7 染色质免疫共沉淀(ChIP)测定SMIR 手术后第1、5、10、20 和30 天取大鼠脊髓,染色质免疫共沉淀(ChIP)检测STAT3 与SDF-1 启动子相互作用。使用ChIP 分析试剂盒(Thermo)进行分析。快速取出L3/4 脊髓背角并置于1%甲醛中2 min。通过超声处理将DNA 片段化,并用微球菌核酸酶消化。加入ChIP 稀释缓冲液后,将100 μL 样品保存为输入。然后将STAT3 抗体(R&D 系统)8 μL添加到500 μL 预先清除的染色质溶液中,并将样品接种过夜。进行“IgG”(Sigma)免疫沉淀作为阴性对照。然后捕获、洗脱和反向交联抗体/DNA 复合物。从复合物和输入级分中纯化DNA,沉淀并重悬于60 μL 无核酸酶的水中,用于PCR。计算ChIP/输入比。引物5′-AGAAAGGCAATGGGAGTGTGTG-3′和5′-CTCAGTCCTGCCGATAGACC-3′被设计为扩增SDF-1 启动子片段(-1181/-879),该片段包含预测的STAT3 结合位点(-1085/-1075)。
1.3 统计学方法使用SPSS 13.0统计学软件进行分析。对于行为学分析,使用双向或单向ANOVA,并进行重复检验,随后进行了Tukey 事后检验。对于qPCR、蛋白印迹和免疫组化数据,使用了双向ANOVA,然后进行了Tukey 事后检验。P<0.05 为差异有统计学意义。
2 结果
2.1 脊髓背角SDF-1的上调导致SMIR后痛觉过敏通过检测观测时间段大鼠撤足反射阈值,相较对照组,皮肤肌肉切口牵拉术组大鼠实验反射阈值显著降低(P<0.05),将中和SDF-1抗体注射于大鼠鞘内可升高SMIR导致的大鼠疼痛阈值(图1A)。SMIR后第5、10、20天大鼠脊髓背角SDF-1的mRNA(图1B)及蛋白(图1C)表达水平均显著上调(均P<0.01)。
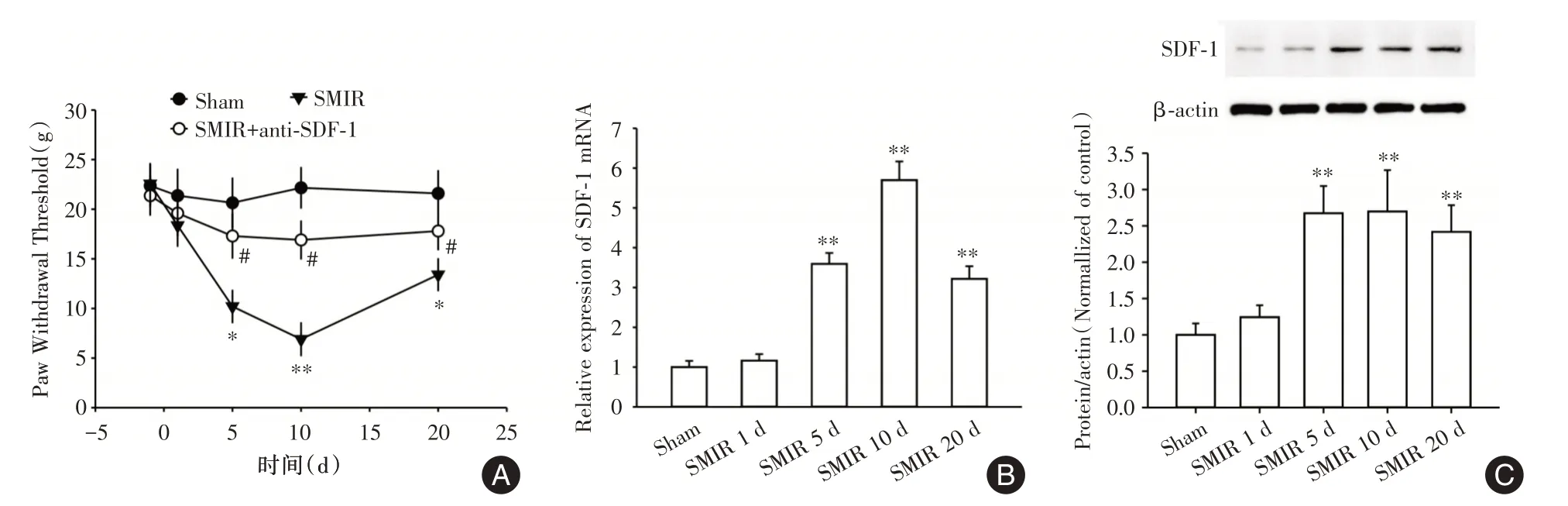
图1 SMIR 后不同时间大鼠痛阈及脊髓SDF-1 的表达Fig.1 Paw withdrawal threshold and expression of SDF-1 in spinal cord at different phases after SMIR
2.2 脊髓背角STAT3 在SMIR 术后慢性疼痛中的作用Western blot 结果显示(图2A),SMIR 手术后第5~20 天,大鼠脊髓背角p-STAT3 与总STAT3 蛋白的比值显著增加(P<0.01);且鞘内注射STAT3抑制剂S3I-201 可缓解SMIR 引起的大鼠痛阈的降低(P<0.05,图2B)。提示脊髓背角磷酸化的STAT3 参与SMIR 诱导的痛觉过敏。

图2 脊髓背角STAT3 在SMIR 诱发的机械性痛觉过敏中的作用Fig.2 The role of spinal dorsal horn STAT3 in SMIR-induced mechanical hyperalgesia
2.3 SMIR 手术后脊髓背角神经中SDF-1 与p-STAT3 表达定位双重免疫荧光染色结果表明,SDF-1 与Neun 阳性神经元共染,与GFAP 阳性星形胶质细胞不共染(图3A);p-STAT3 也与Neun 阳性神经元共染,与GFAP 阳性星形胶质细胞不共染(图3B)。表明脊髓背角SDF-1 与p-STAT3 主要在Neun 阳性神经元中表达,而在GFAP 阳性星形胶质细胞中不表达,并且p-STAT3 可能调节SDF-1 的表达。

图3 SMIR 手术后脊髓神经中SDF-1 与p-STAT3 表达定位Fig.3 Expression and localization of SDF-1 and p-STAT3 in spinal nerves after SMIR
2.4 SMIR 促进脊髓背角STAT3 与SDF-1 基因启动子的结合Western blot 结果显示(图4A),鞘内注射STAT3 抑制剂S3I-201 显著抑制了SMIR 术后脊髓背角SDF-1蛋白的表达(P<0.01),表明脊髓背角STAT3 的激活可能介导了SMIR 诱导的SDF-1 的上调。与观察到的脊髓背角SDF-1蛋白表达变化一致,定量PCR结果显示(图4B),S3I-201同样抑制了SMIR 诱导的SDF-1 的mRNA 表达(P<0.01),表明脊髓背角STAT3对SDF-1的调控发生在转录水平。Jaspar 数据库预测STAT3 可能与SDF-1 基因启动子区域-1085/-1075 区域发生结合,针对该区域所在的启动子(-1181/-879)设计引物。ChIP-PCR 显示(图4C),与假手术相比,SMIR 后第10 天STAT3与SDF-1 基因启动子的结合显著增加(P<0.01),提示脊髓背角STAT3 向SDF-1 基因启动子的募集可能会进一步上调脊髓背角SDF-1 的表达并导致痛觉过敏。

图4 脊髓背角STAT3 介导SMIR 术后SDF-1 的表达Fig.4 Spinal dorsal horn STAT3 mediates the expression of SDF-1 after SMIR
3 讨论
CPSP发生率非常高,截至目前相关产生原因尚不明确,而常规使用各类镇痛药物效果不明显[12]。明确手术导致痛觉过敏的机制,并进一步探索治疗模式,可有效减轻患者痛苦从而降低社会医疗支出具有显著医学价值与现实意义。FLATTERS等[9]首先成功构建皮肤肌肉切口牵拉动物模型,该模型在保有外周神经正常功能前提下,效仿外科手术进行切口牵拉,并可引起1 个月左右持续性痛觉过敏,该模型的成功建立成为目前研究术后慢性疼痛的主要方法,因此被广泛采用作为研究术后慢性痛机制的理想模型。
SDF-1 作为趋化因子家族中的重要成员,广泛存在于中枢神经系统中,介导多种原因导致的痛觉过敏。报道显示脊髓损伤、蜂毒注射模型诱导痛觉过敏中均检测到SDF-1 的明显上调[13-14],SDF-1 还通过与其受体CXCR4 相结合介导神经损伤或吗啡耐受诱导的痛觉过敏[15]。本研究证实:SMIR 手术显著上调脊髓背角SDF-1 蛋白及mRNA 的表达,且鞘内注射SDF-1 中和性抗体显著抑制SMIR 手术诱导的机械性痛觉过敏,提示SMIR 手术可能通过上调脊髓背角SDF-1 的表达诱导中枢敏感化及痛觉过敏,然而脊髓背角SDF-1 的上调机制目前仍不明确。STAT3 是在中枢神经系统中表达的重要转录因子,目前认为STAT3 不仅可以介导免疫和炎症反应,而且在慢性疼痛中也起着至关重要的作用[16]。既往研究显示,神经损伤会增加STAT3的磷酸化,抑制STAT3 通路会减弱机械性痛觉过敏[17-19]。本研究发现,SMIR 手术后大鼠脊髓背角神经元中的STAT3 明显活化,p-STAT3 与总STAT3蛋白的比值显著增加,且鞘内注射STAT3 抑制剂S3I-201 显著减轻了SMIR 引起的疼痛,提示磷酸化的STAT3 可能参与SMIR 诱导的痛觉过敏。然而,STAT3 的激活是否会上调脊髓背角SDF-1 的表达尚不清楚。
为了进一步研究脊髓背角SDF-1 和STAT3 之间的潜在关系,首先要表明它们是否在很大程度上共定位,以及STAT3 抑制剂是否可以降低SMIR诱导的SDF-1 的上调。研究证明,STAT3 可以转录调节趋化因子CX3CL1、CXCL5、CXCL10 和CCL20的表达[8]。作为转录因子,当受到炎症、损伤或其他情况的刺激时,STAT3 可以被激活,结合至其靶基因的启动子区域并促进其转录[20]。本研究通过免疫荧光染色发现,脊髓背角SDF-1 与p-STAT3 主要在Neun 阳性神经元中表达,而在GFAP 阳性星形胶质细胞中不表达,说明神经元细胞而非小胶质细胞参与了术后痛觉反应,并且p-STAT3 可能通过调节SDF-1 的表达诱发术后慢性疼痛。相关研究发现,STAT3 激活后进入细胞核并与目的基因的启动子相结合,通过调控目的基因的转录,在多种生物学功能中发挥作用[16]。ChIP 分析也证实,SMIR 增强了脊髓背角STAT3 向SDF-1 基因启动子的募集,鞘内注射STAT3 抑制剂S3I-201 可显著抑制SMIR 手术后SDF-1 蛋白和mRNA 水平的上调。这表明脊髓背角STAT3 对SDF-1 的调控发生在转录水平,S3I-201 可能通过抑制STAT3 磷酸化、STAT3 转运到细胞核以及脊髓背角STAT3 与SDF-1 基因启动子的结合来降低SDF-1 的表达。因此,SMIR 可能通过增强脊髓背角STAT3 向SDF-1 基因启动子的募集,上调SDF-1 的表达,从而促进了机械性痛觉过敏的发生发展。
本研究首次提出了脊髓背角病理性上调的SDF-1 参与了SMIR 模型大鼠术后慢性疼痛的发生、发展,并且提出其上调机制可能是由转录因子STAT3 与SDF-1 启动子结合增多、促进SDF-1 转录产生的。但本文也有一定的局限性:(1)没有证明STAT3 与SDF-1 启动子结合增多的原因,是否是由于SMIR 术后SDF-1 启动子区域乙酰化水平增高或是其他原因;(2)没有对STAT3 与SDF-1 可能的结合区域进行突变,之后观察STAT3 还能否与突变后的SDF-1 启动子区域结合以及其对SDF-1 表达的影响;(3)激活的STAT3 是否存在其他下游靶蛋白在本文中并未探究。
综上所述,SMIR 手术可能通过激活脊髓背角STAT3,促进其与SDF-1 基因启动子的结合,上调脊髓背角SDF-1 的表达,增强脊髓背角突触传递效率,从而导致机械性痛觉过敏。这一结论为术后慢性疼痛提供了潜在的分子诊断依据和临床治疗靶点。而术后慢性疼痛是否还存在其他可能机制及STAT3/SDF-1 信号通路的具体调控方式,需要进一步深入研究。

