颗粒蛋白前体衍生物Atsttrin对骨关节炎的保护作用及对CD+4T细胞的调节作用
彭侃,鲁超,胡守业,井文森,王波
骨关节炎(OA)是一种以关节软骨破坏、滑膜炎、软骨下骨硬化和骨赘形成为特征的关节疾病。目前,骨关节炎的发病机制仍不清楚,但据报道肿瘤坏死因子-α(TNF-α)在骨关节炎的病理过程中发挥重要作用[1]。其他研究发现骨关节炎患者关节软骨中TNF-α水平异常升高,并且TNF-α的水平与疾病进展有关[2]。此外,抗TNF-α药物在各种骨关节炎模型以及临床试验中均表现出较好的预防和治疗作用[3]。颗粒蛋白前体(PGRN)是一种生长因子,具有独特的“串珠”结构[4]。PGRN参与许多病理生理过程,包括抗炎、组织修复和伤口愈合[5-6]。此外,PGRN还是调节软骨发育和降解的生长因子。PGRN通过与肿瘤坏死因子受体(TNFRs)结合在多种炎症性关节炎小鼠模型中发挥作用[7-8]。
Atsttrin是一种PGRN衍生工程蛋白,该分子由PGRN的F+A+C三个片段组成,该蛋白具有比PGRN更强的结合肿瘤坏死因子受体(TNFR)(如TNFR1和TNFR2)的能力,并且半衰期更长(约120 h)[9]。因此,Atsttrin是一种靶向TNFR的TNF∕TNFR信号拮抗剂[10]。据报道,在炎症性关节炎动物模型中,Atsttrin具有比PGRN更强的治疗作用[3]。
CD+4T细胞亚群在骨关节炎的进展中发挥重要功能[11]。其中,Th1∕Th2细胞、Th17∕调节性T细胞(Treg)的比例失衡可对机体产生免疫损害,并且是包括骨关节炎在内的多种关节炎发生的关键因素。本研究建立了骨关节炎大鼠模型,并考察了PGRN衍生物Atsttrin对骨关节炎的保护机制,以及对CD+4T细胞亚群的影响。
1 材料与方法
1.1 实验材料本研究起止时间为2018年10月至2019年12月,60只5周龄SD雄性大鼠购自西安交通大学医学部实验动物中心[SYXK(陕)2018-001];大鼠饲料购自南通特洛菲饲料科技有限公司;Atsttrin由艾美捷科技有限公司合成;番红O固绿染色试剂盒购自北京凯瑞基生物科技有限公司;干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-17(IL-17)和转化生长因子-β(TGF-β)ELISA试剂盒购自美国R&D公司;异硫氰酸荧光素(FITC)抗CD4、PE抗IFNγ、藻红蛋白(PE)抗IL-4、PE抗IL-17、FITC抗CD4、PE抗CD25、PE抗叉头盒P3(Foxp3)抗体购自美国Biolegend公司;胶原酶Ⅱ购自Gibco公司;DMEM培养基购自Gibco公司;BrdU细胞增殖测定试剂盒购自Merck Millipore公司;胶原酶、胎牛血清购自美国Gibco BRL公司;RNeasy试剂盒购自德国Qiagen公司;RIPA裂解液购自北京索莱宝科技有限公司;BCA蛋白质测定试剂盒购自上海碧云天生物技术有限公司;解聚蛋白样金属蛋白酶-4(ADAMTS-4)、基质金属蛋白酶-13(MMP-13)、IL-4、IL-17、IFN-γ、TGF-β和甘油醛-3-磷酸脱氢酶(GAPDH)一抗以及辣根过氧化物酶(HRP)标记的抗兔∕小鼠免疫球蛋白二抗购自美国Cell Signaling Technology公司;增强化学发光(ECL)试剂盒购自上海乔羽生物科技有限公司。
1.2 实验方法
1.2.1实验动物及分组60只5周龄SD雄性大鼠的体质量为230~280 g。将大鼠饲养在25℃、55%相对湿度、12 h光照∕黑暗循环照明的实验室内,给予大鼠标准饲料和纯净水,不限制饮食和饮水。将大鼠随机分为假手术组、骨关节炎模型组和Atsttrin组,每组20只。
1.2.2骨关节炎大鼠模型的建立采用膝关节前交叉韧带横断法建立骨关节炎大鼠模型。将大鼠用10%水合氯醛(4 mL∕kg)麻醉。大鼠仰卧固定,脱毛消毒后内侧髌骨切口暴露右膝关节腔并切断前交叉韧带,然后将切口逐层缝合。术后每天注射20 000 U青霉素抗感染1周。模型组和Atsttrin组大鼠进行建模,假手术组大鼠进行相同的手术操作但未切断前交叉韧带。术后4周,各组中随机选取3只大鼠通过病理学观察模型是否建立成功。
1.2.3给药大鼠麻醉后,Atsttrin组大鼠关节内注射15 μL Atsttrin(1 μg∕μL),每周注射1次,连续注射4周。假手术组和模型组大鼠注射等体积生理盐水。实验过程中允许大鼠自由进食,最后一次给药2 h后,从大鼠腹主动脉采血5 mL,4 000 r∕min立即离心15 min,分离血清并置于4℃冰箱保存。处死大鼠后分离右膝关节组织并储存在-20℃冰箱。
1.2.4膝关节的组织学检查将大鼠膝关节组织用10%多聚甲醛固定,20%的EDTA溶液脱钙。然后将膝关节组织在梯度乙醇中脱水,二甲苯中透明,石蜡包埋后切成4.0 μm切片。使用番红O固绿染色试剂盒对切片进行染色,在光学显微镜下(×20)观察组织学变化。采用OARSI评分系统评价软骨退化情况。
1.2.5ELISA测定和CD+4T细胞亚群分析按照说明书,使用IFN-γ、IL-4、IL-17和TGF-β ELISA试剂盒通过酶联免疫吸附测定(ELISA)法测定大鼠血清样品中细胞因子浓度。使用FITC抗CD4、PE抗IFN-γ、PE抗IL-4、PE抗IL-17对Th1、Th2和Th17进行流式细胞分析。为了分析Treg细胞,将Treg细胞用FITC抗CD4和PE抗CD25染色标记,然后与PE抗Foxp3一起孵育。
1.2.6滑膜细胞的分离培养切碎大鼠滑膜组织,用0.2%胶原酶Ⅱ消化3 h。200目筛过滤并收集滤液,1 500 r∕min离心15 min,上清液中加入含有10%FBS的DMEM培养基并在37℃、5%二氧化碳培养箱中培养,每隔48 h更换1次培养基。融合度达到约80%时将细胞传代培养,第3代细胞用于实验。将滑膜细胞分别分成五组,第一组正常培养48 h,第二组组使用TNF-α处理滑膜细胞48 h,TNF-α终浓度为10 μg∕L。其他三组分别使用终浓度为10 μg∕L、20 μg∕L、50 μg∕L的Atsttrin以及10 μg∕L的TNF-α处理48 h。
1.2.7软骨细胞的分离培养从大鼠膝关节处收集关节软骨,PBS冲洗并切成小块,在0.1%胶原酶中孵育3 h。将大鼠软骨细胞在含有10%胎牛血清的DMEM培养基中培养,培养条件为37℃、5%二氧化碳。融合度达到约80%时将细胞传代培养,第3代细胞用于实验。将软骨细胞用完全培养基洗涤3次,无血清培养基孵育过夜。
将软骨细胞分成五组,第一组正常培养48 h,第二组使用TNF-α处理滑膜细胞48 h,TNF-α终浓度为10 μg∕L。其他三组分别使用终浓度为10 μg∕L、20 μg∕L、50 μg∕L的Atsttrin以及10 μg∕L的TNF-α处理48 h。
1.2.8滑膜细胞和软骨增殖测定按照说明书,通过5-溴-2-脱氧尿苷(BrdU)细胞增殖测定试剂盒检测滑膜或软骨细胞的增殖情况。实验重复6次。
1.2.9RT-PCR使用RNeasy试剂盒(Qiagen)从培养的软骨细胞中提取总RNA,并使用ImProm-Ⅱ反转录系统(Promega)将其反转录为cDNA。设计引物序列(表1),将数据标准化为内部对照GAPDH。实验重复6次。

表1 引物序列信息
1.2.10蛋白质印迹法使用RIPA裂解液裂解细胞并离心。使用BCA蛋白质测定试剂盒检测蛋白质浓度。从软骨细胞中提取的蛋白质在8%SDS-聚丙烯酰胺凝胶上电泳,然后电转移到硝酸纤维素膜上。将膜在3%牛血清白蛋白中封闭。洗涤3次后,将膜与ADAMTS-4(1∶500稀释)、MMP-13(1∶500稀释)、IL-4(1∶1 000稀释)、IL-17(1∶1 000稀释)、IFN-γ(1∶1 000稀释)、TGF-β(1∶500稀释)和GAPDH(1∶500稀释)4℃过夜孵育。然后将膜与HRP标记的抗兔∕小鼠免疫球蛋白二抗在25℃下孵育1 h。使用增强化学发光(ECL)试剂盒进行显影。实验重复6次。
1.3 统计学方法本研究中结果表示为±s,统计分析软件为SPSS 17.0。组间比较通过t检验或单因素方差分析及LSD法进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 Atsttrin减轻骨关节炎大鼠膝关节组织病变各组大鼠膝关节组织番红O固绿染色显示见图1。

图1 各组大鼠膝关节组织(番红O固绿染色×20)
假手术组大鼠膝关节组织未见明显番红O失染现象,关节表面光滑,软骨结构清晰可见。而模型组中的番红O失染严重,可见软骨细胞数量明显减少,细胞弥漫性增加。Atsttrin组大鼠的膝关节软骨破坏情况得到明显减轻。OARSI评分结果显示,与假手术组相比(0.51±0.03),模型组(2.56±0.21)和Atsttrin组(1.08±0.11)大鼠OARSI评分均显著升高(P<0.001);与模型组相比,Atsttrin组大鼠OARSI评分显著降低(P=0.001)。
2.2 Atsttrin对骨关节炎大鼠CD+4 T细胞亚群的影响细胞因子水平检测结果显示,与假手术组相比,模型组和Atsttrin组大鼠的血清IFN-γ和IL-17水平均显著升高,而IL-4和TGF-β水平均显著降低(P<0.05)。Atsttrin组大鼠的血清IFN-γ和IL-17水平显著低于模型组,而IL-4和TGF-β水平显著高于模型组(P<0.05)。见表2。
表2 各组大鼠血清IFN-γ、IL-4、IL-17和TGF-β水平∕(ng∕L,±s)

表2 各组大鼠血清IFN-γ、IL-4、IL-17和TGF-β水平∕(ng∕L,±s)
注:IFN-γ为干扰素-γ,IL-4为白细胞介素-4,IL-17为白细胞介素-17,TGF-β为转化生长因子-β。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
与假手术组相比,模型组和Atsttrin组大鼠的血清Th1和Th17细胞比例均显著升高,而Th2和Treg细胞比例均显著降低(P<0.05)。Atsttrin组大鼠的血清Th1和Th17细胞比例显著低于模型组,而Th2和Treg细 胞 比 例 显 著 高 于 模 型 组(P<0.05)。见表3。
表3 各组大鼠血清Th1、Th2、Th17和Treg细胞比较∕(%,±s)
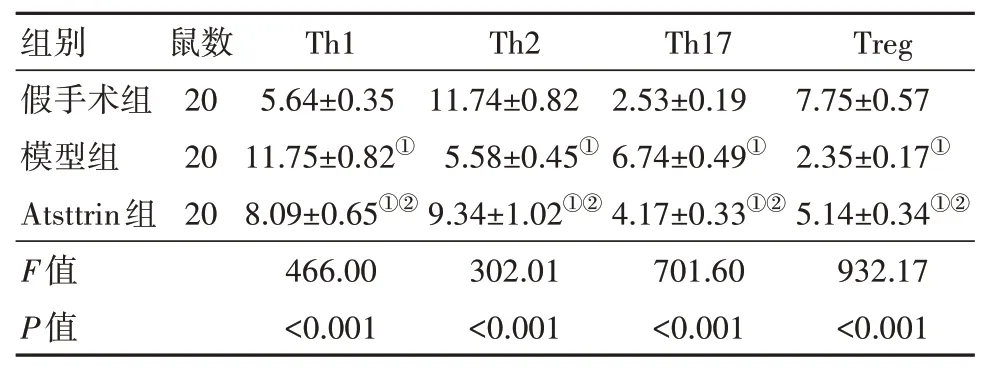
表3 各组大鼠血清Th1、Th2、Th17和Treg细胞比较∕(%,±s)
注:①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.3 Atsttrin抑制TNF-α诱导的滑膜细胞增殖与对照组(1.03±0.12)相比,TNF-α(10 μg∕L)处理组(1.78±0.15)的滑膜细胞增殖能力显著升高(P<0.001);用10 μg∕L、20 μg∕L或50 μg∕L的Atsttrin处理后,与TNF-α(10 μg∕L)处理组相比,三组滑膜细胞的增殖能力均显著降低,依次为(1.31±0.12)、(1.11±0.09)和(1.06±0.07)(P=0.014,P=0.002和P<0.001)。
2.4 Atsttrin促进TNF-α诱导的软骨细胞增殖与对照组(1.12±0.14)相比,TNF-α(10 μg∕L)处理组(0.34±0.04)的软骨细胞增殖能力显著降低(P<0.001);用10 μg∕L、20 μg∕L或50 μg∕L的Atsttrin处理后,与TNF-α(10 μg∕L)处理组相比,三组软骨细胞的增殖能力均显著升高,依次为(0.66±0.05)、(0.76±0.07)和(0.80±0.09)(P<0.001,P=0.007和P=0.011)。
2.5 Atsttrin抑制TNF-α诱导的软骨细胞中ADAMTS-4和MMP-13的表达与对照组相比,TNFα(10 μg∕L)处 理 组 的 软 骨 细 胞 中ADAMTS-4和MMP-13的mRNA和蛋白表达水平显著上升,而用10 μg∕L、20 μg∕L或50 μg∕L的Atsttrin处 理后,与TNF-α(10 μg∕L)处理组相比,三组软骨细胞中ADAMTS-4和MMP-13的mRNA和蛋白表达水平均显著降低(P<0.05)。见图2,表4。

图2 Western blotting检测Atsttrin对TNF-α诱导的软骨细胞中ADAMTS-4和MMP-13表达的影响

表4 各组ADAMTS-4和MMP-13的mRNA相对表达量
2.6 Atsttrin对TNF-α诱导的软骨细胞中细胞因子表达的影响与对照组相比,TNF-α(10 μg∕L)处理组的软骨细胞中IFN-γ和IL-17的mRNA和蛋白表达水平均显著上升,而IL-4和TGF-β的表达水平均显著降低(P<0.05)。用10 μg∕L、20 μg∕L或50 μg∕L的Atsttrin处理后,与TNF-α(10 μg∕L)处理组相比,三组软骨细胞中IFN-γ和IL-17的mRNA和蛋白表达水平均显著降低,而IL-4和TGF-β的表达水平均显著升高(P<0.05)。见图3和表5。

图3 Western blotting检测Atsttrin对TNF-α诱导的软骨细胞中IFN-γ、IL-4、IL-17和TGF-β表达的影响
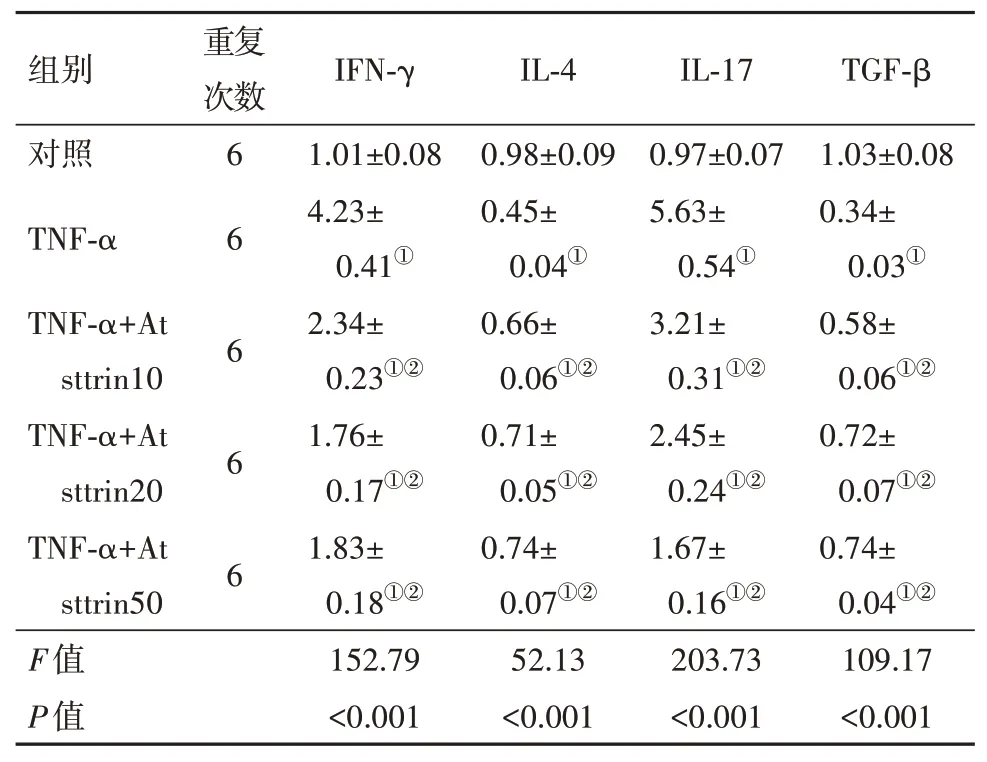
表5 各组IFN-γ、IL-4、IL-17和TGF-β的mRNA相对表达量
3 讨论
骨关节炎是最常见的关节疾病之一,然而,骨关节炎的确切病理机制仍不清楚。目前,临床中仍缺乏特效药物阻止骨关节炎的发生发展。众所周知,细胞因子密切参与骨关节炎的发展过程。其他研究发现PGRN是与骨关节炎相关的生长因子[3]。PGRN的缺失可加重骨关节炎模型小鼠的骨关节炎严重程度,而外源性施用重组PGRN则可显著抑制骨关节炎[7]。PGRN通过与TNFRs结合在多种炎症性关节炎小鼠模型中发挥作用[12]。Atsttrin是一种PGRN衍生工程蛋白,该蛋白具有比PGRN更强的结合TNFR的能力,并且半衰期更长。据报道,在炎症性关节炎动物模型中,Atsttrin具有比PGRN更强的治疗作用[3]。外科手术诱发的骨关节炎模型是研究体内骨关节炎发病机制的公认方法,本研究通过膝关节前交叉韧带横断法建立骨关节炎大鼠模型,并应用Atsttrin治疗大鼠4周以考察Atsttrin在治疗骨关节炎反面的潜在价值和所涉及的机制。
碱性染料番红O可将嗜碱性的软骨染为红色,而酸性染料固绿可将嗜酸性的骨组织染为蓝色或绿色,因此,番红O固绿染色可用于观察关节软骨退变情况,在本研究中,番红O固绿染色切片表明Atsttrin有效地防止了骨关节炎模型大鼠的软骨退变。OARSI评分结果表明,Atsttrin显著降低了骨关节炎大鼠的OARSI评分,说明Atsttrin可有效抑制骨关节炎的病情进展,改善膝关节功能。
众所周知,TNF-α在骨关节炎发生中起重要作用,作为重要的促炎细胞因子,上调TNF-α可直接促进骨关节炎的炎症反应并诱导软骨细胞死亡[17]。另外,TNF-α可以激活MAPK和NF-κB信号传导导致关节软骨破坏[3]。TNF-α抑制剂在关节炎的临床试验中均显示出较好的治疗效果[18]。其他研究中已经证实Atsttrin可在类风湿性关节炎小鼠模型中抑制软骨破坏和炎症反应。为了揭示Atsttrin在骨关节炎发病过程中的生理机制,本研究探讨了Atsttrin对TNF-α诱导的滑膜细胞和软骨细胞增殖的影响。已知骨关节炎发病过程中的关节内微环境失衡主要与滑膜组织和滑膜细胞微环境失衡有关。滑膜细胞主要由成纤维细胞样滑膜细胞和巨噬细胞样滑膜细胞组成。在骨关节炎中,滑膜细胞增殖可导致滑膜增生和纤维化,改变软骨细胞微环境及关节的力学特征,从而导致关节功能障碍。本研究显示,TNF-α可明显促进滑膜细胞增殖并抑制软骨细胞增殖,而Atsttrin可逆转上述效应,从而维持关节内微环境的稳定。
据报道,TNF-α可在软骨细胞中诱导基质降解酶(包括MMP-13和ADAMTS-4)以及其他炎性生物标志物降解软骨基质,导致关节软骨破坏[19]。ADAMTS-4是软骨基质蛋白聚蛋白多糖的主要降解酶,而MMP-13是一种能够溶解软骨细胞外基质的基质金属蛋白酶[20]。本研究中也发现了TNF-α可上调软骨细胞中ADAMTS-4和MMP-13的表达,然而,Atsttrin可以剂量依赖性方式下调软骨细胞中ADAMTS-4和MMP-13的表达,从而发挥软骨保护作用。
另外,在软骨细胞体外实验中发现,TNF-α处理可上调软骨细胞中IFN-γ和IL-17的表达并下调IL-4和TGF-β的表达。不同浓度的Atsttrin处理可逆转上述变化。该结果与骨关节炎大鼠模型体内实验一致,进一步证实了Atsttrin可通过纠正Th1∕Th2细胞以及Th17∕Treg细胞的失衡来发挥软骨保护作用。
综上所述,Atsttrin可有效抑制骨关节炎大鼠模型的软骨病变并提高关节功能。Atsttrin可通过抑制滑膜细胞增殖、促进软骨细胞增殖、抑制软骨机制降解来维持关节内微环境的稳定。此外,Atsttrin的关节软骨保护作用与纠正Th1∕Th2细胞以及Th17∕Treg细胞的失衡有关。

