红汁乳菇培养基和菌株优选
谭 云, 申爱荣, 谭著明, 沈宝明
(1.湖南省菌根性食用菌种质资源保护与利用中心, 湖南 长沙 410004; 2.湖南省林业科学院, 湖南 长沙 410004; 3.湖南省林下特色生物资源培育与利用工程技术研究中心, 湖南 长沙 410004)
红汁乳菇(Lactariuslividatus)隶属于担子菌门、红菇科、乳菇属,俗称寒菌、雁鹅菌、枞菌、铜锣菌、紫花菌、丝茅菌等[1]。其子实体营养丰富,味道鲜美,食用、药用价值高, 富含真菌多糖、粗纤维、不饱和脂肪酸、核酸衍生物、多种氨基酸及维生素等生物活性成份[2],具有益肠胃、抗癌等药用功效,是一种天然优质多功能菌物食品。红汁乳菇在我国及日本、韩国、泰国等地有着悠久的食用历史和广阔的市场,并已发展成为野生食用菌市场的大宗产品。该菌可鲜食、速冻或加工成菌油,产业链长、市场容量大,是一种开发前景广阔的菌根性食用菌。国内外研究机构对红汁乳菇的研究已持续多年,涉及其生理生化特征、菌种培养、菌根合成、营养成分、功能成分分析等。21世纪初,通过人工接种、培育红汁乳菇菌根苗,建立菌根性食用菌种植园,并收获子实体的技术路线和方案首度取得成功[3]。此后,红汁乳菇逐渐成为野生菌领域研究的热点之一。随着菌根性食用菌种植园建设逐步兴起,满足市场对菌根苗质量的更高要求成为研究者追求的新目标。在红汁乳菇菌根苗培育过程中,优良菌种是提高菌根苗质量和子实体产量的关键。其中,菌种繁殖、菌剂制备则是重要的工艺问题。菌剂制备环节相对耗时,主要原因是红汁乳菇离体菌丝普遍存在生长速度慢,并伴有自溶现象。此外,菌种自身活力、生长速度等生理特性会直接影响菌种增殖。因此,缩短培养周期、提高菌种活力是红汁乳菇菌种繁殖必须优先解决的难题。红汁乳菇菌剂生产一般经过固体平板培养和液体发酵培养两个阶段,在此过程中,培养基成分与配比对菌种的菌丝体增殖速度影响最直接。因此,除优良菌种外,筛选合适的培养基也是解决上述难题的前提之一。关于红汁乳菇培养基的研究,已有很多报道[4-11],但研究结论各不相同,没有普遍认可的配方,以致参考者莫衷一是。为此,我们比较、筛选和验证了多种培养基配方,以期获得符合菌根苗高效培育目标的红汁乳菇培养基配方。
1 材料与方法
1.1 试验材料
1.1.1 菌株 试验用菌株分离于湖南嘉禾县试验基地的野生红汁乳菇子实体。菌株经过ITS测序,与红汁乳菇子实体ITS序列一致。12种菌株分别命名为C2、JH1、JH2、JH3、JH4、JH5、JH7、JH8、JH10、JH11、JH12、JH13。选择其中生长速度快、生长势好、不易老化自溶、侵染能力强的菌株C2用于培养基优化试验,其余用于菌株与培养基的匹配试验。
1.1.2 培养基 将已报道不同配方的培养基分为4组,第一组为基础培养基,第二组为优化后的红汁乳菇固体或液体培养基,第三组为以PDA为基础的微调培养基,第四组为广泛采用的菌根真菌培养基。各培养基的配方及来源(参考文献)见表1至表4,所有培养基的pH值均为5.5~6.5。
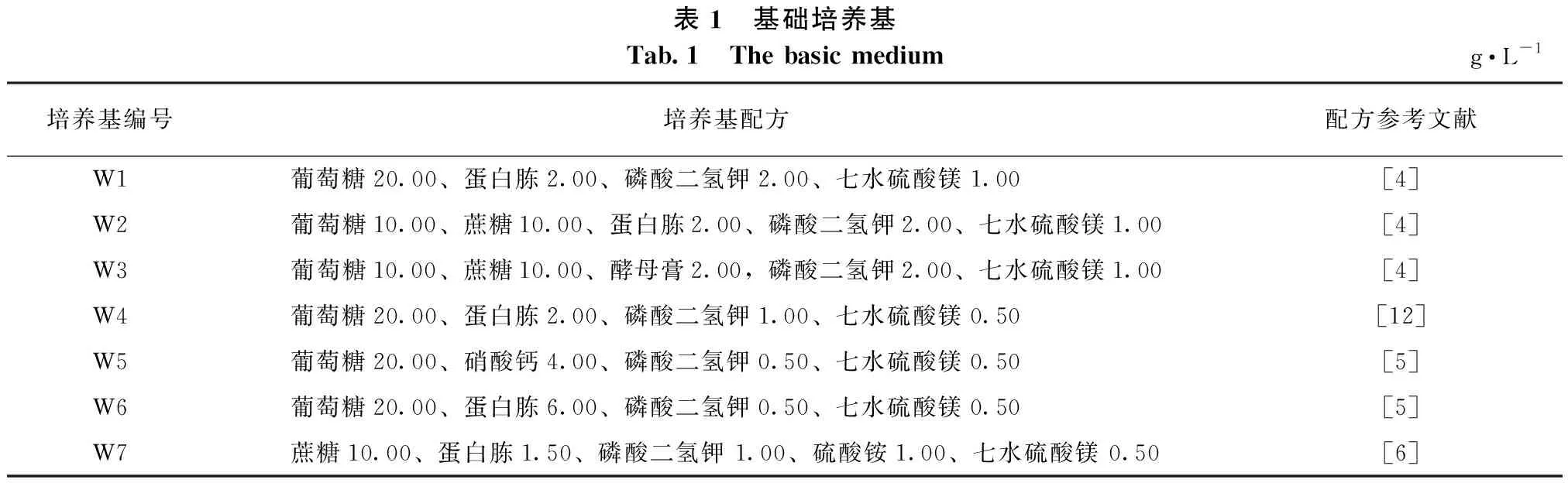
表1 基础培养基Tab.1 The basic mediumg·L-1培养基编号培养基配方配方参考文献W1葡萄糖20.00、蛋白胨2.00、磷酸二氢钾2.00、七水硫酸镁1.00[4]W2葡萄糖10.00、蔗糖10.00、蛋白胨2.00、磷酸二氢钾2.00、七水硫酸镁1.00[4]W3葡萄糖10.00、蔗糖10.00、酵母膏2.00,磷酸二氢钾2.00、七水硫酸镁1.00[4]W4葡萄糖20.00、蛋白胨2.00、磷酸二氢钾1.00、七水硫酸镁0.50[12]W5葡萄糖20.00、硝酸钙4.00、磷酸二氢钾0.50、七水硫酸镁0.50[5]W6葡萄糖20.00、蛋白胨6.00、磷酸二氢钾0.50、七水硫酸镁0.50[5]W7蔗糖10.00、蛋白胨1.50、磷酸二氢钾 1.00、硫酸铵1.00、七水硫酸镁 0.50[6]
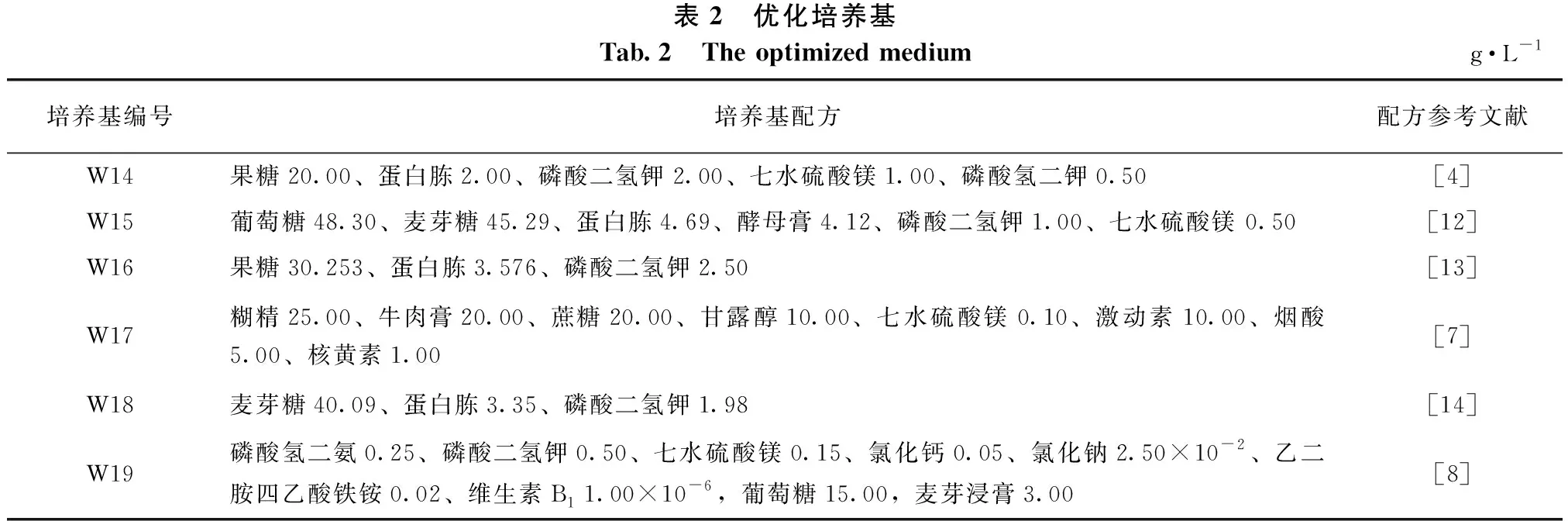
表2 优化培养基Tab.2 The optimized mediumg·L-1培养基编号培养基配方配方参考文献W14果糖20.00、蛋白胨2.00、磷酸二氢钾2.00、七水硫酸镁1.00、磷酸氢二钾0.50[4]W15葡萄糖48.30、麦芽糖45.29、蛋白胨4.69、酵母膏4.12、磷酸二氢钾1.00、七水硫酸镁 0.50[12]W16果糖30.253、蛋白胨3.576、磷酸二氢钾2.50[13]W17糊精25.00、牛肉膏20.00、蔗糖20.00、甘露醇10.00、七水硫酸镁0.10、激动素10.00、烟酸5.00、核黄素1.00[7]W18麦芽糖40.09、蛋白胨3.35、磷酸二氢钾1.98[14]W19磷酸氢二氨0.25、磷酸二氢钾0.50、七水硫酸镁0.15、氯化钙0.05、氯化钠2.50×10-2、乙二胺四乙酸铁铵0.02、维生素B1 1.00×10-6,葡萄糖15.00,麦芽浸膏3.00[8]
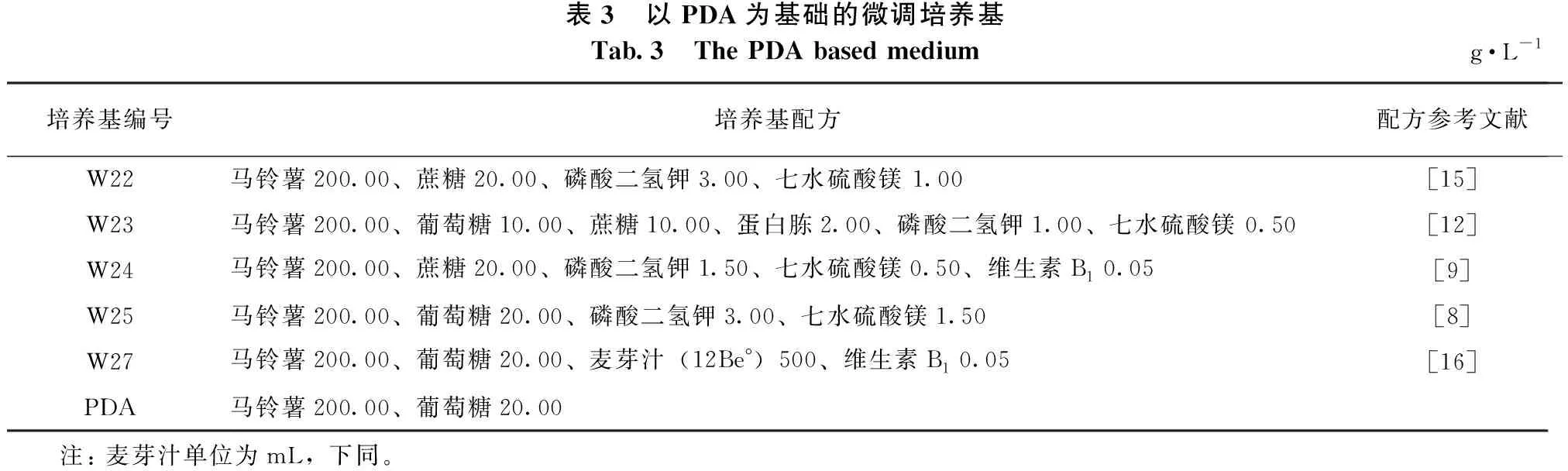
表3 以PDA为基础的微调培养基Tab.3 The PDA based mediumg·L-1培养基编号培养基配方配方参考文献W22马铃薯200.00、蔗糖20.00、磷酸二氢钾3.00、七水硫酸镁 1.00[15]W23马铃薯200.00、葡萄糖10.00、蔗糖10.00、蛋白胨2.00、磷酸二氢钾1.00、七水硫酸镁 0.50[12]W24马铃薯200.00、蔗糖20.00、磷酸二氢钾1.50、七水硫酸镁0.50、维生素B1 0.05[9]W25马铃薯200.00、葡萄糖20.00、磷酸二氢钾3.00、七水硫酸镁1.50[8]W27马铃薯200.00、葡萄糖20.00、麦芽汁(12Be°)500、维生素B1 0.05[16]PDA马铃薯200.00、葡萄糖20.00 注: 麦芽汁单位为mL,下同。

表4 广泛采用的菌根菌培养基Tab.4 The widely used mycorrhizal mediumg·L-1培养基名称培养基配方配方参考文献YpSs磷酸二氢钾 1.00、七水硫酸镁0.50、酵母浸膏4.00、可溶性淀粉15.00[17]WPM硝酸铵0.40、硫酸钾0.99、磷酸二氢钾0.17、七水硫酸镁0.37、硫酸锌8.60×10-3、硫酸亚铁2.78×10-2、肌醇0.10、烟酸0.50×10-3、甘氨酸0.2×10-3、硝酸钙5.56×10-1 、氯化钙9.60×10-2、钼酸钠2.50×10-4、硫酸锰2.24×10-2、硫酸铜2.50×10-4、乙二胺四乙酸3.73×10-2、维生素B11.00×10-4、维生素B6 5.00×10-4、蔗糖20.00[18] MMN氯化钙0.05、磷酸二氢钾0.50、氯化钠2.50×10-2、磷酸二氢铵0.25、七水硫酸镁0.15、三氯化铁(1%)12.00、维生素B11.00×10-4、葡萄糖15.00、麦芽汁(12Be°)100.00、柠檬酸0.20[19]改良MMN氯化钙0.05、磷酸二氢钾0.50、氯化钠2.50×10-2、磷酸二氢铵0.25、七水硫酸镁0.15、三氯化铁1.20×10-2、维生素B11.00×10-3、葡萄糖10.00、麦芽糖3.00、酵母提取物1.00[20]HM磷酸二氢钾0.50、七水硫酸镁0.50、氯化铵0.50、三氯化铁(1%) 0.50、葡萄糖5.00、麦芽浸膏5.00、维生素B15.00×10-5、金霉素3.50×10-2[21]YMT磷酸二氢钾1.00、七水硫酸镁0.50、葡萄糖20.00、麦芽浸膏5.00、酵母浸膏2.00、维生素B11.00×10-4、金霉素3.50×10-2[17]PACH酒石酸铵0.50、七水硫酸镁0.50、麦芽糖5.00、KH2PO4磷酸二氢钾1.00、维生素B1 0.10、葡萄糖20.00、硼酸8.45、硫酸锰5.00×10-3 、钼酸钠3.00×10-4 、硫酸亚铁6.00×10-3、硫酸铜6.30×10-4、硫酸锌2.27×10-3[16]BAF氯化钙0.10、磷酸二氢钾0.50、七水硫酸镁0.50、硫酸锰5.00×10-2 、硫酸锌1.10×10-2 、三氯化铁0.01、肌醇5.00×10-5、叶酸1.00×10-4 、维生素B15.00×10-5、葡萄糖30.00、酵母提取物0.20、蛋白胨2.00[22]注: 三氯化铁(1%)单位为mL。
1.2 试验方法
1.2.1 菌种制备 配制PDA固体培养基,活化C2斜面菌种,(24±1)℃条件下黑暗培养,待生长旺盛、致密的菌丝长满1/2平板后,备用。
1.2.2 生长速度测定 在无菌条件下,用直径为5 mm的打孔器在菌种平板上打孔,接种到上述各不同固体培养基中,每种配方接种3皿,各重复3次,用封口膜封口,(24±1)℃下黑暗培养,随时观察菌丝密度、颜色变化,每7 d采用“十字交叉法”测量菌落直径。按公式(1)计算红汁乳菇菌丝生长速度。
(1)
式中:V为菌丝生长速率(mm·d-1);D为菌落直径(mm);t为培养时间(d);L为打孔器直径(mm)。
1.2.3 生物量测定 按1.2所列配方配置液体培养基。于500 mL三角瓶中分装250 mL培养液,每种培养基分装3瓶,即重复3次,灭菌冷却后接种红汁乳菇C2菌株,于(24±1) ℃,180 r·min-1条件下黑暗培养。21 d结束培养,将摇瓶中的发酵液倒入抽滤瓶中抽滤。抽滤后的菌丝体放置于烘箱中,80 ℃烘干至恒质量,按公式(2)计算红汁乳菇菌丝生物量。
(2)
式中:S为菌丝生物量(g·L-1);M为菌丝干质量(g);V为发酵液体积(L)。
1.2.4 生长势测定 培养至第21 d,测量固体平板培养基上菌落的直径,对菌丝生长势进行评分。菌丝生长势评分标准为:5级(+++++),基外菌丝生长势旺盛、浓密、均匀、不自溶;4级(++++),基外菌丝多、较均匀、有轻微自溶现象;3级(+++),基外菌丝较多、纤细、不均匀、自溶;2级(+++),基外菌丝稀疏、少、严重自溶;1级(+),只有基内菌丝,无基外菌丝,或严重自溶。
1.3 数据分析
采用SPSS 22.0软件进行数据处理,采用Duncan法进行单因素和多重比较方差分析,显著性水平设置为0.05。
2 结果与分析
2.1 基础培养基对红汁乳菇菌丝生长的影响
由表5可知:在固体培养状态下,红汁乳菇C2菌株的菌丝在W3号培养基上平均生长速度最快,为1.88 mm·d-1,显著快于它在其它6种培养基上的生长速度,其生长势相对较好,基内菌丝生长快,有基外菌丝产生,自溶现象轻微;菌丝生长速度在W1、W4号之间无显著差异,表明培养基中磷酸二氢钾和硫酸镁含量的改变对红汁乳菇菌丝生长影响不大。菌丝在W6号培养基上的平均生长速度最慢,仅为0.62 mm·d-1。在液体培养状态下,红汁乳菇菌丝的生物量以W3号培养基中的最高,达到1.25 g·L-1;W4、W7号培养基中的较高,且这两者间的差异不显著。W2号和W3号培养基中均以葡萄糖和蔗糖作为碳源,其中的菌丝生长速度和生物量也均较高,可能是能量供应持久所致。

表5 基础培养基对红汁乳菇生长的影响Tab.5 Effects of different basic medium on the growth of Lactarius lividatus编号固体培养菌丝生长速度/(mm·d-1)菌丝生长势液体培养菌丝生物量/(g·L-1)W11.32±0.02 c++0.72±0.02 dW21.51±0.03 b++1.05±0.02 cW31.88±0.02 a+++1.25±0.06 aW41.29±0.05 c+++1.17±0.07 bW51.02±0.02 d+0.41±0.01 eW60.62±0.04 f+0.28±0.02 fW71.03±0.01 d+++1.14±0.10 b 注: 同列相同字母表示差异不显著;不同字母表示差异显著。下同。
红汁乳菇在不同基础培养基上生长的差异主要表现为基内菌丝生长速度的不同,且基外菌丝的生长速度与基内菌丝的不同步。所有基础培养基上均有菌丝自溶现象,这可能是基础培养基的营养成分不足以支撑红汁乳菇的旺盛生长,因此,有必要在基础培养基中添加合适的矿物质、维生素、激素等营养物质,以改善红汁乳菇的生长状态。综合考虑菌丝生长速度、生长势、生物量等,W3号为适合红汁乳菇生长的较优基础培养基。
2.2 优化培养基对红汁乳菇菌丝生长的影响
由表6可知:红汁乳菇C2菌株在不同优化培养基上表现不一。固体平板培养时,红汁乳菇菌丝在W19号培养基上的平均生长速度最快,为2.36 mm·d-1,显著快于它在其它培养基上的生长速度,且其基外菌丝较多、分布均匀但纤细,无自溶现象;菌丝生长速度在W14、W15、W16号培养基之间无显著差异,且3种优化培养基上的菌丝生长势均较弱。液体培养时,红汁乳菇菌丝生物量以W19号培养基中的最高,达到1.87 g·L-1;W18、W15号培养基中的较高,分别为1.72、1.17 g·L-1;W14号和W16号培养基上菌丝的生物量无显著差异,分别为0.97、0.87 g·L-1。红汁乳菇C2菌株在W17固体和液体培养基上均不生长。综合考虑菌丝生长速度、生长势、生物量,W19号为适合红汁乳菇生长的较佳培养基。
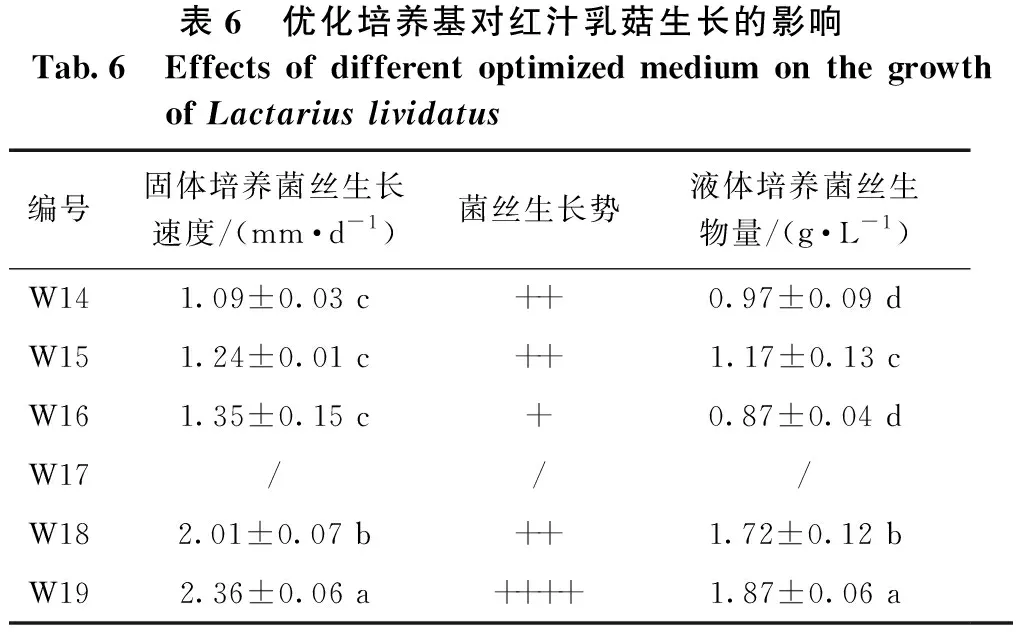
表6 优化培养基对红汁乳菇生长的影响Tab.6 Effects of different optimized medium on the growth of Lactarius lividatus编号固体培养菌丝生长速度/(mm·d-1)菌丝生长势液体培养菌丝生物量/(g·L-1)W141.09±0.03 c++0.97±0.09 dW151.24±0.01 c++1.17±0.13 cW161.35±0.15 c+0.87±0.04 dW17///W182.01±0.07 b++1.72±0.12 bW192.36±0.06 a++++1.87±0.06 a
2.3 以PDA为基础的培养基对红汁乳菇菌丝生长的影响
由表7可知:固体培养时,红汁乳菇C2菌株的菌丝在PDA培养基上生长最快、生长势最好,其平均生长速度为3.05 mm·d-1,且基外菌丝多、菌丝层厚、浓密、均匀、粗壮且不自溶;其次是W24号培养基上的,其平均生长速度为2.96 mm·d-1,与PDA培养基上的无显著差异,基外菌丝多、较粗壮但分布不均匀、菌丝层薄、不致密、自溶现象严重。W22号培养基上的菌丝平均生长速度为2.76 mm·d-1,生长势较好,基外菌丝较多、菌丝层厚度一般、菌丝浓密、洁白、分布均匀,有自溶现象,菌丝自溶圈上可以重新长出菌丝。W23号培养基上的菌丝平均生长速度为2.24 mm·d-1,有基外菌丝、菌丝层薄、较密、纤细洁白、分布不均匀、自溶现象严重。从液体培养时的菌丝生物量来看,PDA培养基中的最大,为2.25 g·L-1,且与其他培养基中的有显著性差异;其次为W24号培养基中的,为2.05 g·L-1。红汁乳菇菌丝在W27号固体培养基上不生长,在W27号液体培养中菌丝生物量最低,仅为0.28 g·L-1,可能是培养基中麦芽汁比例过大所致。
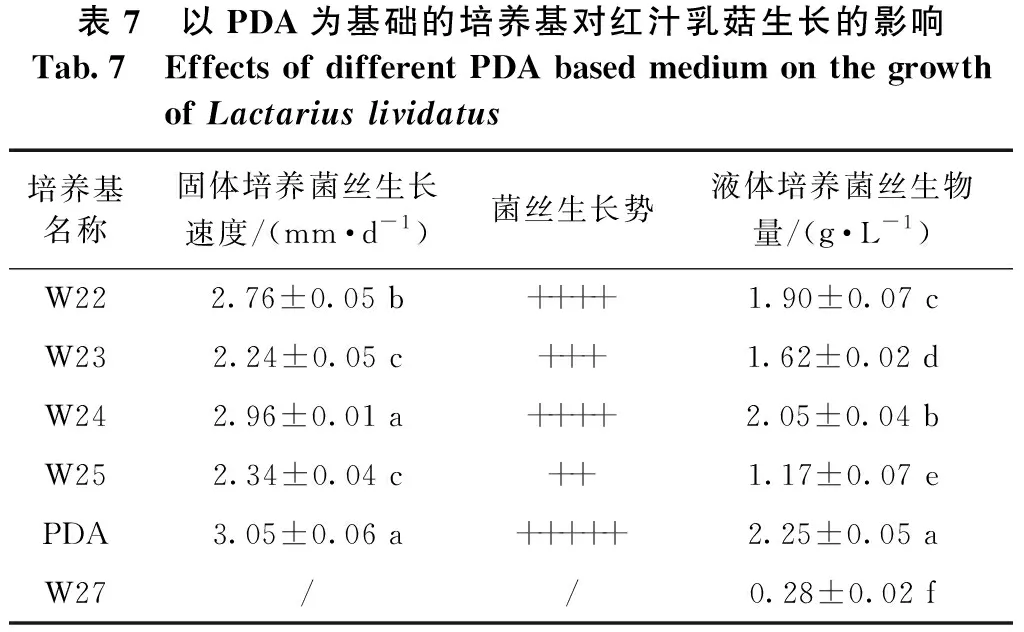
表7 以PDA为基础的培养基对红汁乳菇生长的影响Tab.7 Effects of different PDA based medium on the growth of Lactarius lividatus培养基名称固体培养菌丝生长速度/(mm·d-1)菌丝生长势液体培养菌丝生物量/(g·L-1)W222.76±0.05 b++++1.90±0.07 cW232.24±0.05 c+++1.62±0.02 dW242.96±0.01 a++++2.05±0.04 bW252.34±0.04 c++1.17±0.07 ePDA3.05±0.06 a+++++2.25±0.05 aW27//0.28±0.02 f
2.4 菌根菌培养基对红汁乳菇菌丝生长的影响
由表8可知:红汁乳菇C2菌株的菌丝在不同菌根菌培养基上的生长表现不同。固体培养时,菌丝在BAF培养基上的生长速度最快,为2.57 mm·d-1;其次是在PACH培养基上的,为2.51 mm·d-1;在该2种培养基上,菌丝的生长速度无显著性差异,且显著快于其他6种培养基上的。BAF培养基上的菌丝生长势最好,基外菌丝分布均匀、致密、粗壮、洁白、无自溶现象。PACH培养基上的菌丝生长势也很好,基内菌丝和基外菌丝生长同步,分布均匀、较粗壮,有轻微自溶现象。HM培养基上菌丝的生长速度较慢,为2.27 mm·d-1;生长势较差,基外菌丝稀疏、纤细、白色、分布较均匀、没有自溶现象。在WPM、YMT、改良MMN、YpSs培养基上的菌丝生长速度均无显著差异。在WPM培养基上的菌丝生长势较好,基外菌丝多、白中带绿、纤细、不致密、菌丝层薄、分布不均匀、不易老化,不自溶;在YMT培养基上的菌丝生长势较差,基外菌丝稀疏、分布不均匀、匍匐状、纤弱、白色、无自溶现象;在改良MMN培养基上的菌丝生长势差,基外菌丝稀少、纤细、菌丝带褐色、易老化、自溶严重;在YpSs培养基上的菌丝生长势差,仅基内菌丝生长速度快,基外菌丝稀少,匍匐于培养基上,有轻微自溶现象,无法进行继代培养。在MMN培养基上红汁乳菇的菌丝生长势很差,基外菌丝稀少、纤细、易老化、易自溶;菌丝生长速度最慢,仅为1.34 mm·d-1。

表8 菌根菌培养基对红汁乳菇菌丝生长的影响Tab.8 Effects of different mycorrhizal medium on the growth of Lactarius lividatus培养基名称固体培养菌丝生长速度/(mm·d-1)菌丝生长势液体培养菌丝生物量/(g·L-1)YpSs2.05±0.09 c+0.73±0.04 eWPM1.98±0.03 c++++1.90±0.02 cMMN1.34±0.03 d+0.48±0.03 f改良MMN2.01±0.12 c+0.75±0.04 ePACH2.51±0.14 a+++++2.07±0.19 bHM2.27±0.1 b +++1.92±0.02 cYMT1.98±0.12 c+++1.62±0.09 dBAF2.57±0.01 a+++++2.51±0.02 a
表8还显示:液体培养时,BAF培养基中的红汁乳菇C2菌株的菌丝生物量最大,为2.57 g·L-1,菌丝为短棒状,较小,便于直接用于菌剂制作;其次为PACH培养基中的,其菌丝的生物量为2.07 g·L-1;HM、WPM培养基中的菌丝生物量分别为1.92 g·L-1和1.90 g·L-1,该2种培养基中的菌丝生物量无显著性差异;YMT培养基中的菌丝生物量为1.62 g·L-1,菌丝球颗粒较大;改良MMN、YpSs培养基中的菌丝生物量分别为0.75 g·L-1和0.73 g·L-1,该2种培养基中的菌丝生物量也无显著性差异;MMN培养基中的菌丝生物量最低,仅为0.48 g·L-1。总体来看,适合C2菌株生长的培养基为BAF和PACH。
2.5 在不同固体培养基上不同红汁乳菇菌株菌丝生长速度和生长势
根据以上结果,选择生长速度和生长势综合效果较佳的W3、W19、W22、W23、W24号和BAF、PACH、WPM、PDA培养基以及使用较普遍的MMN培养基,共10种培养基,以固体培养基分别培养11个红汁乳菇菌株(菌株编号:JH1、JH2、JH3、JH4、JH5、JH7、JH8、JH10、JH11、JH12、JH13)。结果(图1和表9)显示:所有的供试红汁乳菇菌株均能在W22、W24号和BAF、PACH、PDA固体培养基上生长,其菌丝平均生长速度为0.87~2.35 mm·d-1;所有菌株在PDA培养基上的生长势均较好、生长均较旺盛,表明PDA培养基营养丰富、配比合理,是培养红汁乳菇的首选固体培养基。11个供试菌株中的10个菌株均能在W19、W23号和WPM固体培养基上生长,其菌丝平均生长速度为1.09~1.49 mm·d-1;只有8个菌株能在W3号固体培养基上生长,其菌丝平均生长速度为1.18 mm·d-1;只有5个菌株能在MM固体培养基上生长,其菌丝平均生长速度为0.86 mm·d-1。
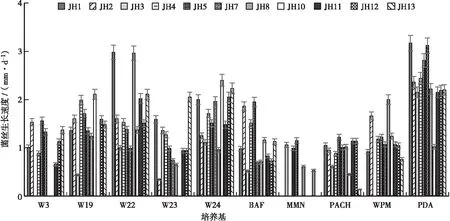
图1 不同红汁乳菇菌株菌丝在不同固体培养基上的生长速度Fig. 1 The growth rate of 11 strains of Lactarius lividatuson different solid medium

表9 不同红汁乳菇菌株在不同固体培养基上的生长势Tab.9 The mycelium growth vigor of different strains on different solid medium菌株菌丝生长势W3W19W22W23W24BAFMMNPACHWPMPDAJH1++++++++/++++++++++++JH2+++++++++++++++++++++++JH3/++++++++++++++/+++/++++JH4+++++++++++++++++++++++++++++++JH5++++++++++++++++++++++++++++++++++++++++++++++JH7+++++++++++++++/++++++++++++JH8/++++++++++++++++++++++++++JH10/++/+++++/+++++++++++JH11++/+++++++/+++++++++++++JH12+++++++++++++++++++++++++JH13++++++++++++/++++++++++++++
11个红汁乳菇菌株中,JH5菌株在所有供试培养基上的生长速度、生长势表现均优,是1个优良菌株。此菌株现注册保存于中国普通微生物菌种保藏管理中心(CGMCC),编号为19369。
3 结论与讨论
选择和优化合适的培养基是菌株培养的前提。观察表明,活力强的红汁乳菇菌株在合适的培养基上培养,其菌丝生长势应该具有基外菌丝粗壮、菌丝层厚、菌落边缘整齐、浓密、不自溶、白色或白绿色或肉红色等特征。本文作者用已报道的27种培养基培养红汁乳菇,通过对其菌丝生长速度、生长势和生物量进行测定,结果表明,PDA固体培养基表现最佳,BAF液体培养基表现最佳。参试的11个红汁乳菇菌株中,JH5具有良好的营养适应性,生长势最好,生长速度最快,是1个优良菌株,具有进一步挖掘的潜力。
根据红汁乳菇菌株在培养过程中生长势的表现,我们推测,红汁乳菇有自己独特的生长特性。当固体培养基营养不足时,红汁乳菇菌丝向培养基深层生长,摄取营养;营养足够时,基内菌丝冒出,基外菌丝旺盛生长。如在基础培养基中,红汁乳菇菌丝均以基内菌丝生长为主,基外菌丝较少,自溶现象普遍。当培养基中营养过剩或者比例不合理时,红汁乳菇菌丝不仅受到抑制,也会产生自溶。如在添加了磷酸二氢钾、蛋白胨等营养成分的W22、W23、W24、W25号培养基上,红汁乳菇菌丝的生长势就不如PDA的。这与李忠海等[23]发现松乳菇菌丝在PDA上生长势最好的结论相似。W24号和W27号培养基均以PDA为基础培养基,添加VB1后,红汁乳菇菌丝生长并未得到促进。这印证了李文艺[5]认为PDA培养基含有松乳菇菌丝生长所需的足量维生素的结论,也与赵洪等[24]关于PDA培养基中加入生长因子对红汁乳菇菌丝生长无明显促进作用的结果一致。可见,红汁乳菇菌丝的生长势对培养基成分和配比有明显的依赖性。值得注意的是,W22号和WPM培养基上,自溶圈上能重新长出菌丝,这一现象有待进一步研究。
从C2菌株菌丝生长情况来看,在含有麦芽汁成分的培养基上,其菌丝生长表现均较差,初步推断,可能是麦芽汁中的某些成分不利于红汁乳菇C2菌株菌丝的生长。自1996年Marx[19]报道适宜于外生菌根真菌生长的MMN培养基以来,国内外研究者视其为经典,广泛用于分离培养外生菌根菌菌种。但笔者采用MMN培养基培养红汁乳菇时,发现其菌丝生长缓慢,培养时间需35 d以上,无法满足规模生产要求。这与刘君昂[25]利用MMN培养基培养红汁乳菇,其菌丝生长较迅速且旺盛的结论不同。推测可能是培养基中麦芽汁抑制了菌根菌菌丝生长所致。为此,笔者曾尝试将与MMN培养基中剂量相同或减半的麦芽汁加入PDA、BAF、PACH、WPM、YMT培养基中培养红汁乳菇,发现红汁乳菇菌丝生长均受抑制,表现为只长基内菌丝且严重自溶,从而印证了上述推测。
采用经验证表现良好的10种培养基,对11个红汁乳菇菌株进行平板培养,发现不同菌株在不同培养基上表现不一,推测其原因可能是不同菌株对营养的需求不同。杨平等[10]、张疏雨等[11]试验筛选出的红汁乳菇培养基配方差异较大,也认为其原因归于菌株不同。因此,针对特定菌株,优化与之匹配的培养基配方和培养条件很有必要。由此推知,对于其它菌根性食用菌菌种的培养,培养基的选择和菌株的筛选同样重要。

