海洋溶珊瑚弧菌VcChit56 几丁质酶的蛋白质工程改造
孔德颖,蔡燕飞
(1.上海农林职业技术学院,上海 201699;2.华南农业大学资源环境学院,广东广州 510642)
几丁质是由N-乙酰-D-葡萄糖胺通过β-1,4-糖苷键组成的同聚物,是海洋中含量最丰富的生物大分子之一[1]。导致珊瑚白化的溶珊瑚弧菌Vibrio coralliilyticus[2]隶属于细菌变形菌门Proteobacteria,丙型变形菌纲Gammaproteobacteria,弧菌目Vibrionales,弧菌科Vibrionaceae,是珊瑚虫重要病原微生物之一,其所在的弧菌属Vibrio 具有强大几丁质降解能力,除珊瑚虫外,溶珊瑚弧菌还是鱼类和软体动物的病原菌[3],威胁水产养殖的健康发展。几丁质酶[4]在溶珊瑚弧菌生活史中发挥重要作用,弧菌依附在寄主表面外骨骼上,获取碳源的第一步为几丁质酶将几丁质降解为N-乙酰氨基葡萄糖二聚~六聚物(GlcNAc)2~6,进而从细胞外周质空间通过ABC 转运蛋白转移到细胞质内。陆生微生物几丁质酶大多由GH18 和GH19 两种糖苷水解酶组成,蛋白质结构相对简单。
重组蛋白质表达和纯化的过程中,缓冲液的离子浓度通常为200~500 mmol·L-1甚至更高,因此具有实际应用价值的酶制剂需要经脱盐工艺处理[5]。然而,溶珊瑚弧菌的几丁质酶具有酶活高,还有适应海洋高盐环境特点,理论上为保证最大酶活,反而需要保留较高的盐离子浓度,使其相比源自于陆生生物的酶制剂更具成本优势[6]。
本研究选择了1 株分离自海洋的溶珊瑚弧菌,其几丁质酶的蛋白质结构相对简单,经过对其进行序列改造和大肠杆菌重组表达、纯化,摸索出一套简单易行的纯化工艺,同时对其酶活特性进行了研究,并发现重组几丁质酶具有较好生物防治潜力。
1 材料和方法
1.1 主要试剂和仪器
基因组提取试剂盒、DNA 回收纯化试剂盒购自天根生化科技公司,BamHI、HindIII 酶、T4 DNA ligase购自Thermo Scientific,pET30a 购自大连宝生物有限公司,其他试剂均使用国产分析纯;超净工作台(ZHJHC1115C)、恒温振荡培养器(ZHWY-211B)、恒温培养箱(BPH-9082)采用上海智城公司的产品,台式离心机(5417R)采用Eppendorf 公司的产品。
1.2 几丁质酶序列改造
在NCBI(https://www.ncbi.nlm.nih.gov)上查找溶珊瑚弧菌几丁质酶的氨基酸序列(WP_045985309.1)。采用胞内原核表达策略,经序列分析,删减信号肽区域(1M~20A),保留GH18 家族几丁质酶保守域(69I~495D)和几丁质酶C 的几丁质结合结构域保守域(461K~495D),同时为增加几丁质结合能力,在N 端额外增加1 个陆生真菌几丁质结合域(XP_014082242,CSEFGFCGTTADFCGKNCQS),为保证各保守域功能独立,用柔性肽(GSGSGS)进行区隔。将改造后的几丁质酶命名为VcChit56,经大肠杆菌偏好密码子优化,提交至上海铂尚生物技术有限公司进行全基因合成。
1.3 VcChit56 原核表达载体的构建与诱导表达
将VcChit56 基因和pET30a 原核表达载体同时用BamHI 和HindIII 酶切(37 ℃,30 min),然后进行1%琼脂糖凝胶电泳,并用T4 DNA ligase 连接胶回收后的VcChit56 基因片段和pET30a 质粒骨架。连接产物转化至表达菌株E.coli BL21(DE3),挑选3 个阳性单克隆菌株,送上海铂尚生物技术有限公司测序验证。
将测序正确的表达菌株接种于50 mL 含50 ng·mL-1卡那霉素的LB 培养基,37 ℃,220 r·min-1过夜培养,按1∶100 体积比扩培至OD600=0.5 时,加入终浓度为1 mmol·L-1IPTG,20 ℃诱导表达20 h,收集菌体,用1× PBS 冲洗2 次,冻存于-80 ℃。
1.4 VcChit56 层析纯化
将菌体重悬于4 ℃预冷的Buffer A 缓冲液中(50 mmol·L-1Tris-HCl,20 mmol·L-1咪唑,200 mmol·L-1NaCl,1 mmol·L-1PMSF,pH 8.0),高压均质仪破碎,12 000 r·min-1,4 ℃离心30 min。将离心收集的上清用AKTA pure100 层析仪(Cytiva,瑞典)上样于Ni-NTA 层析柱,用Wash Buffer(50 mmol·L-1Tris-HCl,40 mmol·L-1咪唑,200 mmol·L-1NaCl,pH 8.0)冲洗4 个柱体积(20 mL),后用Elution buffer(50 mmol·L-1Tris-HCl,500 mmol·L-1咪唑,200 mmol·L-1NaCl,pH 8.0)接入层析仪pump B,按照1 mL·min-1流速,20 min 内到100%pump B 进行梯度洗脱。收集洗脱峰,用10 kd 超滤管进行浓缩处理,保存于5% 聚乙烯吡咯烷酮(PVP)溶液,同时对各个组分留样进行SDS PAGE 凝胶电泳检测。
1.5 不同盐离子浓度下VcChit56 酶活分析
配制酶活测定体系如下:100 μL 纯化后的几丁质酶(1 μg·μL-1),200 μL 2%胶体几丁质,300 μL PBS 缓冲液(pH=7.8)或300 μL PBS+NaCl 缓冲液(PBS 1×,pH=7.8,氯化钠浓度分别为100,200,300,400,500,600,700,800 mmol·L-1),37 ℃反应1 h 后用3,5-二硝基水杨酸(DNS)终止反应,沸水孵育10 min,后测定540 nm 吸光值。同时以商品纯几丁质酶作为对照组。酶活单位定义:单位时间(min)从胶体几丁质释放1 μmol GlcNAc 所需酶量。
2 结果与讨论
2.1 VcChit56 氨基酸序列分析
几丁质酶家族前20 个左右氨基酸为信号肽区,负责几丁质酶向胞外分泌[7],本研究通过SignalP-5.0分析可知,氨基酸序列WP_045985309.1 的原始序列信号肽分值0.66(图1),与其细胞周质降解几丁质功能的亚细胞定位吻合。氨基酸序列WP_045985309.1 的REJ 保守域位于569T~845E,预测含有多个细分亚结构域,但因具体功能未知,这部分序列在本研究与信号肽序列一并删除。为了增强几丁质结合能力,参考许颖等[8]、李大琪等[9]、钟万芳等[10]的研究,本研究在VcChit56 的N 端额外增加陆生真菌来源几丁质结合保守域(land fungi chitin bind region,LFCh BD:CSEFGFCGTTADFCGKNCQS),同时保留C 端野生ChiC BD保守域(PAWDSSAQYPDSGTLVSHNGFVWQNQWYANVGEEPGVADVWEL)(图2,图3)。此外,为防止邻近几丁质结合保守域之间的空间位阻,参考甘中伟等[11]、魏巍等[12]的研究,在各保守域之间增设柔性氨基酸链GSGSGS(图2,图3)。

图1 XP_014082242 序列信号肽预测Fig.1 Prediction of signal peptide of sequence XP_014082242

图2 VcChit56 序列示意图Fig.2 Sequence schematic diagram of VcChit56

图3 VcChit56 序列与溶珊瑚弧菌几丁质酶以及陆生真菌几丁质酶序列同源性比对Fig.3 Homology comparison of CH18,ChiC BD and LFCh BD
经过以上精细设计,VcChit56 重组蛋白共由508 个氨基酸组成,与降解几丁质相关的功能域从N 端到C 端依次为,①陆生真菌几丁质酶结合域、②GH18 糖苷水解酶、③弧菌几丁质结合域。两个几丁质结合域可有效增加底物结合效率,另外功能域之间由柔性氨基酸分隔,可降低功能域错误折叠和空间位阻的概率。
2.2 VcChit56 原核表达与纯化
测序正确的重组表达菌株经过1 mmol·L-1IPTG,20 ℃诱导表达20 h 后,样品经过组氨酸-镍离子亲和层析和SDS-PAGE 分析,结果显示6xHis 标签目的蛋白在100 mmol·L-1咪唑浓度下开始洗脱,200 mmol·L-1咪唑浓度下蛋白洗脱效率达到最高,该结果与范艳华[13]的研究结果一致。在约56 kD 位置出现明显诱导表达条带(图4),与预测分子量55.81 kD 一致。细菌菌体裂解后,蛋白条带丰度增加,显示有更多蛋白内含物析出,结果与庄群等[14]的研究结果类似。菌体裂解液离心后,沉淀组分蛋白含量低,切除与目的条带一致的蛋白,说明本研究对蛋白序列结构改造并未造成包涵体现象,目标蛋白溶解度高。此外,镍柱流穿组分和洗杂组分无VcChit56 条带,所有目的蛋白都被有效结合,无纯化损失(图5)。

图4 VcChit56 SDS-PAGE 层析纯化结果Fig.4 SDS-PAGE purification results of VcChit56

图5 VcChit56 SDS-PAGE 分析结果Fig.5 SDS-PAGE analysis results of VcChit56
重组蛋白正确折叠对减少包涵体生成至关重要,本研究结果进一步预示VcChit56 序列的合理性。在接下来工作中,可开展蛋白结构解析,并利用结构生物学数据指导VcChit56 序列进一步优化和功能迭代升级。
2.3 VcChit56 酶活分析
本研究以2%胶态几丁质为底物,重点分析商品几丁质酶和弧菌几丁质酶在不同盐离子浓度下的酶活特性。由图6 所示,VcChit56 的酶活整体高于商品几丁质酶,该结果与连文浩[15]的研究结果一致。此外,2 种几丁质酶的盐离子适应性差异显著(P<0.05),商品几丁质酶的最适酶活发生于较低盐离子浓度,例如100 mmol·L-1NaCl 和1× PBS,而VcChit56 的最高酶活为1.89,发生于高盐离子浓度(500~600 mmol·L-1),与海水的盐离子浓度接近,与该几丁质酶来源于生活在海洋中的溶珊瑚弧菌有关。随着盐离子浓度增加到一定程度,2 种酶的酶活都呈下降趋势,但2 个阈值有明显差异:商品化几丁质酶盐离子浓度阈值在100~200 mmol·L-1,VcChit56 盐离子浓度阈值在700 mmol·L-1以上。最后,从图6 中可知,VcChit56 与商品几丁质酶在各个盐离子浓度下酶活相比差异显著,该结果与宋柳[16]的研究结果类似,同时也说明,具有生物活性的几丁质酶更适应高盐离子浓度的环境。
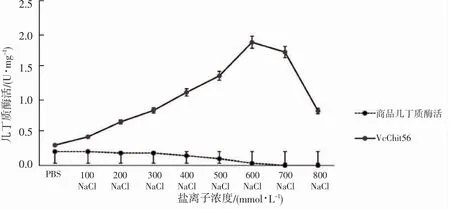
图6 不同盐离子浓度下商品几丁质酶和VcChit56 酶活测定Fig.6 Determination of commercial chitinase and VcChit56 enzyme activity under different salt ion concentration
在现代农业生产中,大量使用饲料、肥料、药物,在利用其活性成分同时,这些添加物也会造成水环境渗透压和盐离子浓度升高,这可能是未经改造的天然生物酶活性得不到发挥的原因之一。本研究重组的酶在高盐环境下的高活性验证了以上猜测的合理性,同时对其他生物酶的改造也具有一定借鉴意义。
3 结论
本研究通过蛋白质工程改造的方式,获得了源于海洋微生物溶珊瑚弧菌的几丁质酶,相比商品几丁质酶,酶活显著提高,尤其在高盐浓度下。增加几丁质结合保守域是近年来几丁质酶结构改造的主要思路,本研究在保留了弧菌N 端几丁质酶的同时,在C 端增加陆生真菌几丁质结合保守域,进一步增加酶与底物的普遍结合能力。溶珊瑚弧菌经过长时间海洋高盐环境选择,与其寄生生活史相关的致病基因都普遍适应高盐离子浓度,这与蛋白质纯化工艺中常用盐离子浓度接近,选择海洋微生物来源的几丁质酶可大大减少蛋白质工程中的脱盐工艺步骤,节省纯化成本。溶珊瑚弧菌虽然是近年珊瑚白化的病原物,但对其极端环境下寄生生活史深入研究有助于挖掘在其他应用领域有价值的基因资源。

