禁食对小鼠下丘脑磷酸化蛋白质组的影响
王梦凡,洪 杰, ,王倩倩,姚 迪,贾辰熙
禁食对小鼠下丘脑磷酸化蛋白质组的影响
王梦凡1,洪 杰1, 2,王倩倩2,姚 迪2,贾辰熙2
(1. 天津大学化工学院,天津 300350;2. 北京生命组学研究所蛋白质组学国家重点实验室,北京 102206)
本研究旨在通过干预小鼠进食,探讨对小鼠下丘脑中蛋白质磷酸化修饰和相关信号通路的影响,为完善蛋白磷酸化调控网络提供有价值的信息.将实验小鼠平均分为3组,分别为对照组(con)、禁食组(D2)和禁食后恢复组(DR),每组小鼠数量为3只.在48h内,con组正常提供饲料,D2组不提供饲料,DR组前44h不提供饲料、后4h提供饲料.同时解剖3组小鼠并提取下丘脑组织,提取、纯化和酶解下丘脑组织的蛋白质,并采用二氧化钛富集分离技术富集磷酸化肽段,运用高通量液相色谱-质谱联用进行检测,以鉴定样品中的磷酸化蛋白质组.利用非标记定量方法筛选差异表达的磷酸化蛋白以及位点,对鉴定数据进行GO富集和KEGG通路分析,并探究磷酸化蛋白间的相互作用关系.结果显示,共鉴定到4810个磷酸化蛋白质,对应于14259个磷酸化位点发生了变化.采用数学统计方法分析,成功确认小鼠下丘脑中有681个磷酸化蛋白差异显著,观察到这些差异蛋白与蛋白结合、激酶行为、转运、轴突生成等分子活动和生物学过程有关,并富集到了MAPK、细胞内噬和环磷酸腺苷信号通路等11个主要的信号通路.这说明禁食会对小鼠下丘脑中多种蛋白质的磷酸化修饰水平产生显著的影响,为完善小鼠下丘脑磷酸化信号调控网络提供了有价值的信息.
食欲;禁食;下丘脑;蛋白质组;磷酸化修饰
食欲是满足身体能量需要和食物摄取的欲望,可分为3个阶段:饥饿、饱食和饱腹.饥饿是促进食物摄取的感觉;饱食感在进食过程中控制进餐的多少和持续时间,有助于停止进食,并开始一段禁食期;饱腹感决定了两餐间的禁食时期[1].下丘脑是大脑中调节食欲和能量平衡的中枢部位,在其中神经肽Y(neuropeptide Y,NPY)、刺鼠相关肽(agouti-related peptide,AgRP)、前阿黑皮素(proopiomelanocortin,POMC)等共同作用保持食欲稳态平衡[2-3].当下丘脑中调节食物摄入的蛋白和神经肽出现失衡时,就会导致暴饮暴食或者厌食的状况,从而诱发消化系统疾病、代谢疾病等.
蛋白质磷酸化是目前研究最广泛和深入的蛋白质翻译后修饰方式,它主要发生在丝氨酸、酪氨酸以及苏氨酸上.蛋白质磷酸化在调节蛋白质功能和亚细胞定位中起着重要的作用,如细胞信号传导、DNA修复、感知环境刺激、代谢调节、细胞运动和细胞 分化[4-8].
近年来,一些研究发现通过控制摄入的食物改变机体中蛋白质磷酸化状态与一些疾病的发生发展有关联,如阿尔茨海默症、癌症、心脑血管疾病、糖尿病等.Dittmann等[9]发现和正常食物喂养的小鼠相比,喂养16周高脂食物的小鼠表现出了明显增肥和与胰岛素抵抗相关的表型,且肝脏中酪氨酸磷酸化水平显著增加.Rivera等[10]研究了母鼠在妊娠和哺乳期间饮食失调的影响,发现母鼠在哺乳期采取高热量低蛋白饮食都会使雌性后代下丘脑表现出高水平的瘦素受体磷酸化以及低水平的SOCS3、IRS1磷酸化和AMPK磷酸化,此外后代小鼠会减少摄食、体重轻于野生型小鼠.这些科学研究通过改变饮食规律、改变食物类型和断食等进行进食干预,揭示了进食干预对各种疾病、细胞、特定蛋白质修饰状态的影响.目前尚无研究通过进食干预,探究对小鼠全蛋白质组的磷酸化影响.本研究采取了禁食的方法对小鼠进行干预,富集下丘脑组织蛋白磷酸化肽段,运用质谱技术进行磷酸化蛋白的鉴定,并使用非标记定量的方法筛选差异表达的磷酸化蛋白,揭示了禁食对小鼠下丘脑中蛋白质磷酸化的影响.
1 材料与方法
1.1 材 料
1.1.1 实验动物
9只8周龄SPF 级C57BL/6雄性小鼠,购自北京维通利华实验动物技术有限公司,使用许可证编号:SYXK(军)2015-0004,饲养于国家蛋白质科学中心动物饲养平台,其室温、湿度、饮食、饮水均符合标准实验动物饲养条件.购买后将小鼠适应性饲养2周,以减少生活环境变化对小鼠生理的影响.
1.1.2 主要试剂
尿素购自AMRESCO公司;HEPES、磷酸酶抑制剂(phosphatase inhibitor,PPI)、二硫苏糖醇(DL-dithiothreitol,DTT)、吲哚乙酸(iodoacetamide,IAA)、乳酸(lactic acid,LA)购自SIGMA公司;超滤管(截留分子量10000)购自Merck Millipore公司;蛋白酶抑制剂(protease inhibitor,PI)购自Roche公司;三氟乙酸购自ACROS公司;质谱级Trypsin酶购自北京华利世科技有限公司;TiO2(二氧化钛)购自GL Science公司;乙腈(acetonitrile,CAN)购自AVANTOR公司;氨水购自霍尼韦尔(中国)有限公司;BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;Pierce™荧光定量肽段试剂盒购自ThermoFisher Scientific公司.
1.1.3 主要仪器
真空离心浓缩仪购自Eppendorf公司;恒温箱购自湖南力辰仪器科技有限公司;超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;超低温高速离心机、Nanodrop One超微量分光光度计、EASY-nLC 1000-Orbitrap Fusion液质联用质谱仪购自ThermoFisher Scientific公司.
1.2 方 法
1.2.1 动物模型构建
禁食9只小鼠48h后,为部分小鼠供应绿色饲料.从提供绿色饲料到小鼠排出第一颗绿色粪便的时长约为4h,因此将禁食后恢复时间设定为4h.解剖并观察对比正常饮食小鼠(con组)、禁食48h小鼠(D2组)和禁食后恢复4h饲料小鼠(DR组)的肠胃组织,我们发现相较于con组,D2组的肠胃更为干瘪,而DR组的肠胃更为饱满.根据饱腹程度的差异,相比于con组,D2组为食欲增强组,DR组为食欲减弱组.为控制生物节律一致,将造模的总时长设为48h,即con组正常进食48h、D2组禁食48h、DR组禁食44h再提供食物4h.
1.2.2 下丘脑组织的获取
造模完成后,将小鼠脱颈处死并迅速开颅取出脑组织,分离出下丘脑组织于含有蛋白酶抑制剂与磷酸酶抑制剂的低温生理盐水中洗净,放于液氮中保存.待所有小鼠下丘脑组织取出后,放置于-80℃低温保存.
1.2.3 蛋白样品的制备
将下丘脑组织处于裂解液环境中,用组织研磨器在冰上裂解.裂解液组成为8mol/L尿素、20mmol/L HEPES、1%(体积分数)磷酸酶抑制剂和1%(体积分数)100倍的蛋白酶抑制剂,每个样品用量为900μL.裂解后进行超声处理2min,超声仪设置30%功率、开2s、关2s,4℃、14000离心10min取上清.用BCA试剂盒测量样品蛋白浓度,取出一定质量的蛋白质,按照100∶1(蛋白质溶液体积∶DTT溶液体积)加入1mol/L DTT溶液,37℃水浴加热1h.按照50∶1(蛋白质溶液体积∶IAA溶液体积)加入1mol/L IAA溶液,室温避光反应30min.按照100∶1(蛋白质溶液体积∶DTT溶液体积)加入1mol/L DTT溶液,室温避光反应15min.
1.2.4 蛋白质提纯
取截留分子量为10000的超滤管,加入样品,室温14000离心30min.加入400μL浓度为50mmol/L的碳酸氢铵溶液,14000离心30min洗涤并重复两次.
1.2.5 蛋白质酶解
将离心管换成新的离心管,在超滤管中加入200μL的50mmol/L碳酸氢铵溶液和一定体积的质量浓度为0.5μg/μL的Trypsin酶溶液(其中蛋白与酶的质量比为25∶1),37℃孵育过夜.室温14000离心20min,加入400μL碳酸氢铵溶液14000离心20min并重复一次.取出离心管中溶液,于60℃真空抽干.
1.2.6 磷酸化肽段富集
用200μL BB(binding buffer)溶解肽段干粉,静置20min后10000离心5min,取上清.按TiO2和蛋白质质量比为9∶1的比例取TiO2,并分成3等份,并各加500μLBB,垂直混匀5min,1000离心1min去上清并重复2次.将肽段溶液与TiO2混合,垂直混匀结合30min,1000离心1min.吸取上清并与下一份TiO2混合,重复上一步骤.直至肽段溶液与3份TiO2全部结合后弃去上清,将3份TiO2混合.将混合后的TiO2用500μL BB、500μL WB1 (washing buffer1)、500μL WB2(washing buffer2)各洗2次,每次清洗均需垂直混匀10min,1000离心1min去上清.用200μL EB(elution buffer)和TiO2混合,垂直混匀洗脱10min,1000离心1min并取上清,重复一次.合并两次上清于60℃真空抽干.其中BB为70%ACN+5%TFA+8.3%LA+ddH2O,WB1为30%ACN+0.5%TFA+ddH2O,WB2为80% ACN+0.5%TFA+ddH2O,EB为40%ACN+15%氨水+ddH2O,均为体积分数.
1.2.7 LC-MS设定
将样品溶于20μL 0.1%(体积分数)FA溶液.用nanodrop测得肽段浓度后,取500ng肽段的溶液注入液相.肽段经进样针吸附在预柱上(C18填料:直径3μm).用不同比例的A相溶液(0.1%FA)和B相溶液(100%ACN)洗脱预柱上的样品.样品在分析柱(C18填料:直径1.9μm)上被进一步分离后进入质谱仪.液相流速设置为600nL/min、总时长为78min,洗脱梯度为:0min,5%B;2min,7%B;10min,10%B;50min,20%B;70min,30%B;71min,90%B;78min,90%B.质谱仪采用正电荷模式,电喷雾电压为2300V,离子传输管温度为320℃.一级扫描为轨道阱(orbitrap),分辨率为120000,质谱扫描范围(/)为300~1400,自动增益控制目标为5e5,最大注入时间为100ms.二级扫描为离子阱(ion trap)采用高能诱导裂解(high-energy C-trap dissociation,HCD)/为120的母离子,碎裂能量为32%,扫描范围设为自动,自动增益控制目标为5e3,最大注入时间为35ms.
1.2.8 蛋白的定性和定量
质谱数据RAW文件统一使用MaxQuant(版本为1.5.3.8)进行搜库分析,搜索引擎为Andromeda,检索所用数据库为UniProtKB的小鼠全蛋白序列库(17008个reviewed的蛋白,2019年4月更新)[11].选择非标记定量方法(lable free quantification),勾选“iBAQ”.设置母离子质量误差为20×10-6,子离子质量误差为0.5,FDR(假阳性率)<1%,最小肽长度为7个氨基酸,允许肽最多有2个漏切位点,固定修饰为carbamidomethyl(C),可变修饰为oxidation(M)和phosphorylation(STY).
1.3 生物信息分析
使用R(版本4.0.2)和Rstudio(版本1.3.1056.0)对数据进行z-score归一化、t-test检验、ANOVA方差分析等处理,计算组间相关性,统计各组磷酸化位点、肽段和蛋白数量,分析各组间差异并挑选出差异蛋白.使用DAVID Bioinformatics Resources 6.8进行GO(gene onology)功能富集分析和KEGG(kyoto encyclopedia of genes and genomes)通路分析.
2 结 果
2.1 下丘脑磷酸化蛋白质组数据处理
对MaxQuant搜库结果设置localization score>0.75,去除污染后共鉴定到了4810个蛋白质,对应于14259个磷酸化位点发生了变化.对结果进一步筛选处理,设定3次重复实验中至少鉴定到2次的数据为有效数据.各组筛选得到的蛋白质数量分别为con组713个、D2组509个、DR组550个,磷酸化肽段数量分别为con组1979个、D2组1198个、DR组1433个.
对比3组数据统计发现,鉴定到的蛋白质总数为820个,3组共有的蛋白质数量为390个(图1(a));磷酸化肽段总数为2396,3组共有的肽段为836条(图1(b));磷酸化位点总数为5545个.对用z-score归一化处理的磷酸化位点数据进行了Pearson相关性分析(图1(c)),Pearson相关系数均在0.7及以上,说明非标记定量的有效性.
2.2 差异磷酸化位点的聚类分析
对D2/con(图2(a))、DR/con(图2(b))、DR/D2 (图2(c))的磷酸化位点分别做统计分析,并用火山图呈现,设置差异倍数(FoldChange)大于2为上调、小于0.5为下调,值小于0.05为差异显著.D2/con中,下调位点数量为289,上调位点数量为345;DR/con中,下调位点数量为176,上调位点数量为103;DR/D2中,下调位点数量为52,上调位点数量为98.对比3次火山图分析的差异显著位点发现,相较于D2/con和DR/con,DR组与D2组的差异位点数量更少.这可能是由于DR组小鼠从食欲很强的饥饿状态到食欲最弱的饱腹状态的时长间隔只有4h,许多蛋白质的磷酸化修饰状态还未稳定,这一状况还有待通过其他实验继续研究.

图1 磷酸化蛋白质组学质谱数据定量分析
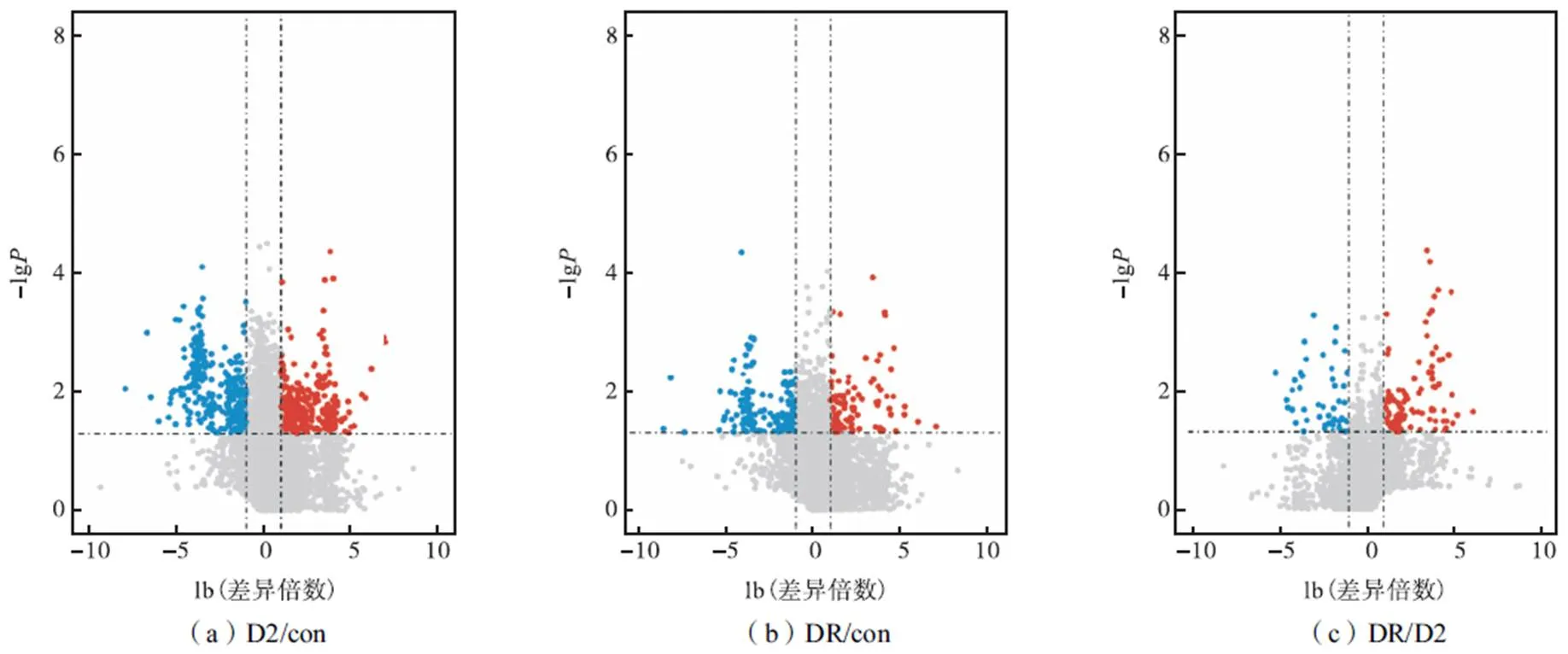
图2 磷酸化修饰位点丰度水平差异火山图
接下来对3组中差异显著的磷酸化修饰位点的归一化数据进行ANOVA分析和CV(变异系数)值筛选,并制作层次聚类分析热图(图3),发现D2组和DR组磷酸化修饰水平差异较小,但和con组相比,D2组和DR组变化较为明显.

图3 不同组中磷酸化位点丰度热图
2.3 差异磷酸化修饰蛋白质的GO富集分类和KEGG通路富集分析
进一步对D2/con、DR/con和DR/D2中显著差异的磷酸化位点所对应的681个蛋白进行GO功能注释分析(https://david.ncifcrf.gov/home.jsp),分别从生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)3个方面进行分析.
选取FDR小于0.05,共获得73条注释信息.从3个方面的分析中各选取10条富集蛋白较多的注释制作GO功能富集分析柱状图(如图4所示).根据GO功能富集分析结果发现,分子功能集中在蛋白结合(protein binding)、GTP酶活化物活动(GTPase activater activity)、肌动蛋白结合(actin binding)等;细胞组分集中在细胞质(cytoplasm)、突触(synpase)、细胞连接(cell junction)等;生物学过程集中在转运(transport)、轴突生成(axonogenesis)、细胞黏附(cell-cell adhesion)等.
对这681个差异蛋白进行KEGG代谢通路信号分析.共获得46条不同的代谢通路,值<0.01且蛋白数量>10的有11个(如图5所示),其中MAPK (mitogen-activated protein kinase)信号通路(MAPK signaling pathway)、内噬作用(endocytosis)、环磷酸腺苷信号通路(cAMP signaling pathway)、Ras信号通路(Ras signaling pathway)、肌动蛋白细胞骨架调节(regulation of actin cytoskeleton)等富集程度较高.这一结果提示,蛋白质的磷酸化修饰在小鼠下丘脑食欲信号传导途径中发挥着重要的作用.

图4 差异磷酸化蛋白的GO功能富集分析

图5 差异磷酸化蛋白的KEGG信号通路分析
3 讨 论
下丘脑位于大脑腹面、丘脑的下方,参与调节自主神经系统,是调节内脏和内分泌活动的中枢.下丘脑分为多个区域,其中腹内侧核(ventromedial nucleus,VMH)是食欲抑制中心,下丘脑外侧是食欲增强中心.本研究通过干预小鼠进食,使不同组小鼠的食欲产生差异,观察不同食欲期的小鼠下丘脑中磷酸化蛋白质组的区别.通过质谱鉴定、蛋白搜库和R语言处理,筛选出了681个蛋白质的磷酸化位点有显著差异.这些差异表达的蛋白质的分子功能涉及参与多种细胞活动、物质能量转换和磷酸化修饰过程,主要负责分子间的结合和催化,并且参与MAPK信号通路、内噬作用、环磷酸腺苷信号通路、Ras信号通路等相关通路.
本研究通过对显著差异蛋白进行GO功能富集的分析发现,34.4%的蛋白质的功能与蛋白结合相关.其中部分的蛋白质与食欲直接或间接相关,如突触结合蛋白7(synaptotagmin-7,SYT7)、胰岛素受体底物(insulin receptor substrate,IRS).在胰腺β细胞中SYT7的磷酸化可以调节胰岛素的释放,并且不会改变Ca2+的分泌依赖性[12].SYT7在胰腺α细胞中为胰高血糖素的分泌起Ca2+传感器的作用[13].SYT7通过增加钙离子水平、促进ATP的生成,促进了胰高血糖素的分泌.胰岛素和胰高血糖素在体内共同起着调节血糖的作用,分别增强和抑制食欲.因此,SYT7蛋白及其磷酸化水平的变化在一定程度上影响着小鼠能量摄取行为.胰岛素受体底物(insulin receptor substrate,IRS)是胰岛素信号通路中参与细胞增殖、代谢和生存的主要成分,被激活的酪氨酸激酶可以使其磷酸化修饰发生变化.在阿尔茨海默症和Ⅱ型糖尿病中,IRS的磷酸化修饰变化引起的胰岛素抵抗是其最主要的特征.胰岛素抵抗会改变糖代谢,并引起IRS-1(Ser307)过磷酸化,引发食欲亢进,出现高血糖、肥胖、血脂异常等症状[14-15].其他的一些基因,如TNIK与ATP结合相关、BSN与金属离子结合相关、CTNNA1与肌动蛋白的结合相关及CHCHD3与DNA结合转录抑制因子活性、RNA聚合酶Ⅱ特异性相关等,这些基因对应蛋白的磷酸化水平的变化提示蛋白结合的变化可能对小鼠摄食行为的研究具有重要的意义.
本研究的通路富集分析证实有多达23个蛋白与MAPK信号通路相关,如MEF2C编码的心肌细胞特异性增强因子2C(myocyte-specific enhancer factor 2C)、TAOK3编码的丝氨酸/苏氨酸蛋白激酶TO3(serine/threonine-protein kinase TAO3)、NF1编码的神经纤维蛋白(neurofibromin)、PPM1A编码的蛋白磷酸酶1A(protein phosphatase 1A)、MAPT编码的微管结合蛋白tau(microtubule-associated protein tau)等.MAPK信号通路包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和丝裂原活化蛋白激酶(MAPK),这3种激酶能依次激活,共同调节着细胞的生长分化、对环境的应激适应、炎症反应等多种重要的细胞生理病理过程[16-17].MAPT在整个中枢 神经系统的神经元中广泛表达,负责编码组装tau 蛋白[18].
tau磷酸化是其最重要的翻译后修饰,受蛋白激酶和磷酸酶调节,与神经变性的发病机理密切相关. MAPT编码区的突变会引起tau蛋白表达失调和错配,异常的tau蛋白会过度磷酸化并聚集,从而会导致微管崩解和轴突运输功能障碍引起额颞叶痴呆伴帕金森病等神经性疾病[19-20].
MKP1是一种MAPK磷酸酶,MKP1的肝脏特异性缺失会增强高脂饮食小鼠体内的糖异生,并会引起肝胰岛素抵抗,并且MKP1可能会减少p38和JNK MAPK介导的糖异生基因的转录以及p38MAPK介导的环AMP响应元件结合蛋白(CREB)的磷酸化[21].从MAPK信号通路图(https://www.kegg.jp/kegg-bin/ show_pathway?map04010)中,显而易见MKP会抑制ERK并将其去磷酸化,ERK又能促进tau的磷酸化,从而MKP磷酸化修饰状态的变化会间接影响tau的磷酸化水平,最终引起小鼠体内肝胰岛素抵抗和摄食增加.
虽然获得了受禁食影响而发生磷酸化修饰水平变化的蛋白质及相关的通路等,但是还有待进一步的实验对显著差异的蛋白进行生物学验证.
4 结 语
本研究对小鼠进行禁食,获取了小鼠下丘脑中磷酸化蛋白质数据,进一步分析发现小鼠下丘脑中SRRM2、CAC1A、BSN、HYCCI等681个蛋白的磷酸化受到影响,进而影响蛋白结合、激酶行为、转运、轴突生成等分子活动和生物学过程,并影响MAPK通路、细胞内噬等信号通路.通过禁食实验,得以理解蛋白质的磷酸化修饰如何在小鼠下丘脑中发挥调节作用,希望可以为摄食调控和药物代谢研究提供重要的数据资源和参考.
[1] Mattes R D,Hollis J,Hayes D,et al. Appetite:Measurement and manipulation misgivings[J]. J Am Diet Assoc,2005,105(5 Suppl 1):87-97.
[2] Andrew C,Shin N F C L,Buettner C. Insulin receptor signaling in Pomc,but not AgRP,neurons controls adipose T[J]. Diabetes,2017,66(6):1560-1571.
[3] 朱永香,王 倩,王 爽,等. 肥胖与食欲调控机制[J]. 吉林大学学报(医学版),2013,39(5):1067-1071.
Zhu Yongxiang,Wang Qian,Wang Shuang,et al. Obesity and mechanisms of appetite regulation[J]. Journal of Jilin University(Medicine Edtion),2013,39(5):1067-1071(in Chinese).
[4] Ressurreição M,Rollinson D,Emery A M,et al. A role for p38 mitogen-activated protein kinase in early post-embryonic development of schistosoma mansoni[J]. Molecular and Biochemical Parasitology,2011,180(1):51-55.
[5] Wang Y,Chen S,Li H. Hydrogen peroxide stress stimulates phosphorylation of FoxO1 in rat aortic endothelial cells[J]. Acta Pharmacologica Sinica,2010,31(2):160-164.
[6] Bu Y H,He Y L,Zhou H D,et al. Insulin receptor substrate 1 regulates the cellular differentiation and the matrix metallopeptidase expression of preosteoblastic cells[J]. Journal of Endocrinol,2010,206(3):271-277.
[7] Lian I,Kim J,Okazawa H,et al. The role of YAP transcription coactivator in regulating stem cell self-renewal and differentiation[J]. Genes & Development,2010,24(11):1106-1118.
[8] Wood C D,Thornton T M,Sabio G,et al. Nuclear localization of p38 MAPK in response to DNA damage[J]. International Journal of Biological Sciences,2009,5(5):428-437.
[9] Dittmann A,Kennedy N J,Soltero N L,et al. High fat diet in a mouse insulin resistant model induces widespread rewiring of the phosphotyrosine signaling network[J]. Molecular Systems Biology,2019,15(8):e8849.
[10] Rivera P,Ramírez López M T,Vargas A,et al. Perinatal free‐choice of a high‐calorie low‐protein diet affects leptin signaling through IRS1 and AMPK dephosphorylation in the hypothalami of female rat offspring in adulthood[J]. Acta Physiologica,2019,226(2):e13244.
[11] Sacco F,Seelig A,Humphrey S J,et al. Phosphoproteomics reveals the GSK3-PDX1 axis as a key pathogenic signaling node in diabetic islets[J]. Cell Metab,2019,29(6):1422-1432.
[12] Wu B,Wei S,Petersen N,et al. Synaptotagmin-7 phosphorylation mediates GLP-1-Dependent potentiation of insulin secretion from Β-cells[J]. Proceedings of the National Academy of Sciences—PNAS,2015,112(32):9996-10001.
[13] Zhang Y,Wu F,Iqbal K,et al. Subacute to chronic alzheimer-like alterations after controlled cortical impact in human tau transgenic mice[J]. Scientific Reports,2019,9(1):3789.
[14] De Sousa R A L,Harmer A R,Freitas D A,et al. An update on potential links between type 2 diabetes mellitus and alzheimer’s disease[J]. Molecular Biology Reports,2020,47(8):6347-6356.
[15] 张健维,王俊博,王梦远,等. 胰岛素对代谢的中枢调控作用[J]. 生理科学进展,2018,49(6):401-410.
Zhang Jianwei,Wang Junbo,Wang Mengyuan,et al. Central action of insulin on metabolism[J]. Progress in Physiological Sciences,2018,49(6):401-410(in Chinese).
[16] Guo Y,Pan W,Liu S,et al. ERK/MAPK signalling pathway and tumorigenesis[J]. Experimental and Therapeutic Medicine,2020,19(3):1997-2007.
[17] Oh C C,Lee J,D’Souza K,et al. Activator protein-1 and caspase 8 mediate P38α MAPK-dependent cardiomyocyte apoptosis induced by palmitic acid[J]. Apoptosis(London),2019,24(5/6):395-403.
[18] Strang K H,Golde T E,Giasson B I. MAPT mutations,tauopathy,and mechanisms of neurodegeneration[J]. Laboratory Investigation,2019,99(7):912-928.
[19] Wang Z,Wang Z,Tan L,et al. Axonal transport defects in Alzheimer’s disease[J]. Molecular Neurobiol-ogy,2015,51(3):1309-1321.
[20] Spillantini M G,Goedert M. Tau pathology and neurodegeneration[J]. The Lancet Neurology,2013,12(6):609-622.
[21] Lawan A,Zhang L,Gatzke F,et al. Hepatic mitogen-activated protein kinase phosphatase 1 selectively regulates glucose metabolism and energy homeostasis[J]. Molecular and Cellular Biology,2015,35(1):26-40.
Effect of Fasting on the Phosphoproteome of Mouse Hypothalamus
Wang Mengfan1,Hong Jie1, 2,Wang Qianqian2,Yao Di2,Jia Chenxi2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China;2. State Key Laboratory of Proteomics,Beijing Institute of Life Omics,Beijing 102206,China)
Determining the effect of fasting on the protein phosphorylation and related signaling pathways in the hypothalamus of mice provides valuable information for improving the regulatory network of protein phosphorylation. The mice were divided into three groups(with three mice in each group):control group(con),fast group(D2),and recovery group after fasting(DR). Within 48h,con was fed with a normal diet;D2 was fasted;DR was fasted for the first 44h and was then provided with a normal diet for the next 4h. The hypothalamus was extracted from the three groups at the same time. The protein of the hypothalamus tissues was extracted,purified,and enzymolyzed. The digested peptides from the hypothalamus were treated with TiO2to enrich the phosphorylated peptides. The phosphorylated proteins were identified by high-throughput liquid chromatography-mass spectrometry(HPLC-MS). The label-free quantitative method was used to identify the differentially expressed phosphorylated proteins. GO enrichment analysis and KEGG pathway analysis were carried out to explore the potential functions of these proteins. Results showed that 4810 phosphorylated proteins were identified corresponding to 14259 phosphorylation sites. There were 681 phosphorylated proteins in the hypothalamus of mice that were greatly affected by fasting,which were related to molecular activities and biological processes,such as protein binding,kinase activity,transport,and axonogenesis. These proteins were mainly classified into 11 signaling pathways,including MAPK signaling pathways,endocytosis,and cAMP signaling pathway. The phosphoproteome of the mouse’s hypothalamus can be significantly affected by fasting,which provides valuable information for improving the regulatory network of the hypothalamic phosphorylation signal in mice.
appetite;fasting;hypothalamus;proteome;phosphorylation
10.11784/tdxbz202101020
Q816
A
0493-2137(2022)04-0357-07
2021-01-12;
2021-04-28.
王梦凡(1983— ),女,博士,副教授,mwang@tju.edu.cn.
贾辰熙,cjia@mail.ncpsb.org.
国家重点研发计划资助项目(2016YFA0501302,2017YFA0505702);国家自然科学基金资助项目(21675006);国家重大科研资助项目(BWS17J025).
Supported by the National Key Research and Develepment Program of China(No. 2016YFA0501302,No. 2017YFA0505702),the National Natural Science Foundation of China(No. 21675006),the National Key Research Program of China(No. BWS17J025).
(责任编辑:田 军)

