非洲猪瘟诊断技术研究进展
苗 春,李 伟,杨思成,邵军军,常惠芸
(中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,OIE/国家口蹄疫参考实验室,甘肃兰州 730046)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的一种急性、高度接触性、高致病性传染病。ASFV 是非洲猪瘟病毒科的唯一成员,也是目前已知的唯一DNA 虫媒病毒。ASFV 基因组是一个大型线状双链DNA 分子,主要在单核巨噬细胞及网状内皮细胞中复制,长度为170~190 kbp,编码150 多种蛋白,包含中间保守区和两端可变区[1]。根据p72 蛋白编码基因(B646L)末端约500 bp 核苷酸的差异,已鉴定出24 种ASFV 基因型[2]。世界动物卫生组织(OIE)将ASF 列入须通报动物疫病名录,我国将其列为一类动物疫病[3]。目前暂无有效疫苗来预防该病。感染ASFV 会产生各种综合症,从最急性、急性到慢性,以及无症状的病毒携带,最主要临床特征表现为高热、出血和全身皮肤发绀坏死,尸体剖检可见脾脏充血、肿大,淋巴结、肝脏和肾脏出血等。这些临床特征及病理变化与猪瘟(CSF)、猪皮炎和肾病综合征(PDNS)以及猪繁殖与呼吸综合征(PRRS)尤为相似,难以鉴别,所以需要借助实验室诊断来确诊[4]。
本文综述了目前应用的ASFV 检测技术,并对各种方法优缺点进行比较分析,同时探讨了未来诊断技术发展趋势,以期为我国ASF 防控提供技术参考。
1 ASF 病原学检测
1.1 病原检测
1.1.1 病毒分离鉴定 ASFV 感染动物后,主要在单核巨噬细胞系统(单核细胞和巨噬细胞)中复制,并通过淋巴系统和血液循环系统扩散到肝、肾等器官。《OIE 陆生动物诊断试验与疫苗手册》要求,ASFV 分离必须在BSL-3 及以上生物安全实验室进行,且需要从血液、脾脏、肝脏、淋巴结和扁桃体等组织样本中分离病毒,用于下一步的实验室诊断。
1.1.2 红细胞吸附试验(haemadsorption test,HAD) 红细胞吸附性是在1960 年由Malmquist和Hay 首次发现的。ASFV 会粘附于猪的单核细胞或巨噬细胞表面,产生特征性的“玫瑰花环”现象。采集发病猪的血液或组织悬液接种到猪原代骨髓细胞(PBM)、原代白细胞或肺泡巨噬细胞中进行培养,6 d 后确定结果。通常,如果样本呈强烈阳性,则会在培养后24~48 h 出现血液吸附而形成特征性的“玫瑰花环”现象。为防止非特异性的红细胞吸附,培养基中需添加猪血清或血浆[5]。虽然该方法敏感性高、成本低,但需要进行原代细胞培养,时间周期长,而且现已分离出少量“非血吸附”的ASFV,其中大多数是低毒性的,不产生红细胞吸附现象,所以HAD 不再是检测ASFV 的首选方法,一般将HAD 与病毒分离鉴定作为ELISA、PCR 或FAT 阳性结果确认的参考试验[6]。
1.2 核酸检测
1.2.1 PCR PCR 全称为聚合酶链式反应,由变性、退火、延伸3 个基本反应步骤构成,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR用于检测血液、血清或器官样本中的ASFV 基因组,在ASFV 感染早期就可通过PCR 检测到ASFV。病毒脱氧核糖核酸的小片段可通过PCR 扩增到可检测的数量。该方法快速、敏感性高、特异性强。所有已知基因型的病毒分离株,包括非血液吸附毒株和低毒力分离毒株,都可以用PCR 检测,甚至灭活或降解的样品都可以检测。Agüero 等[7]发现,ASFV 引物集可以与CSFV 的特定引物集相结合,采用多重反转录PCR(RT-PCR)方法,可以在一次反应中同时区分并检测两种病毒基因组。然而,PCR 敏感性高,样品稍有交叉污染,就会导致假阳性结果。为此,Luo 等[8]基于GenBank 中所有ASFV 毒株VP72基因序列的高度保守区,设计了ASFV 特异性引物,建立了PCR 检测方法,并与两个OIE 验证的PCR 检测进行了比较,结果表明灵敏性和特异性都高于OIE 推荐的PCR 方法。
1.2.2 实时荧光定量PCR(quantitative real-time PCR,qPCR) qPCR 是通过对体系中加入的荧光基团产生的信号进行实时收集积累,最后用标准曲线对未知模板进行定量分析的方法。与基于凝胶的常规PCR 方法相比,qPCR 方法具有快速、灵敏度高、不易交叉污染,以及可以定量分析的优点,现已成为病原学诊断中应用最广泛的方法。King等[9]首次根据ASFV 的VP72基因设计特异性引物和探针,建立了一种TaqMan qPCR 来快速检测ASFV DNA,灵敏度在10~100 个分子之间,并针对不同地区25 株代表9 个基因型(I、III、IV、V、VI、VII、VIII、IX、X)的ASFV 分离株和16个非洲、欧洲蜱分离株进行了验证,结果没有发现与相关的猪病毒发生交叉反应。Zsak 等[10]也基于VP72基因建立了一种实时TaqMan PCR 方法,可以通过使用便携式检测仪器实时获得检测结果,从而简化聚合酶链反应操作程序。该方法比OIE 推荐的常规PCR 和qPCR 具有更高的灵敏度。现已成为病原学诊断中应用最广泛的方法。
1.2.3 多重PCR(multiplex polymerase chain reaction,mPCR) 多重PCR 是在常规PCR 的基础上进行改进的,在本身体系结构中增添更多的引物来进行扩增,因目标片段之间有着较大的差异性,所以通过凝胶成像能直接进行分析,是一种应用范围更广、更加有效的PCR 新技术[11]。Giammarioli 等[12]基于猪瘟病毒(CSFV)、ASFV、猪圆环病毒2 型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)和猪细小病毒(PPV)基因组设计特异性引物,开发了一种新的热启动mPCR 方法,可同时检测猪的多种病毒感染。
1.2.4 微滴数字PCR(droplet digital polymerase chain reaction,ddPCR) ddPCR是第三代PCR技术,可以在不使用标准样品的情况下绝对定量核酸。它先对样品进行微滴化处理,然后经PCR 扩增,再对每个微滴进行检测,最后根据泊松分布原理及阳性微滴的个数与比例得出靶分子的起始拷贝数或浓度。该方法更精确、更数字化,灵敏度更高。Wu 等[13]基于ASFVK205R基因的高度保守区域设计特异性引物和TaqMan 探针,建立了一种准确、灵敏的ASFV ddPCR 检测方法。ddPCR 的最小检测限约为10 拷贝/反应,而qPCR 的检测限为102拷贝/反应,因此ddPCR 的检测灵敏度是qPCR 的10 倍。
1.2.5 巢氏PCR(nested-PCR) 巢式PCR 涉及两组引物,用于连续两次的聚合酶链反应,第二组引物用于扩增第一批产物中的第二个靶标,一般适用于一些有必要增加灵敏度和/或特异性的PCR反应。Basto 等[14]首次建立了一种带有内部对照的巢式PCR 检测方法,用于检测不同蜱种中的ASFV DNA。检测蜱类中的ASFV 感染状态,有助于确定该地区有无ASFV 感染。
1.2.6 环介导等温扩增技术(loop mediated isothermal amplification,LAMP) LAMP 是 用于DNA 扩增的单管技术,使用两套或三套引物和一种具有复制活性、高链置换活性的聚合酶,可在15~60 min,60~65 ℃的恒定温度下扩增靶序列,是一种更简便、快速、精确,且成本低的扩增方法。Wang 等[15]设计了针对ASFVP10基因的LAMP 引物,并用伪狂犬病病毒(PRV)、PCV2、CSFV、PRRSV、PPV 和ASFV 的DNA 或cDNA 验证实时LAMP 和可视化检测的特异性,证实LAMP 可以准确和特异性检测ASFV。Zhu 等[16]通过将Hive-Chip 和LAMP 相结合,设计针对5 个ASFV 基 因(B646L、B962L、C717R、D1133L 和G1340L)的LAMP 引物,并将其预固定在Hive-Chip 中,结果发现靶基因之间没有交叉反应。该方法无需核酸提取,不依赖精密仪器,可避免因病毒的单个基因突变引起的假阴性问题,且灵敏度高、特异性强,检测结果可视化。Wang 等[17]根据ASFVP72基因高度保守区域设计引物,建立以中性红为显色指示剂的视觉LAMP 检测方法,其特异性高,不与其他猪病毒出现交叉反应,与OIE推荐的qPCR 方法敏感度相当。
1.2.7 重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA) RPA 技 术是由Piepenburg 等[18]在2006 年建立的一种等温核酸扩增技术。该技术不需要模板的热变性,反应温度为37~42 ℃,扩增反应时间一般为10~20 min。Miao等[19]开发了一种将ASFVP72基因的 RPA 与侧流检测(LFD)相结合的快速检测方法。RPALFD 法对ASFV 具有高度灵敏性和特异性,并且与CSFV 等其他猪病毒没有交叉反应。哈登楚日亚等[20]建立了ASFV 实时荧光RPA 检测方法。该方法在39 ℃,20 min 内可检测10 个拷贝的DNA 分子,并且与CSFV、PCV2、PPV、PRV 都无交叉反应,可用于ASFV 的定性检测。Wang 等[21]也将RPA 与LFD 相结合,开发了一种用于ASFV 现场诊断的金纳米颗粒试纸条,称为侧向流动基因检测(lateral flow gene assay,LFGA)。该方法使用尾部引物来产生一端具有单链尾部的双链体。该双链体与金纳米粒子(AuNP)标记的探针杂交,使标记在检测探针上的金纳米粒子在试纸条的测试线上显示红色带,即为阳性。在较低的反应温度和较短的反应时间下,LFGA 可以特异性区分ASFV 和CSFV,检测限为102拷贝/μL,灵敏度与琼脂糖凝胶电泳相当,整个操作过程不需要任何昂贵的仪器,并且快速、特异、操作简单,对ASFV 的早期诊断非常有帮助。目前,随着CRISPR/Cas 技术的不断发展,已经有研究[22]将RPA 和CRISPR/Cas12a相结合来实现更高的灵敏度,并提供了对条带的高灵敏度荧光检测。这在实现多基因检测的同时,为更灵敏、更快速的ASFV 诊断提供了启示。
1.2.8 交叉引物扩增技术(cross priming amplification,CPA) CPA 是一类等温核酸扩增反应,利用交叉引物和探针,能够在1 h 内扩增出至少4 个拷贝的基因组DNA,具有高度特异性。CPA 方法依赖于具有链置换活性的DNA 聚合酶,通过链置换进行核酸扩增。该技术是我国首个具有自主知识产权的核酸扩增技术[23]。Frączyk 等[24]基于P72基因,设计了一组CPA 引物,可以特异性检测猪和野猪血液、血清样本中的ASFV DNA以及CSFV DNA,无需提取DNA,无交叉反应性,检测灵敏度与qPCR 一致。CPA 高度敏感,可在水浴中进行,无需使用热循环器。这种快速检测技术为储存、运输和销毁怀疑感染ASFV 病毒的材料提供了更好的生物安全措施[24]。
1.2.9 原位杂交技术(in situ hybridization,ISH) ISH 就是将标记的核酸探针与细胞或组织中的核酸进行杂交,目前已发展出荧光原位杂交技术(FISH)以及多彩色荧光原位杂交技术(mFISH)。FISH 克服了放射性探针检测周期长且危害人体健康的缺点,被广泛应用于基因定位、染色体识别等研究中。Bentolila 等[25]进行了小鼠的量子点荧光原位杂交(QD-FISH),发现QD-FISH 探针可穿透完整的间期细胞核和中期染色体,并显示出对致密染色质结构域的良好靶向,且空间位阻最小,表明QD-FISH 探针在QD-FISH 应用中十分有效。Ballester[26]开发了一种新ISH 法,使用地高辛标记探针,来鉴定用福尔马林固定、石蜡包埋组织中的ASFV 基因组,检测效果良好。
1.2.10 生物传感器技术 该方法通过生物识别元件识别分析物,然后换能器将生物识别元件捕获目标分析物后发生的反应转换成等效信号,最后由检测器系统将信号进行处理和分析,从而得到分析结果[27]。Biagetti 等[28]利用DNA/LNA 探针作为ASFVVP72基因保守区的互补识别元件,建立了一种基于生物传感器的方法来检测猪血液中的ASFV。其检测限(LOD)和定量限(LOQ)分别为178 拷贝/μL 和245 拷贝/μL,该结果和OIE推荐的qPCR 敏感性相当。该方法可用于ASF 的初步诊断及筛检,具有快速、简便、成本低的优点。Wu 等[29]将PCR、Cas12a 和侧流生物传感器(LFB)结合起来,基于Cas12a 的生物传感器靶向不同ASFV 菌株中VP73基因的保守区域,同时检测7 种不同基因型的ASFV 病毒。该方法具有极高特异性和灵敏性,而且操作简便、价格低,可以普遍用于检测ASFV 和其他病毒。
2 血清学检测
2.1 抗体检测
2.1.1 酶联免疫吸附试验(ELISA) ELISA 是目前血清检测最常用的方法,也是OIE 指定的ASF 首选血清学诊断方法。ELISA 的敏感性、特异性都较高,操作方便快速,适用于检测多头猪样本,能够快速检测群体中的ASFV 抗体。但是,当检测样品发生降解或在-20 ℃放置太长时间时,ELISA 检测的灵敏度就会降低。目前,常用作检测ASFV 抗原的蛋白有p30、p54、p72、pp62 等。Gallardo 等[30]通过使用杆状病毒表达p30、p54 和pp62 重组蛋白建立的重组ELISA 检测方法,不仅显示出比OIE 推荐方法(ELISA)更高的灵敏度,而且还减少了检测出假阳性的概率,极大程度提高了检测的准确性。Giménez-lirola[31]等基于多重荧光微珠的免疫测定法(FMIA)对ASFV 的3 种重组多肽(p30、p54、p72)感染猪后产生的早期血清抗体进行比较,以选择最佳候选抗原,结果发现p30 是早期诊断的最佳抗原;通过表达ASFV p30蛋白,开发了一种能够检测血清或口腔液标本中ASFV 抗体的间接酶联免疫吸附试验(I-ELISA),其对两种样本类型都具有高度特异性,而且在8 DPI 时,就可以检测到口腔液抗体,与OIE 推荐的I-ELISA 敏感度相当。
2.1.2 间接荧光抗体试验(indirect fluorescent anti-body test,IFA) IFA 是一种免疫标记技术,应用荧光标记的二抗,通过与抗原抗体复合物中的抗体结合而检测未知抗原。Heimerman 等[32]通过对ASFV 感染的Vero 细胞进行免疫荧光抗体(IFA)染色,共回收了29 种单克隆抗体(mAb),并对其中的IFA 阳性抗体进行进一步表征,发现这些抗体均位于p72 的高度保守区域内,这为开发新的ASFV 抗体和抗原检测方法提供了机会。Wu 等[33]开发了一组针对ASFV p30 的mAb,并对其中的14 种进行检测,通过IFA 等方法检测发现,这些抗原区域3 和4 在宿主抗体反应中高度保守并具有免疫优势,从而为ASF 血清学检测的开发和改进提供了有价值的工具。
2.1.3 胶体金快速免疫层析法(gold immunochromatography assay,GICA) GICA 是一种以胶体金标记的抗原或抗体作为示踪标志物,以纤维素膜用作载体的免疫标记技术。吴海涛等[34]以硝酸纤维素(NC)膜上分别包被的ASFV p72多克隆抗体和SPA 作为检测线和质控线,制备了用于检测ASFV 的胶体金免疫试纸条。该试纸条在10 min 内就可以检测出阳性抗原,敏感性和特异性良好,而且具有高度稳定性,在ASFV 临床检测中有良好的应用前景。
2.1.4 免疫印迹法(immunoblotting test,IBT) IBT 通过SDS-聚丙烯酰胺凝胶电泳区分待测样品不同组分,在电流作用下,使蛋白质从凝胶转移至固相载体(膜)上,通过特异性抗体作为探针,对靶抗原蛋白质进行检测分析。Alcaraz 等[35]在大肠杆菌中表达重组蛋白p54,首次建立了ASFV 重组蛋白的IBT 法。该法对检测感染猪的ASFV 具有高度的特异性和敏感性,而且消除了因抗原中含有细胞蛋白从而产生的假阳性,并避免了在抗原生产中使用活病毒。
2.2 抗原检测
2.2.1 荧光抗体试验(fluorescent antibody test,FAT) FAT 是检测抗原的一种辅助方法,具有快速、方便、敏感、特异等特点,而且可以鉴别“非红细胞吸附”的毒株,也能区分由ASFV 引起的CPE 和由其他病毒、接种物细胞毒性产生的CPE,可作为HAD 试验的补充试验进行进一步检测[2]。FAT 需用荧光素对抗原进行标记,但对荧光素的特异性要求较高,非特异性的荧光素染色会造成假阳性结果;对于急性ASF 检出率较高,对于亚急性和慢性ASF 的检出率仅为40%;对人员要求较高,需要荧光显微镜,不适用于现场检测[6]。
2.2.2 抗原ELISA ELISA检测的原理为抗体(抗原)被吸附在固相载体表面,样品中的抗体或抗原与其结合形成复合物,酶标抗体再与该复合物结合,根据加入底物后颜色反应判定结果。Vidal 等[36]基于抗vp73 单克隆抗体建立了一种用单克隆抗体检测猪样品中ASFV 蛋白的改良固相ELISA,检测到vp73 的最低抗原质量浓度为0.05 μg/mL,低于普通ELISA 试验检测最极限(0.5 μg/mL)。
2.2.3 侧向流动免疫色谱分析(lateral flow assay,LFA) LFA 又称“试纸条”测定方法,是近几年来发展比较迅速的试纸条快速检测技术,其以条状纤维层析材料为固相,借助毛细管的吸附作用使样品在层析材料上移动,样品中的待测物与层析材料上一定区域的配体发生特异性的免疫结合反应,可通过目测标记物的显色反应短时间获得直观的测试结果[37-38]。Sastre 等[39]基于ASFV vp72 蛋白的单克隆抗体建立的一种用于抗原检测的LFA,其灵敏度与市售抗原ELISA 试验相当。该法具有快速、特异、经济且易于使用的优点。此外,该法可直接用于检测血液,非常适合现场检测,及实验基础设施不足甚至缺乏的场所。
2.3 常用检测技术比较
目前ASFV 常用检测方法主要表现在病原、核酸、抗原与抗体4 个方面,其中病原检测主要有红细胞吸附和病毒分离方法,核酸检测主要通过普通PCR、qPCR 与RPA 等方法,抗原检测常用抗原ELISA 与LFA 等,而抗体可通过GICA、ELISA、IFA 与IBT 等方法检测(表1)。每种诊断技术都有其特点,可为不同情况下的ASFV 诊断提供多种选择。qPCR 敏感性高、特异性强,可以快速对ASFV 进行定量分析,是诊断ASFV 感染最可靠的“金标准”[5],但是需要专业人员操作而且对设备要求高。mPCR 可以同时检测及区分ASFV 及多种病毒感染,节约了大量时间,但操作步骤繁琐。LAMP 技术是一种特异、灵敏、快速、简单易用且经济高效的ASFV 核酸检测手段,可在现场检测,检测结果可以立即用肉眼观察到,但是操作过程中易造成气溶胶污染,形成假阳性。抗原ELISA 可用作检测猪群体ASFV 抗体,操作简便快速,但敏感性低于PCR。LFA 是近年来发展迅速的新检测方法,具有快速、特异性强、灵敏度高、成本低的优点,适用于现场检测及一些缺乏基础实验设施的场所,具有很好的应用前景,但该方法不能对抗原绝对定量而且需要两个抗原表位。
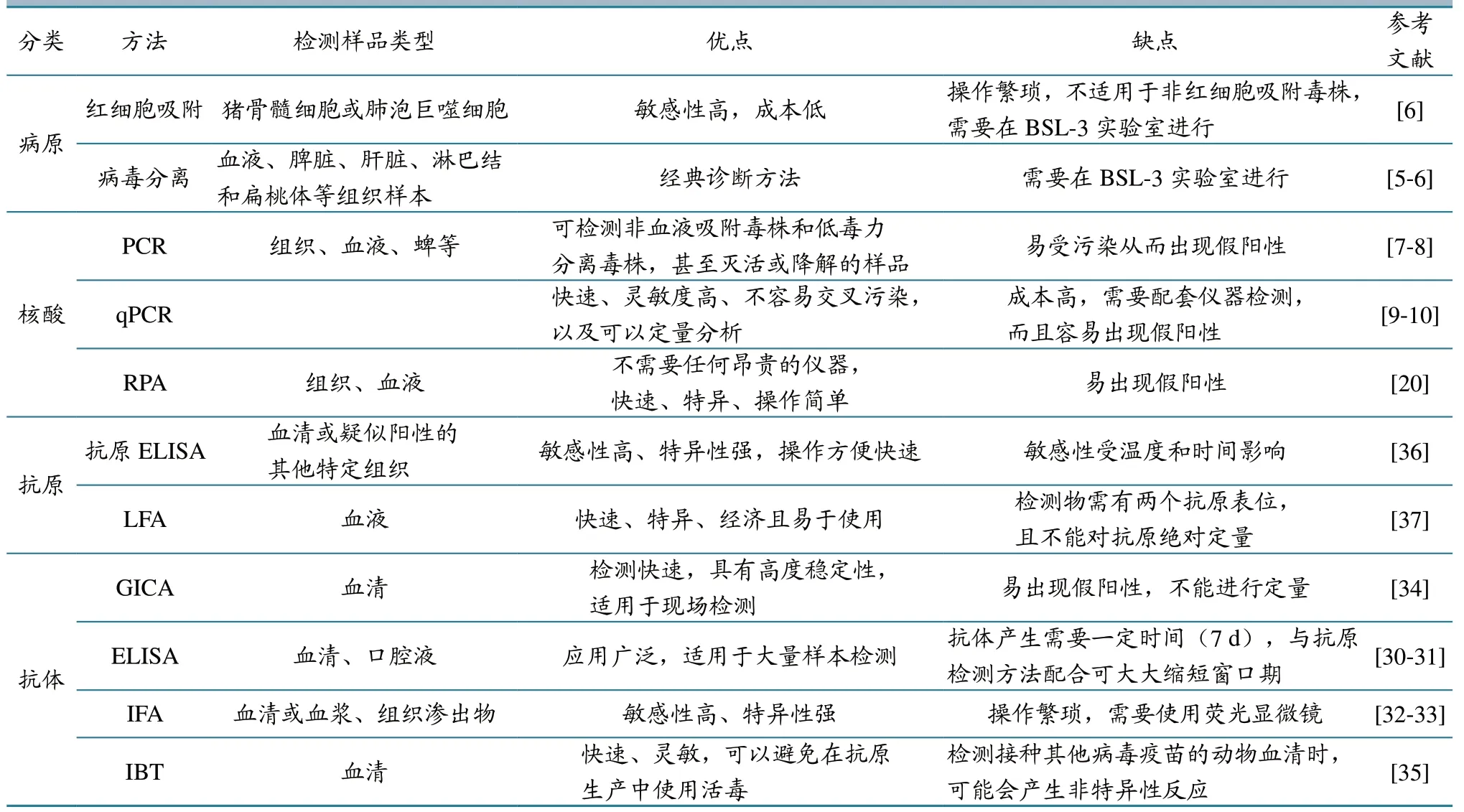
表1 ASFV 常用检测方法及其优缺点
3 展望
ASF 给我国养猪业带来了沉重打击,而且2021 年以来,在我国又出现了变异毒株,使ASFV防控愈加困难。目前,OIE 批准的诊断方法主要包括病毒分离、FAT、ELISA、IFA、PCR 和IBT。这些方法往往需要昂贵的实验室设备和熟练的技术人员,并且在现有的诊断技术中,缺乏能鉴别ASFV病理变化的病原学诊断方法。而快速、简便、可靠的ASF 诊断和监测方法对于控制ASF 格外重要。CRISPR 技术[40-45]与RPA 结合是目前发展较快的检测技术,具有良好的发展潜力,能将检测灵敏度提高10 倍,但却增加了更多的反应时间,因此缩短反应时间是今后新的研究方向。在今后的发展中,不同诊断技术的联合应用也将成为未来诊断技术发展的趋势。

