新型镁合金螺钉体外腐蚀降解及细胞活性研究
杨 越,张雁儒,2*, 徐景超, 李 昊, 李洁洁, 余进伟
新型镁合金螺钉体外腐蚀降解及细胞活性研究
杨 越1,张雁儒1,2*, 徐景超1, 李 昊3, 李洁洁3, 余进伟4
(1.河南理工大学 骨科研究所, 河南 焦作 454001; 2.宁波大学 医学院, 浙江 宁波 315211; 3.河南理工大学 医学院, 河南 焦作 454001; 4.河南理工大学第一附属医院 骨科, 河南 焦作 454002)
研究了基于NZ30K合金开发的新型Mg-3Nd-0.2Zn-0.4Zr-0.2Mn镁合金耐腐蚀性、体外降解行为特性及浸提液细胞生物毒性. 采用金相显微镜得到新型镁合金金相显微图, 采用扫描电镜(Scanning Electron Microscope, SEM)获取SEM图; 采用武汉科思特电化学工作站进行电化学测试, 并绘制动电位极化曲线, 以磷酸盐缓冲液(Phosphate Buffer Solution, PBS)模拟体液环境, 记录氢气析出体积并计算腐蚀速率; 利用细胞完全培养基测定pH值、重量变化曲线; 获取大鼠骨髓间充质干细胞(Bone Mesenchymal Stem Cells, BMSCs), 并利用完全细胞培养基制作新型镁合金浸提液, 检测细胞生物活性, 以ZA75镁合金为基础添加0.3%Mn元素制成合金作为对照组, 比较腐蚀电位、体外降解情况以及细胞活性. 结果表明: 新型Mg-3Nd-0.2Zn-0.4Zr-0.2Mn镁合金横截面等轴晶体组织细小均匀性较好, 纵截面呈长条状组织均匀性稍差; 自腐蚀电位较高, 为-1.3912V; 自腐蚀电流密度较低, 为7.37×10-7A·cm-2; 体外析氢量低, 失重量、pH值变化幅度相对较小; 降解速率下降后呈现小范围上升后趋于平缓; 具有良好的细胞相容性, 可以促进BMSCs细胞增殖分化.
新型镁合金; 腐蚀电位; 体外降解; 细胞活性
可降解生物医用材料自研发以来备受关注, 良好的材料特性在推动其研发的同时为其奠定了临床应用价值. 目前临床医用可降解金属主要有镁及镁合金、铁基合金和锌合金3类, 其中镁及镁合金在心血管及外科领域具有较好的应用前景[1-2].
镁基植入物的主要优点在于镁的可生物降解和可吸收性, 镁的降解产物可以通过体内代谢途径排出体外. 同时, 镁是人体细胞内外液体中最丰富的阳离子之一, 对骨骼和牙齿的形成起到关键作用. 细胞外液中Mg含量在0.70~1.05mmol·L-1之间, 由肾脏和肠道系统维持体内平衡[3]. 但是镁基合金在生理条件下降解很快, 无法完全满足临床要求. 如果镁合金在植入初期的降解速度相对缓慢, 可以保证植入物的力学支撑性能在组织再生之前不受影响; 而快速降解会导致种植体过早丧失机械支撑性能或脱落. 与早期的纯镁相比, 镁合金的降解性能已有明显提升, 力学性能和保持骨传导性也有提高, 可促进骨的形成生长[4-5]. 目前需要进一步研究和优化镁基合金, 以提高其生物降解性能、生物活性、生物相容性和力学性能, 使其更好地应用于骨科等领域.
随着材料工艺的不断提高, 镁及镁合金通过提高铸造技术、合金化、表面改性、材料复合等技术手段有效提高了耐腐蚀性和力学特性[6]; 同时保证了镁及镁合金良好的生物相容性和骨诱导性. 在抗菌性方面, 镁及镁合金也有较好的表现[7].
有研究表明[8], 加入Mn元素可以细化合金基体, 起到一定的“除杂作用”. 因此, 本研究选择NZ30K合金, 并添加Mn元素, 通过热挤压工艺[9](挤压温度300℃)制成新型镁合金(Mg-3Nd-0.2Zn- 0.4Zr-0.2Mn). 采用金相显微镜得到该新型镁合金的金相显微图, 采用扫描电镜(Scanning Electron Microscope, SEM)获取SEM图. 并以ZA75镁合金为基础, 添加0.3%Mn作为对照组, 进行模拟体液体外降解和析氢实验, 对比2种合金材料的电极化曲线、腐蚀速率、重量变化, 配合细胞实验以获取新型镁合金促进细胞生长活性及细胞毒性数据.
1 材料及方法
1.1 实验材料
实验材料采用基于NZ30K合金, 添加Mn元素, 配比为Mg-Nd-Zn-Zr-Mn(平衡-3-0.2-0.4-0.2), 由焦作市新港医疗设备有限公司提供. 采用热挤压铸造技术, 根据实验要求制成不同规格的螺钉、接骨板等形状, 作为实验组. 同时, 选择ZA75镁合金, 添加0.3%Mn, 配比为Mg-Zn-Al-Mn(平衡- 7-5-0.3)制成与实验组相同规格的螺钉、接骨板, 作为对照组.
1.2 实验方法
与河南理工大学材料学院合作, 得到实验组和对照组2组新型镁合金材料的显微组织分析结果及其动电位极化曲线. 采用磷酸盐缓冲溶液(PBS)作为液体介质进行电化学实验. 析氢实验采用自主搭建的简易气体收集装置完成. 具体方法为: 将50mL离心管固定于铁架台上, 加入约15mL没过螺钉的PBS溶液, 将静脉注射针插入离心管中, 尾端接入5mL注射针, 每24h记录氢气析出量, 每48h更换溶液, 共记录240h; 在实验中后期根据实际情况将5mL注射器更换为60mL注射器; 正式实验前进行预实验, 测定装置密封性及收集气体效果.
配制完全培养基: 低糖培养基(L-DMEM)+胎牛血清(FBS)+双抗, 以体积100:10:1比例配制. 将螺钉超声洗净后置于培养基中, 定期测定pH; 将螺钉取出, 置于铬酸清洗液中清洗, 去除其降解物并干燥, 测定螺钉的重量变化.
细胞活性实验: 通过大鼠活体提取其骨髓间充质干细胞(Bone Mesenchymal Stem Cells, BMSCs), 全骨髓贴壁培养7~12d后传代, 待细胞生长状态良好后种植于24孔板上, 置于细胞培养箱(37℃、5%CO2)培养. 待细胞生长至50%左右或贴壁完全长好, 添加镁合金浸提液继续培养, 观察24、48、72h时细胞的增殖及分化. 实验组添加Mg-3Nd- 0.2Zn-0.4Zr-0.2Mn合金浸提液培养, 对照组添加Mg-7Zn-5Al-0.3Mn合金浸提液培养, 空白组添加全培养基培养. 浸提液的制作方法为: 将镁合金高温消毒灭菌后置于完全培养基, 在细胞培养箱中放置48h, 将培养基收集后用0.45μm滤膜过滤, 4℃保存. 实验在超净台上进行. 根据文献[10]中实验步骤, 将浸提液稀释6~10倍, 进行后续实验.
1.3 数据处理
采用Origin 2017软件处理实验数据, 数据采用均值±标准差, 组间分析采用单因素方差分析,<0.05表示有统计学差异.
2 结果
2.1 镁合金螺钉参数信息
表1是实验组与对照组镁合金螺钉规格. 从表1可以看到, 2组受测试螺钉大小相同, 长度均为12.0mm, 螺纹直径均为2.5mm; 实验组螺钉重量略低于对照组, 螺头凹槽为六角形, 对照组螺头凹槽为“一”字形, 实验组螺钉表面积略大于对照组.
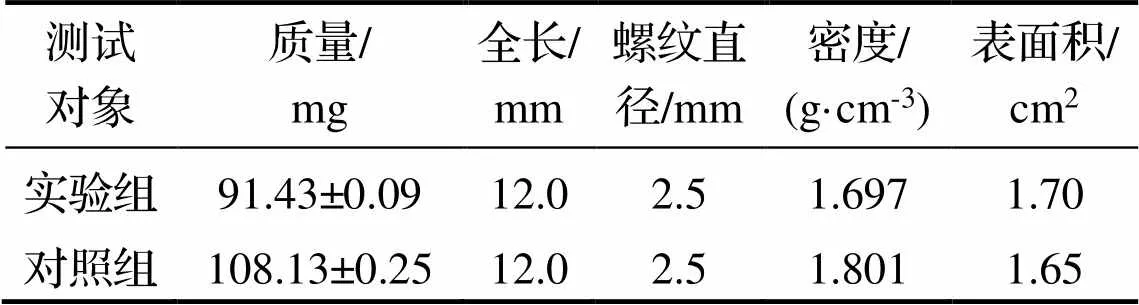
表1 实验组与对照组镁合金螺钉规格
注: 表面积为计算估读值.
2.2 新型镁合金显微组织
2.2.1 新型镁合金挤压金相显微组织
图1为Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金显微组织.

图1 Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金显微组织
从图1可以看到, 由于热挤压过程中合金发生动态再结晶, 热挤压后合金组织由细小的再结晶晶粒和变形晶粒组成, 铸态合金由于冷却速度快,合金发生了非平衡凝固, 造成合金成分不均匀, 晶内容易产生偏析. 经过挤压加工后, 合金组织明显细化; Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金横截面为细小的等轴晶组织; 纵截面出现了尺寸相对较大的晶粒, 沿挤压方向分布. 同时可以看出, 由于挤压过程较短, 合金内部发生动态再结晶, 晶粒来不及完全伸展, 显微组织存在一定的不均匀性.
2.2.2 新型镁合金扫描电镜结果
图2为Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金SEM图. 从图2可以看到, Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金经过热挤压发生了明显的动态再结晶, 合金在挤压过程中遭受强烈的外力作用, 使合金内部的晶粒组织和第二相发生破碎. 第二相颗粒沿挤压方向被碾碎成更细小的颗粒, 只有很少量弥散分布的颗粒状析出, 大晶粒被小晶粒包围, 挤压后呈现的组织并不均匀. 同时, 由于镁合金具有相对较好的塑性, 加工硬化与软化两个过程同时发生, 因此镁合金的堆垛层错能较低, 动态再结晶过程更容易发生, 并细化晶粒. 在300℃挤压温度下, 元素的激活能较低, 不容易扩散, 且塑性变形在再结晶温度以下发生, 挤压时间过短, 再结晶晶粒不容易长大. 同时, 在晶界处分布有很多小颗粒, 经研究这些小颗粒为Mn颗粒相[8]. 由于Mn颗粒相较多分布于晶界处, 因此对位错起到了钉扎作用, 阻碍了位错运动, 从而提高了合金的力学性能. 从图2还可以看到, 有大量的条状第二相沿着晶界生成, 从而使合金的力学性能降低. 条状第二相的形成原因可能是由于Mn元素的添加, 导致合金过冷度增加, 同时Zn元素在凝固末端区域聚集增加, 导致晶界处条状第二相形成.

图2 Mg-3Nd-0.2Zn-0.4Zr-0.2Mn合金SEM图
2.3 新型镁合金动电位极化曲线
理论上合金自腐蚀电位越高, 自腐蚀电流密度越低, 合金耐腐蚀性越好. 从图3可以观察到, 实验组自腐蚀电位高于对照组, 通过对极化曲线进行拟合得到自腐蚀电位和自腐蚀电流密度. 实验组自腐蚀电位为-1.3912V, 自腐蚀电流密度为7.37×10-7A·cm-2; 对照组自腐蚀电位为-1.4397V, 自腐蚀电流密度为5.64×10-6A·cm-2. 表明实验组耐腐蚀性高于对照组.

图3 实验组与对照组动电位极化曲线拟合结果
2.4 新型镁合金螺钉析氢、失重、pH变化及降解速率
图4为新型镁合金螺钉析氢、失重、pH变化及降解速率的实验结果. 从图4可看到, 实验组总产气量为(11.5±0.05)mL, 对照组总产气量为(20.8± 0.08)mL. 2组螺钉在降解初期析氢量大致相近, 中期产气量同时提高, 对照组析氢量明显高于实验组, 后期实验组析氢速率加快, 且趋于稳定, 对照组析氢速度显著增加(图4(a)). 实验组总失重量为(0.0107±0.00012)g, 对照组为(0.0341±0.00016)g; 2组螺钉失重变化趋势与析氢趋势相近(图4(b)). 实验组pH值逐渐上升至9.3, 对照组pH值上升至10.9, 最终在相同时间区域内对照组溶液pH值高于实验组(图4(c)). 2组螺钉在实验前中期降解趋势相近, 而在中后期对照组降解速率明显加快后减缓, 实验组降解速率趋于平缓(图4(d)).
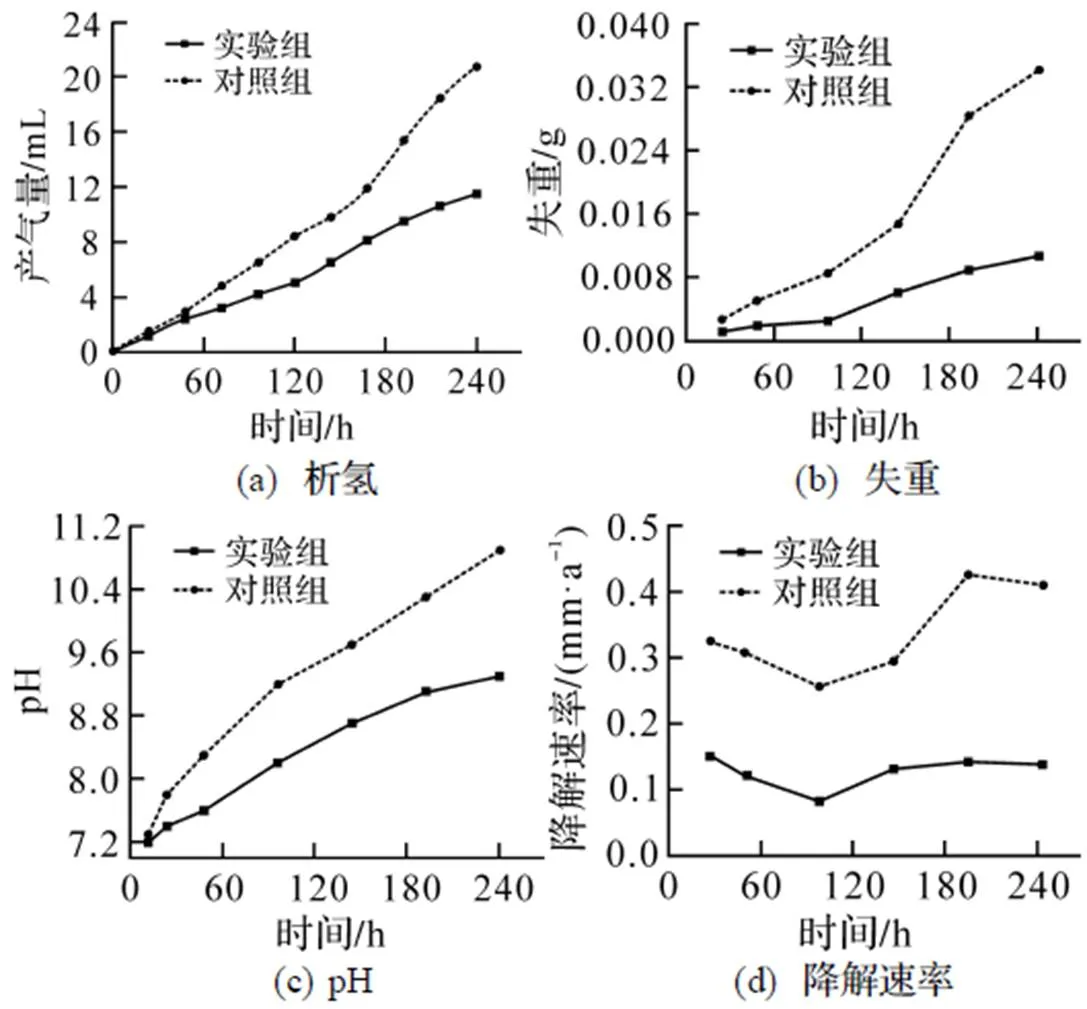
图4 新型镁合金螺钉析氢、失重、pH及降解速率变化
2.5 新型镁合金浸提液的细胞活性
图5为添加浸提液后不同时期细胞培养形态. 从图5可以看到, 实验组添加新型镁合金浸提液24h后BMSCs已出现分化; 48h后细胞形态由梭形、椭圆形分化成不规则形态, 并延伸出“伪足”, 胞质胞核明显; 72h后细胞高度分化逐渐伸长, 胞质呈纤维状, 胞核清晰可见. 对照组培养24h后少数细胞出现分化迹象, 呈多边形或三角形; 48h后多数细胞呈梭形生长, 形态较“饱满”, 极少数细胞高度分化; 72h后亦呈高度分化, 细胞增殖相对较慢. 空白组培养24h后, 细胞分化不明显; 48h后少数细胞出现分化, 呈梭形、多边形; 72h后多数细胞开始高度分化, 多呈现梭形及圆形, 胞质胞核清晰. 同时可以观察到, 实验组代表的新型镁合金可以促进BMSCs细胞分化增殖, 没有出现生长抑制及加速细胞凋亡现象; 对照组也有较为明显的促进细胞分化作用, 但细胞增殖相对较弱, 推测与合金材料中Al元素有关. 已有研究表明[11], Al元素对神经细胞、骨细胞有一定损害.

图5 新型镁合金浸提液的细胞增殖分化形态
3 讨论
最早由蒋海燕等[12]开发的Mg-3Nd-0.2Zn-0.4Zr (NZ30K)稀土镁合金在200℃峰值时效处理后具有最佳的抗拉强度、屈服强度及伸长率, 其断裂方式与状态有关, 铸态合金主要呈沿晶断裂; 固溶处理态及200℃峰值时效态呈穿晶解理断裂; 250℃10h时效态合金呈穿晶和沿晶混合型. 通过调控合金元素比例, 利用重力铸造出多个组合的稀土镁合金, 并筛选出最佳比例为Nd 3.0%、Zn 0.2%, 此合金具有最佳的强度及伸长率. 当Zn高于1.0%会降低合金机械性能, 并且Nd含量界限应限制在3.0%以下, 其原因是Nd可以提高合金的屈服强度及极限抗拉强度, 但是会降低合金的延展性[13]. 在相同溶液介质环境下NZ30K耐腐蚀性明显高于AZ91D合金, NZ30K的腐蚀沿表面扩散, 而AZ91D的腐蚀沿纵向扩展, 在某些区域形成更深的腐蚀坑, 前者的腐蚀产物膜比后者更致密[14]. 在后续研究中, 有学者以NZ30K合金为实验材料得出退火温度在420~440℃时, 合金可以获得合适的屈强比及耐腐蚀性[15]; Wen等[16]讨论了铸造挤压与切屑挤压2种方法制备NZ30K镁合金, 所有挤压合金都比铸造合金具有更好的拉伸性能. 随着实验温度的升高, 合金的强度下降, 伸长率增加, 通过位错攀爬机制可以控制合金的蠕变. 断口的SEM观察表明: 合金在高温下的断裂方式为脆性断裂和滑动断裂相混合. 后续研究在NZ30K合金基础上, 通过改变合金元素比例或在原基础上添加其他元素, 改变合金微观结构及力学特性, 在实验阶段取得了较好的结果. Xie等[17]探究了不同含量Gd元素对合金组织演变及力学性能的具体作用, 发现Gd含量的增加, 铸态合金的平均晶粒尺寸不断减小, 沿晶界分布的主要共晶化合物由Mg12Nd变为Mg3Gd, β相分布更加致密, 纵横射电系数更高, 合金强度显著提高; 当Nd含量为4.5%时, 合金综合性能最佳; Gd的固溶强化显著提高了淬火态合金强度, 峰时效合金中主要析出相为β柱状相, 在β析出相中发现Gd元素的加入有可能取代Nd原子, β相体积分数大幅增加导致析出动力增强.
镁合金综合力学性能在以后的研究中不断被改进, 在生物活性、抗菌性、促成骨活性等方面提高显著. Samiee等[18]利用磁溅射法在AZ91D合金表面形成均匀的TiO2/MgO涂层, 提高了合金的耐腐蚀性能. 此外, 在体外细胞实验中, 细胞在涂层样品表面生长、附着、生物相容性、增殖性能都有明显改善. Liu等[19]将碱金属元素Na添加到镁合金中, 制成“微合金”, 提高了硬度和抗腐蚀性, 促进骨质疏松修复和血管形成, 更有利于骨骼再生. Sampatirao等[20]回顾研究了等离子电解氧化(PEO)表面修饰技术对镁合金耐腐蚀性能的改善, 通过改变电解质成分、浓度、pH值、温度、处理时间等参数, 控制涂层的形态和厚度, 进而改变镁合金性能. Fang等[21]研究团队将丝纤维素、钠藻酸盐按照一定比例制成聚合物涂层应用于镁合金表面, 显著提高了镁合金的机械性能指数, 确保了涂层的性能, 降低了镁合金的腐蚀率. Guo等[22]利用循环伏安法在镁合金表面制备了多功能多酚/氧化锌复合涂层, 有效降低了镁合金的腐蚀率, 同时显著提高了抗菌性能. Guo等[23]研究团队采用化学转化及浸涂涂层法, 在镁合金表面制成磷酸钙/胶原蛋白复合涂层, 显著提高了镁合金耐腐蚀性, 为成骨细胞生长增殖提供有利的微环境. Wang等[24]研究团队在镁合金表面利用水热合成和浸渍法制备出MMT-BSA复合涂层, 使镁合金拥有更好的抗腐蚀性、血液相融性及细胞相融性. Ag元素在人体中具有抗菌性和生物相容性, Zhang等[25]在研究中, 将Ag微合金元素加入到Mg-3Nd-0.2Zn-0.4Zr合金中, 研究Ag对合金微观结构和耐腐蚀性的影响. 结果表明: 合金腐蚀率随着Ag的增加而增加, 当Ag含量为0.2%时, 合金腐蚀速率与未添加Ag合金相似, 结合合金内腐蚀性, Ag最佳添加量为0.2%.
间充质干细胞(MSCs)可以在适当条件下分化为包括成骨细胞、软骨细胞、脂肪细胞及神经细胞等在内的多种细胞, 在骨折愈合及骨骼重塑期间发挥重要作用[26]. 根据来源MSCs可分为BMSCs和脂肪间充质干细胞(ADSCs)[27], 在组织工程中使用适当的材料加速修复重建已损伤缺陷的骨组织, 需要了解植入的生物材料对BMSCs细胞反应的影响[28]. 而BMSCs分泌多种内分泌因子, 与受损组织的纤维化、增殖、凋亡、趋化、免疫调节和血管生成过程有关, 通过这些作用, 骨髓间充质干细胞可以刺激损伤区域的恢复、免疫系统的应答和保护其他细胞免受凋亡[29]. BMSCs在治疗骨关节炎(OA)方面表现出较好的治疗潜力, 在一项荟萃分析中BMSCs改善了膝关节软骨蜕变、关节损伤, 显著减轻了患者疼痛[30]. 6项临床实验报告结果支持干细胞注射治疗膝关节骨关节炎[31]. 在一项系统性研究回顾中, OA患者膝盖疼痛得到明显改善, 虽然没有明显改变软骨体积, 但是软骨质量有显著提高[32].
基于NZ30K制造的Mg-3Nd-0.2Zn-0.4Zr-0.2Mn新型镁合金具有更好的耐腐蚀性及良好的细胞生物相容性. 有着较慢的体外降解行为, 初步显示该合金在骨科中具有较广的临床应用前景. 目前已研制出镁合金板、螺钉等, 并已进行骨损伤修复的体内实验. 研究结果表明: 镁合金螺钉系统在早期可以获得良好的界面稳定性, 但是失效时间仍然提前出现. 因此, 后续研究重点将放在骨科镁合金植入物的优化设计上, 力求制作出符合临床降解要求的镁合金钉板系统, 增强初始稳定性, 并考察其在体内外降解后的机械性能改变, 使其符合临床要求.
4 结论
(1)研究制造的Mg-3Nd-0.2Zn-0.4Zr-0.2Mn挤压前均匀化热处理可以使粗大的树枝晶和第二相溶于合金基体, 横截面组织呈现细小的等轴晶, 组织均匀性较好; 纵截面沿着挤压方向形成较长的长晶粒, 大晶粒被小晶粒所包围, 挤压后合金的纵截面组织均匀性较差.
(2)新型镁合金Mg-3Nd-0.2Zn-0.4Zr-0.2Mn自腐蚀电位为-1.3912V, 自腐蚀电流密度为7.37× 10-7A·cm-2, 具有良好的耐腐蚀性.
(3)新型镁合金Mg-3Nd-0.2Zn-0.4Zr-2Mn体外降解速率较为平缓, 析氢量、失重、pH变化更加稳定.
(4)新型镁合金Mg-3Nd-0.2Zn-0.4Zr-0.2Mn无明显细胞毒性, 可以促进细胞增殖分化, 具有良好的细胞相容性.
[1] Tang J, Wang J L, Xie X H, et al. Surface coating reduces degradation rate of magnesium alloy developed for orthopaedic applications[J]. Journal of Orthopaedic Translation, 2013, 1(1):41-48.
[2] Abdal-Hay A, Barakat N A M, Lim J K. Hydroxyapatite- doped poly (lactic acid) porous film coating for enhanced bioactivity and corrosion behavior of AZ31 Mg alloy for orthopedic applications[J]. Ceramics International, 2013, 39(1):183-195.
[3] Liu H N. The effects of surface and biomolecules on magnesium degradation and mesenchymal stem cell adhesion[J]. Journal of Biomedical Materials Research Part A, 2011, 99(2):249-260.
[4] Johnson I, Perchy D, Liu H.evaluation of the surface effects on magnesium-yttrium alloy degradation and mesenchymal stem cell adhesion[J]. Journal of Biomedical Materials Research Part A, 2012, 100(2): 477-485.
[5] Guan R G, Johnson I, Cui T, et al. Electrodeposition of hydroxyapatite coating on Mg-4.0Zn-1.0Ca-0.6Zr alloy andevaluation of degradation, hemolysis, and cytotoxicity[J]. Journal of Biomedical Materials Research Part A, 2012, 100(4):999-1015.
[6] 李少鹏, 陈豪杰, 杨帆, 等. 可降解镁金属在骨科中的应用[J]. 生物骨科材料与临床研究, 2021, 18(4):92-96.
[7] Zhao Y, Jamesh M I, Li W K, et al. Enhanced antimicrobial properties, cytocompatibility, and corrosion resistance of plasma-modified biodegradable magnesium alloys[J]. Acta Biomaterialia, 2014, 10(1):544-556.
[8] 汪琴, 汤爱涛, 许婷熠, 等. Mn对镁合金中杂质元素Si分布的影响[J]. 中国科技论文, 2016, 11(4):404-408; 417.
[9] 王建国, 任朋立, 王清川. 高性能镁合金铸造技术的研究现状[J]. 热加工工艺, 2014, 43(17):21-23; 28.
[10] 金实. 新型医用可降解镁合金(Mg-2Zn-0.5Zr-0.5Nd/Y)的材料性能、生物相容性和抗菌性研究[D]. 沈阳: 中国医科大学, 2020.
[11] Bondy S C. Low levels of aluminum can lead to behavioral and morphological changes associated with Alzheimer’s disease and age-related neurodegeneration[J]. NeuroToxicology, 2016, 52:222-229.
[12] 蒋海燕, 付彭怀, 彭立明, 等. Mg-3Nd-0.2Zn-0.4Zr合金的显微组织与力学性能[J]. 特种铸造及有色合金, 2008, 28(S1):254-258.
[13] Fu P H, Peng L M, Jiang H Y, et al. Chemical composition optimization of gravity cast Mg-Nd-Zn-Zr alloy[J]. Materials Science and Engineering: A, 2008, 496(1/2):177-188.
[14] Chang J W, Peng L M, Guo X W, et al. Comparison of the corrosion behaviour in 5% NaCl solution of Mg alloys NZ30K and AZ91D[J]. Journal of Applied Electro- chemistry, 2008, 38(2):207-214.
[15] 章晓波, 薛亚军, 王章忠, 等. 热处理对NZ30K生物镁合金力学和腐蚀性能的影响[J]. 材料热处理学报, 2013, 34(8):20-25.
[16] Wen L H, Ji Z S, Hu M L, et al. Microstructure and mechanical properties of Mg-3.0Nd-0.4Zn-0.4Zr magnesium alloy[J]. Journal of Magnesium and Alloys, 2014, 2(1): 85-91.
[17] Xie H, Wu G H, Zhang X L, et al. The role of Gd on the microstructural evolution and mechanical properties of Mg-3Nd-0.2Zn-0.5Zr alloy[J]. Materials Characterization, 2021, 175:111076.
[18] Samiee M, Hanachi M, Seyedraoufi Z S, et al. Bio- degradable magnesium alloy coated with TiO2/MgO two- layer composite via magnetic sputtering for orthopedic applications: A study on the surface characterization, corrosion, and biocompatibility[J]. Ceramics International, 2021, 47(5):6179-6186.
[19] Liu Y, Li H F, Xu J K, et al. Biodegradable metal-derived magnesium and sodium enhances bone regeneration by angiogenesis aided osteogenesis and regulated biological apatite formation[J]. Chemical Engineering Journal, 2021, 410:127616.
[20] Sampatirao H, Radhakrishnapillai S, Dondapati S, et al. Developments in plasma electrolytic oxidation (PEO) coatings for biodegradable magnesium alloys[J]. Materials Today: Proceedings, 2021, 46:1407-1415.
[21] Fang H, Wang C X, Zhou S C, et al. Exploration of the enhanced performances for silk fibroin/sodium alginate composite coatings on biodegradable Mg-Zn-Ca alloy[J]. Journal of Magnesium and Alloys, 2021, 9(5):1578-1594.
[22] Guo Y T, Jia S Q, Qiao L, et al. A multifunctional polypyrrole/zinc oxide composite coating on biodegradable magnesium alloys for orthopedic implants[J]. Colloids and Surfaces B: Biointerfaces, 2020, 194:111186.
[23] Guo Y T, Su Y C, Gu R, et al. Enhanced corrosion resistance and biocompatibility of biodegradable magnesium alloy modified by calcium phosphate/collagen coating[J]. Surface and Coatings Technology, 2020, 401: 126318.
[24] Wang J, Cui L Y, Ya D R, et al.and in vivo biodegradation and biocompatibility of an MMT/BSA composite coating upon magnesium alloy AZ31[J]. Journal of Materials Science & Technology, 2020, 47: 52-67.
[25] Zhang X B, Ba Z X, Wang Z Z, et al. Influence of silver addition on microstructure and corrosion behavior of Mg- Nd-Zn-Zr alloys for biomedical application[J]. Materials Letters, 2013, 100:188-191.
[26] Pansky A, Roitzheim B, Tobiasch E. Differentiation potential of adult human mesenchymal stem cells[J]. Clinical Laboratory, 2007, 53(1/2):81-84.
[27] 于晨雨, 梁荣斌, 邵毅. 骨髓与脂肪间充质干细胞治疗眼病的研究进展[J]. 国际眼科杂志, 2021, 21(1):62-65.
[28] Sun H L, Wu C T, Dai K R, et al. Proliferation and osteoblastic differentiation of human bone marrow- derived stromal cells on akermanite-bioactive ceramics[J]. Biomaterials, 2006, 27(33):5651-5657.
[29] Andrzejewska A, Lukomska B, Janowski M. Concise review: Mesenchymal stem cells: From roots to boost[J]. Stem Cells, 2019, 37(7):855-864.
[30] Jayaram P, Ikpeama U, Rothenberg J B, et al. Bone marrow-derived and adipose-derived mesenchymal stem cell therapy in primary knee osteoarthritis: A narrative review[J]. PM & R, 2019, 11(2):177-191.
[31] Pas H I, Winters M, Haisma H J, et al. Stem cell injections in knee osteoarthritis: A systematic review of the literature[J]. British Journal of Sports Medicine, 2017, 51(15):1125-1133.
[32] Iijima H, Isho T, Kuroki H, et al. Effectiveness of mesenchymal stem cells for treating patients with knee osteoarthritis: A meta-analysis toward the establishment of effective regenerative rehabilitation[J]. npj Regenerative Medicine, 2018, 3:15.
corrosion degradation and cell activity analysis of new magnesium alloy screws
YANG Yue1, ZHANG Yanru1,2*, XU Jingchao1, LI Hao3, LI Jiejie3, YU Jinwei4
( 1.Institute of Orthopedics, Henan Polytechnic University, Jiaozuo 454001, China; 2.School of Medicine, Ningbo University, Ningbo 315211, China; 3.School of Medicine, Henan Polytechnic University, Jiaozuo 454001, China; 4.Department of Orthopedics, First Affiliated Hospital of Henan Polytechnic University, Jiaozuo 454002, China )
The current study was designed to investigate the corrosion resistance,degradation behavior and cell biotoxicity of new Mg-3ND-0.2Zn-0.4Zr-0.2Mn magnesium alloy based on NZ30K alloy. The metallographic images of the new magnesium alloy were obtained by metallographic microscope, and the SEM images were obtained by Scanning Electron Microscope. Electrochemical tests were carried out by using Wuhan Coster Electrochemical Workstation, with which the potentiodynamic polarization curves were drawn. Hydrogen precipitation volume was recorded and corrosion rate was calculated using Phosphate Buffer Solution (PBS) to simulate the body fluid environment. Both the value of pH and weight curve were measured by cell complete medium. Rat Bone Marrow Mesenchymal Stem Cells (BMSCs) were obtained, and a new magnesium alloy extract was prepared using complete cell culture medium to detect the biological activity of the cells. The corrosion potential,degradation and cell activity of ZA75 magnesium alloy were compared with 0.3% Mn alloy as control group. The results show that the new Mg-3Nd-0.2Zn-0.4Zr-0.2Mn magnesium alloy has finer and more uniform microstructure in equiaxed cross section, and lower uniformity in long strip structure in longitudinal section. The higher self-corrosion potential is -1.3912V, and the lower self-corrosion current density is 7.37×10-7A·cm-2.hydrogen evolution is lower, and weight loss and pH value variation are relatively small. Degradation rate decreased and subsequently increased in a small range. The trend tends to be mild. It has good cytocompatibility and can promote the proliferation differentiation of BMSCs cells. The new Mg-3Nd-0.2Zn-0.4Zr-0.2Mn magnesium alloy has greater corrosion resistance, stable degradation rate and good cellular compatibility. It has a broad prospect in practical application.
new magnesium alloy; corrosion potential;degradation; cell activity
R608
A
1001-5132(2022)01-0033-07
2021−10−27.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
河南省科技攻关重点项目(201402003); 2017年河南省高等学校重点科研项目(13170023).
杨越(1998-), 男, 河南信阳人, 在读硕士研究生, 主要研究方向: 骨科植入材料. E-mail: CAS1908@126.com
张雁儒(1970-), 男, 河南西华人, 教授, 主要研究方向: 创伤骨科. E-mail: zyr@hpu.edu.cn
(责任编辑 史小丽)

