海带渣资源化利用及在小球藻培养中的应用研究*
王 铭 彭敏琳 许 瑾 梁翠谊 向文洲 李 涛
海带渣资源化利用及在小球藻培养中的应用研究*
王 铭1, 2彭敏琳1, 3许 瑾4梁翠谊4向文洲2, 3李 涛2, 3①
(1. 贵州民族大学生态环境工程学院 贵州贵阳 550025; 2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广东省海洋药物重点实验室 广东广州 510301; 3. 南方海洋科学与工程广东省实验室(广州) 广东广州 511458; 4. 中国科学院广州能源研究所 中国科学院可再生能源与天然气水合物重点实验室 广东广州 510640)
海带渣是海带加工中的固体废弃物, 将其资源化利用生产高附加值产品具有重要意义。文章以海带渣为原料, 糖化液的总还原糖质量浓度、单糖组成和小球藻培养效果为主要评估指标, 探究不同预处理方法对海带渣酶解的影响, 以及海带渣资源化利用培养微藻工艺的可行性。结果显示: (1) 粗纤维和灰分是海带渣主要组成成分; (2) 常温常压稀硫酸预处理海带渣后进行纤维素酶解, 糖化液的总还原糖质量浓度由初始(海带渣未进行预处理) 2.7 g/L提高到26.3 g/L, 在较优糖化工艺条件下(纤维素酶用量50 IU/g, 酶解时间36 h, 料液比1︰5), 糖化液的总还原糖质量浓度达到(53.4±0.3) g/L, 总还原糖得率98.9%; (3) 糖化液的单糖主要为葡萄糖, 质量浓度为48.0 g/L; (4) 利用2 g/L糖化液培养小球藻SCSIO-559, 其生物量(0.93 g/L)显著高于自养组及2 g/L葡萄糖组, 且有利于多不饱和脂肪酸的积累。综上所述, 海带渣糖化液对小球藻培养优势明显, 具备作为微藻培养有机碳源的潜力。研究旨在为更好地对海带渣资源化利用提供数据支撑, 为提高海带渣高值化应用以及在微藻工业应用等方面提供理论依据。
海带渣; 资源化利用; 预处理; 酶; 有机碳源
海带是一种可食用的大型藻类, 其藻体含有丰富的褐藻胶、甘露醇、纤维素和矿物元素, 被广泛应用在食品、化妆品、医药、饲料添加剂等领域(Islam, 2016; Ashayerizadeh, 2020)。我国是世界最大的海带养殖国, 2019年我国海带养殖量超过160万t (农业农村部渔业渔政管理局, 2020), 除了食用外, 提取褐藻胶和甘露醇是海带的另一项主要用途(周德庆等, 2006)。海带提取褐藻酸盐后产生的不溶性物质称为海带渣, 研究表明海带渣中仍含有纤维素等大量可利用物质, 但目前海带渣的利用率仅有30%, 大多直接以渣的形式用于肥料、饲料、吸附剂等的加工(卢茳虹等, 2012)。若对海带渣进一步加工, 将其作为微生物生长的有机碳源, 通过微生物这一特殊媒介, 产生具有高附加值的物质, 将大幅提高海带渣的利用价值(Larsen, 2017)。
目前最常见的生物质预处理工艺包括蒸汽爆破、稀酸水解、稀碱水解等(杜兆林等, 2019)。王闻等(2016)对甘蔗渣进行蒸汽爆破处理后, 大部分半纤维素被去除; 高凤芹等(2020)研究发现, 稀硫酸预处理可有效降解杂交狼尾草木质纤维素的半纤维素; Mota等(2021)研究表明稀碱预处理可去除木质纤维中70%的木质素。由于蒸汽爆破和稀碱水解会使木质素发生重聚, 导致纤维素结构更加紧密(陈雪艳, 2020), 因此, 稀酸水解是生物质预处理工艺中研究较多的一种。由于稀硫酸能与多数含木质纤维的原料进行反应, 是常用的一种催化剂, 也有用稀硫酸对木质纤维进行催化的报道(Chen, 2013)。此外, 对原料进行酸或碱浸渍后能有效地降解半纤维素或木质素(Mancini, 2018), 提高酶水解效率。而微藻作为一种自养生物, 已形成规模化的生产及应用(于殿江等, 2021), 目前越来越多的研究表明, 小球藻、斜生栅藻等微藻可以通过外加碳源方式实现异养或兼养培养, 从而获得优于自养模式的高生物量, 这有助于微藻产业化的成本控制与发展(Jin, 2020; Wang, 2021)。
本文以海带渣为原料, 探讨常温常压稀硫酸处理(以下简称稀硫酸浸泡)与高压稀酸水解处理对海带渣酶解的影响, 选出适用的预处理方法, 再通过优化酶解反应条件, 提高糖化效率, 以期获得较高还原糖质量浓度的糖液, 并对糖化液进行单糖组成研究分析, 以海带渣糖化液作为有机碳源对小球藻进行培养, 用于考察其作为微藻培养中的碳源效果, 以期为后续海带渣的资源化高值应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 海带渣 海带渣购买于青岛海兴源生物科技有限公司。培养微藻为小球藻属(sp.), 编号SCSIO-559, 由中国科学院南海海洋研究所海藻资源与生物技术实验室分离并保藏。
1.1.2 主要试剂 纤维素酶(酶活225 IU/mL)购自诺维信(中国)生物技术有限公司; 半纤维素酶(150 U/g)购自上海源叶生物科技有限公司; 果胶酶(300 U/g)购自上海麦克林生化科技有限公司。
1.1.3 培养方法 微藻培养容器三角瓶, 采用连续光照培养, 培养体系为300 mL, 光照强度为(60±5) μmol photons/(m2·s)。
1.2 实验设计
1.2.1 市售海带渣的酶解处理 (1) 去离子水浸泡处理: 用去离子水对市售海带渣浸泡后, 称取0.2 g海带渣, 使用纤维素酶、半纤维素酶、果胶酶及复合酶(纤维素酶/半纤维素酶、纤维素酶/果胶酶、半纤维素酶/果胶酶)各60 IU/g对其进行酶解处理, 酶解温度50 °C, 酶解时间48 h, 离心取上清液, 利用苯酚硫酸法测定总还原糖质量浓度。
(2) 稀硫酸浸泡预处理: 用4%稀硫酸溶液对市售海带渣浸泡过夜后, 称取0.2 g海带渣, 使用纤维素酶、半纤维素酶、果胶酶及复合酶(纤维酶/半纤维素酶、纤维素酶/果胶酶、半纤维素酶/果胶酶)各60 IU/g对其进行酶解处理, 酶解温度50 °C, 酶解时间48 h, 离心取上清液, 利用苯酚硫酸法测定总还原糖质量浓度。
1.2.2 高压稀酸水解海带渣的酶解处理 称取0.2 g海带渣, 设置5种稀硫酸处理组(0%、0.3%、1.0%、1.7%和2.5%), 在121 °C、0.12 MPa条件下处理1、2、3和4 h, 冷却后收集海带渣, 随后将渣洗涤成中性, 纤维素酶50 °C酶解48 h, 离心取上清, 利用苯酚硫酸法测定总还原糖质量浓度。
1.2.3 酶解条件优化 (1) 酶添加量: 每各处理组称取0.2 g海带渣(下同), 设置6种纤维素酶添加量 (0、20、30、40、50和60 IU/g), 50 °C酶解48 h, 料液比1︰10; (2) 酶解时间: 设置10种酶解时间(0、0.25、0.5、1、6、12、24、36、48和72 h)处理组, 酶添加量50 IU/g酶解, 酶解温度50 °C, 料液比1︰10; (3) 料液比: 设置5种料液比处理组(1︰40、1︰20、1︰10、1︰5和1︰3.3), 酶添加量为50 IU/g, 酶解温度50 °C, 酶解时间36 h。
1.2.4 海带渣糖化液效能分析 以ASW培养基作为基础培养基, 设置3个实验组别, 分别为自养(CK)组, 葡萄糖兼养(glucose mixotrophs, GM)组和海带渣糖化液兼养(kelp residue saccharification liquid mixotrophs, KSM)组, 实验周期为10 d。
将藻种接入ASW培养基中进行扩种培养, 待藻细胞生长至对数期(7 d左右), 离心收集藻细胞, 用ASW培养基反复冲洗2次, 然后重悬浮于装有ASW培养基的三角瓶中, 其中GM组添加2 g/L葡萄糖, KSM组加入2 g/L的海带渣糖化液, 初始接种OD750约为0.5, 培养至第10 d离心收集藻细胞, 测定细胞干重, 冻干后测定脂肪酸组成。
1.3 测定方法
1.3.1 海带渣生化组成 水分的测定, 参照GB 76435—2014标准测定海带渣中水分含量; 总脂的测定, 参照改良的Khozin-Goldberg法测定藻粉中总脂含量(Khozin-Goldberg, 2005); 灰分的测定, 取1.5 g海带渣于已恒重的干锅中, 先用电炉低温加热灼烧至无烟(完全碳化), 于马弗炉中(650±20) °C灼烧约6 h, 使海带渣完全灰化并至恒重; 蛋白质的测定, 参照凯氏定氮法测定海带渣中蛋白质含量; 粗纤维的测定, 参照GB/T 5009.10—2003标准测定海带渣中粗纤维含量; 可溶性多糖的测定, 0.5 mol/L硫酸80 °C搅拌抽提1 h, 重复3~4次, 合并提取液, 利用苯酚硫酸法测定还原糖含量(Dubois, 1956)。
1.3.2 总还原糖含量测定及总还原糖得率计算 参照Sluiter等(2008)两步酸水解法测定海带渣中总还原糖含量, 总还原糖得率计算公式:
总还原糖得率(%)=1/2×100%, (1)
其中,1为水解液或酶解液中总还原糖质量,2为海带渣总还原糖质量。
1.3.3 单糖组成的测定 多糖样品酸水解: 取样品5 mg, 加入2 mol/L的三氟乙酸, 封管, 在120 °C消化仪中水解2 h, 冷却后, 水解液50 °C旋转蒸发至干, 加入约2 mL甲醇, 蒸干, 此操作重复3次, 最后蒸干待衍生化使用。
腈乙酸酯衍生物的制备: 向水解后的糖样中加入10 mg盐酸羟胺、5 mg肌醇和0.6 mL吡啶, 放入90 °C水浴锅中搅拌及加热反应30 min后, 待冷却, 再加入1.0 mL乙酸酐, 继续放入并搅拌90 °C水浴锅中反应30 min后, 得糖腈乙酸酯衍生物。
气相色谱条件: GC-2014C气相色谱仪(Shimadzu, Kyoto, Japan), SH-Rtx-5毛细管柱(30 m×0.25 mm× 0.25 μm), 以高纯氮气为载气, 检测器为FID检测器; 流速为1 mL/min, 进样口和检测器温度分别为250和280 °C。
1.3.4 糖化液单糖组成的测定 液相色谱条件: Waters E2695高效液相色谱仪(Waters, Milford, USA), Shodex SH1011糖类色谱柱(300 mm × 8 mm × 6 μm), 以5 mmol/L硫酸溶液作为流动相; 检测器为RI2414检测器; 流速为0.5 mL/min, 柱温及检测器的温度为50 °C (王闻等, 2016)。
1.3.5 细胞干重的测定 培养到第10 d后, 取藻液mL, 将其过滤到预先烘好的混合纤维滤膜(重量为1, g)上,将带有藻细胞的滤膜置于80 °C烘箱24 h, 放置干燥器中冷却至室温后称重(重量为2, g)。
细胞干重(g/L)=1000×(2–1)/. (2)
1.3.6 脂肪酸组成测定 称取25 mg藻粉, 加入2 mL 2% H2SO4无水甲醇︰甲苯(体积分数90︰10), 同时加入25 μL 1%的C17︰0, 充氩气后, 置于80 °C的水浴加热搅拌1.5 h, 加入1 mL 纯水和正己烷振荡分层, 将上层有机相转移到1.5 mL样品瓶中, 用氮气吹干, 再加入100 μL正己烷密封, 利用气相色谱进行脂肪酸组成的测定。
气相色谱测定条件为: GC-2014C气相色谱仪(Shimadzu, Kyoto, Japan), DB-5毛细管柱(30 m × 0.25 mm),以高纯氮气为载气; 检测器为FID检测器; 进样口温度260 °C, 程序升温(60 °C保留2 min→30 °C/min 升温至120 °C→1.5 °C/min升温至250 °C保留2 min) (李涛等, 2018)。
1.4 数据处理方法
本文中试验数据采用SPSS 25.0进行方差分析(ANOVA), 测定结果均以平均值±标准差(Mean±SD)表示, 用Origin 2018进行图表制作。
2 结果与分析
2.1 市售海带渣的生化组成及初步酶解
利用去离子水和稀硫酸分别对市售海带渣进行12 h浸泡处理, 并测定处理后海带渣的重量及生化组成, 结果如图1所示, 海带渣的主要组成成分包括粗纤维、蛋白质和灰分, 不同浸泡处理对海带渣主要组成成分的相对含量产生较大影响, 经过去离子水和稀硫酸浸泡处理后的海带渣重量分别为(0.171±0.001) g和(0.144±0.000) g, 分别减少14.5%±0.1%和28.0%±0.0%。去离子浸泡后海带渣的粗纤维、蛋白质和灰分相对含量(干重)分别为33.9%、16.3%和34.3%, 稀硫酸浸泡后海带渣的粗纤维、蛋白质和灰分含量(干重)分别为42.1%、27.4%、12.1%, 由此可见, 稀硫酸浸泡后海带渣的粗纤维和蛋白质相对含量分别提高了24.2%和68.1%, 而灰分相对含量降低了64.7%。

图1 海带渣的生化组成
通过气相色谱法分析海带渣的单糖组成, 由图2可知, 海带渣主要含有葡萄糖、甘露糖、半乳糖和岩藻糖等4种单糖, 其中, 葡萄糖相对含量最高, 通过计算得到甘露糖、葡萄糖、半乳糖和岩藻糖的摩尔比为1.00︰5.02︰1.10︰1.68。

图2 海带渣的单糖组成
注: 1: 岩藻糖; 2: 甘露糖; 3: 葡萄糖; 4: 半乳糖
选用纤维素酶、半纤维素酶、果胶酶及两种酶的两两组合, 对去离子浸泡和稀硫酸浸泡后的海带渣开展酶解实验, 并测定糖化液的总还原糖质量浓度和计算总还原糖得率, 结果如表1所示, 不同浸泡方式明显提高了海带渣糖化液的总还原糖质量浓度和总还原糖得率。单种酶中纤维素酶糖化效果较好, 纤维素酶对去离子水浸泡后的海带渣酶解, 海带渣糖化液的总还原糖质量浓度和总还原糖得率分别为(2.7±0.2) g/L和8.1%±0.7%, 纤维素酶对稀硫酸浸泡后的海带渣处理, 其糖化液的总还原糖质量浓度和总还原糖得率分别为(26.3±0.2) g/L和73.0%±0.6%。组合酶中纤维素酶/半纤维素酶能获得较高质量浓度的糖化液和总还原糖得率, 在去离子水浸泡方式中, 纤维素酶/半纤维素酶解海带渣, 其糖化液的总还原糖质量浓度和总还原糖得率分别为(3.4±0.1) g/L和10.6%±0.2%, 而在稀硫酸浸泡方式中, 纤维素酶/半纤维素酶处理海带渣, 其糖化液的总还原糖质量浓度和总还原糖得率分别为(27.2±2.4) g/L和75.6%±6.7%。由此可见, 稀硫酸浸泡方式中, 纤维素酶和纤维素酶/半纤维素酶对海带渣糖化液的总还原糖质量浓度分别提高8.9倍和6.9倍。
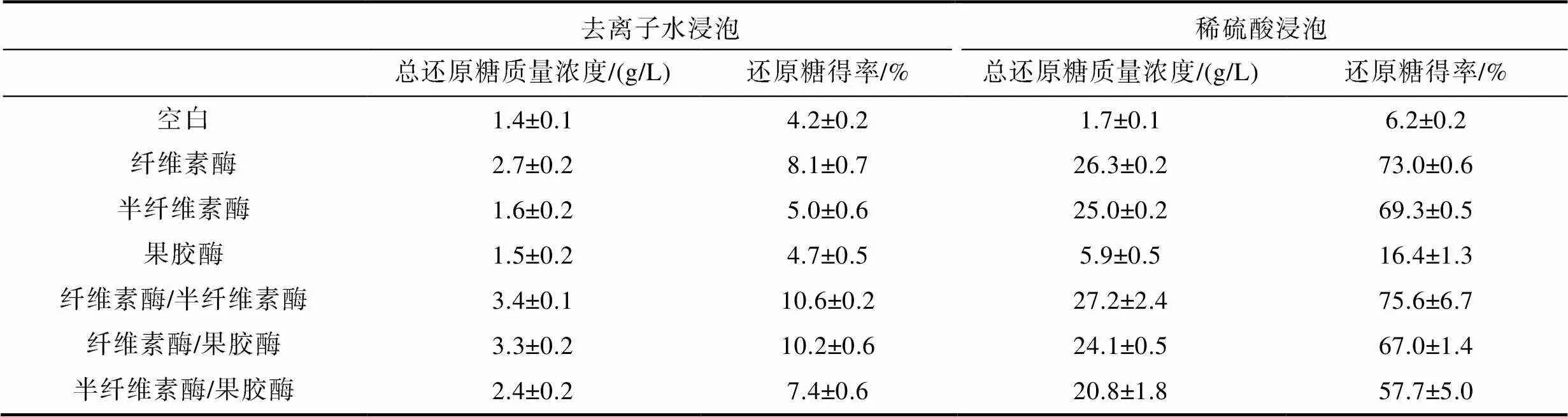
表1 去离子浸泡处理和稀硫酸浸泡处理海带渣后的酶解情况
2.2 高压稀酸预处理对海带渣酶解效果的影响
设置5种稀硫酸处理组(0%、0.3%、1.0%、1.7%和2.5%), 在121 °C、0.11 MPa条件下, 对海带渣进行1、2、3和4 h的高压稀酸预处理, 了解高压稀酸预处理对海带渣后续酶解效果的影响, 结果如图3所示, 所有处理组的还原糖得率及还原糖质量浓度均低于“稀硫酸浸泡后直接酶解”的还原糖得率(73.0%)和还原糖质量浓度(26.3 g/L), 这是因为高压稀酸处理使小部分纤维素发生水解, 这部分还原糖溶于稀酸溶液中且浓度较低, 回收困难, 因此未将其统计在总还原糖得率和总还原糖质量浓度中。预处理时间少于3 h时, 在相同浓度的稀硫酸条件下, 随预处理时间的增加, 酶解的还原糖得率和还原糖质量浓度逐渐增加(图3a~3c), 当预处理时间为4 h时, 酶解效率与3 h时相比明显降低(图3d)。稀硫酸浓度也会影响海带渣的酶解效果, 当稀硫酸浓度低于1%时, 随稀硫酸浓度的提高, 酶解的还原糖得率逐渐增加, 当预处理时间3 h和稀硫酸浓度1.0%时, 还原糖得率和还原糖质量浓度达到最大, 分别为66.4%和21.7 g/L。而当稀硫酸浓度超过1%后, 随稀硫酸浓度的提高, 海带渣酶解的还原糖得率和还原糖质量浓度逐渐降低。
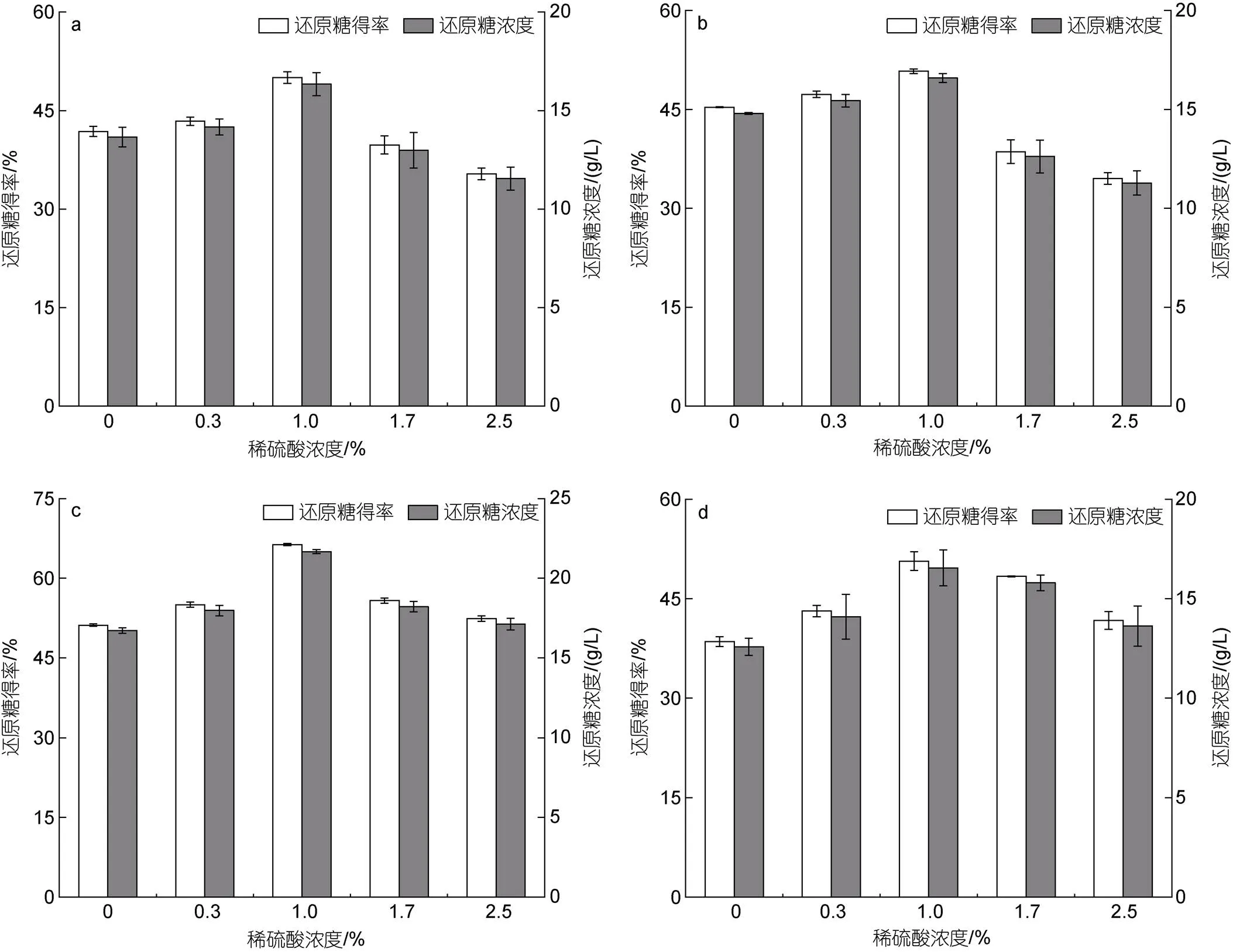
图3 高压稀酸水解对纤维素酶解海带渣还原糖得率的影响
注: a: 1 h处理组; b: 2 h处理组; c: 3 h处理组; d: 4 h处理组
2.3 海带渣的纤维素酶解条件优化
由2.1和2.2可知, 高压稀酸预处理并没有显著提高海带渣的酶解效率, 考虑到高压稀酸处理对设备要求高且能耗大, 综合分析, 稀酸浸泡后直接进行纤维素酶解可能是一种可行的方案, 本文以稀酸浸泡后的海带渣为原料, 通过优化纤维素酶用量、酶解时间和料液比, 获得较优的纤维素酶解条件。
图4a为纤维素酶用量的优化结果, 总还原糖质量浓度随酶添加量增加而增加, 当纤维酶添加量为50 IU/g时, 总还原糖质量浓度最高, 为(34.0±0.3) g/L, 总还原糖得率为89.7%。图4b为酶解时间的优化结果, 酶解时间为0~6 h时, 总还原糖质量浓度快速增加, 酶解时间为12~48 h时, 总还原糖质量浓度增加变缓, 当酶解时间为36 h时, 总还原糖质量浓度达到最高, 为(34.2±0.3) g/L, 总还原糖得率为95.0%。图4c为料液比的优化结果, 总还原糖质量浓度随料液比增加而增加, 料液比1︰5时, 总还原糖质量浓度达到最高, 为(53.4±0.3) g/L, 总还原糖得率为98.9%。
由上述结果初步确定了海带渣的纤维素酶解条件, 纤维素酶用量为50 IU/g, 酶解时间为36 h, 料液比为1︰5。
2.4 海带渣糖化液单糖组成分析
本文对海带渣糖化前后的外观和糖化液组成进行了分析。由图5a和5b可见, 海带渣糖化前的外观颜色呈褐白色, 颗粒表面光滑、间隙较小, 略带海带腥味, 而糖化后的余料为褐色黏糊状, 干燥后呈黑褐色。
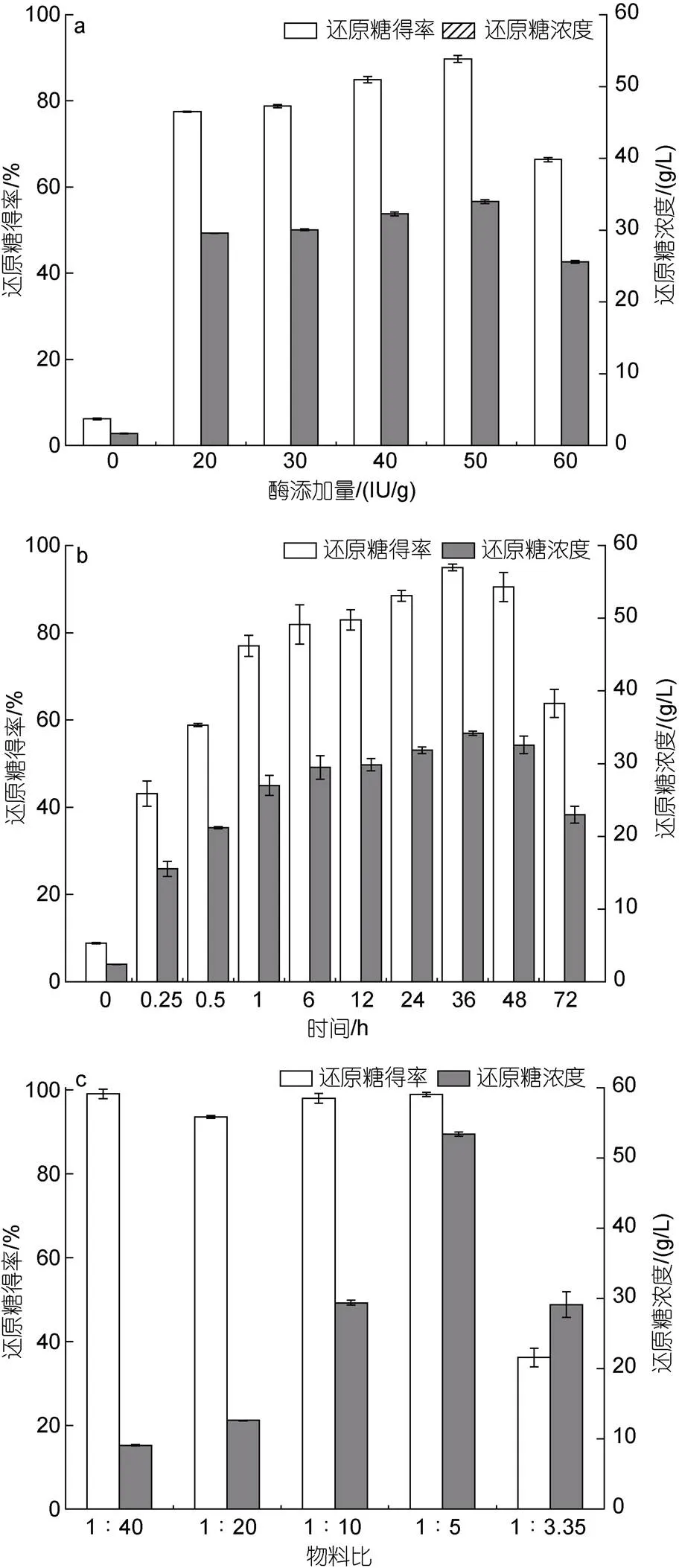
图4 不同条件对稀硫酸浸泡处理后的海带渣酶解的影响
注: a: 纤维素酶用量; b: 酶解时间; c: 物料比例
利用液相色谱法, 对较优纤维素酶解条件下(纤维素酶添加量为50 IU/g, 酶解时间为36 h, 料液比为1︰5)的糖化液进行单糖组成分析, 由图5c可知, 糖化液中的单糖种类以葡萄糖为主, 还存在少量的纤维二糖, 通过计算得到糖化液中葡萄糖质量浓度为48.0 g/L, 由于本实验室的液相色谱仪并未建立甘露糖、半乳糖和岩藻糖进行定量测定方法, 因此海带渣酶解产生的甘露糖、半乳糖和岩藻糖等三种还原糖未进行定量测定。
2.5 海带渣糖化液培养微藻潜力分析
通过设置小球藻SCSIO-559自养(CK)、葡萄糖兼养(GM)、海带渣糖化液兼养(KSM)三个组别, 对海带渣糖化液培养小球藻SCSIO-559进行潜力分析, 不同培养方式下10 d后小球藻SCSIO-559的生物量存在明显差异性, 其中海带渣糖化液组生物量达到(0.93±0.03) g/L显著高于自养组(0.29 g)与葡萄糖组(0.63 g/L) (<0.05) (表2)。
培养10 d后, 对不同培养组小球藻SCSIO-559的脂肪组成进行分析(图6), 海带渣糖化液组的C16︰0 (棕榈酸)相较与其他两组相对比例明显降低, 而C18︰2 (亚油酸)、C18︰3 (亚麻酸)的相对比例相较自养组与葡萄糖组有所增加。同时, 对多不饱和脂肪酸的含量进行分析(图7), 结果显示海带渣糖化液组的多不饱和脂肪酸含量明显高于自养组, 并且与葡萄糖组的结果相差不大(>0.05)。
3 讨论
碳源是微藻生长较关键的影响因素之一, 海带渣经酶解处理形成的糖化液能否应用于微藻培养, 成为海带渣资源化利用的一个重要评判标准。本文利用海带渣糖化液作为有机碳源, 对已经形成较大市场的小球藻进行培养, 以评价海带渣的资源化利用前景。
海带渣购买于青岛海兴源生物科技有限公司, 经分析其主要由粗纤维、灰分和蛋白质组成, 其多糖组成葡萄糖、甘露糖、半乳糖和岩藻糖等4种单糖, 葡萄糖占比最高(图1, 2), 这与董学前等(2018)和房景辉等(2021)的研究结果相一致。酶解糖化法是一种效率高、能耗低的纤维素原料处理方法, 常用的酶包括纤维素酶、半纤维素酶和果胶酶等(吴佐浩, 2014)。本文选用了纤维素酶、半纤维素酶和果胶酶直接对市售海带渣进行酶解处理, 获得了较低的酶解效率(还原糖质量浓度均小于5 g/L), 通过ICP-MS测定发现, 海带渣中钙元素含量较高, 推测海带渣中可能含有大量的水不溶性的碳酸钙或硫酸钙, 这些不溶物覆盖在海带纤维表面, 从而影响酶解效率, 直接对海带渣进行酶解, 酶结合结构域是很难通过木质纤维包裹与纤维素表面直接接触, 从而降低酶解效率。预处理是一种常用的提高纤维素酶解效率的方法, 对木质纤维进行酸预处理可以提高酶解效率, 获得较高质量浓度的糖液(Lee, 2013), 酸处理可以降解部分半纤维素, 促进酶与纤维素的结合(Alvira, 2010)。本文对海带渣采用了稀硫酸浸泡处理后, 海带渣中灰分含量在稀硫酸浸泡处理后大幅降低, 同时大幅提高纤维素酶的酶解效率; 此外, 也可能是稀酸使纤维素结构变疏松, 从而增加与纤维素酶的结合, 刘辉等(2020)利用3种试剂(稀硫酸、稀氢氧化钠和双氧水)对海带渣进行预处理, 结果表明稀硫酸预处理后的酶解效率最高, 这与本文结果一致。
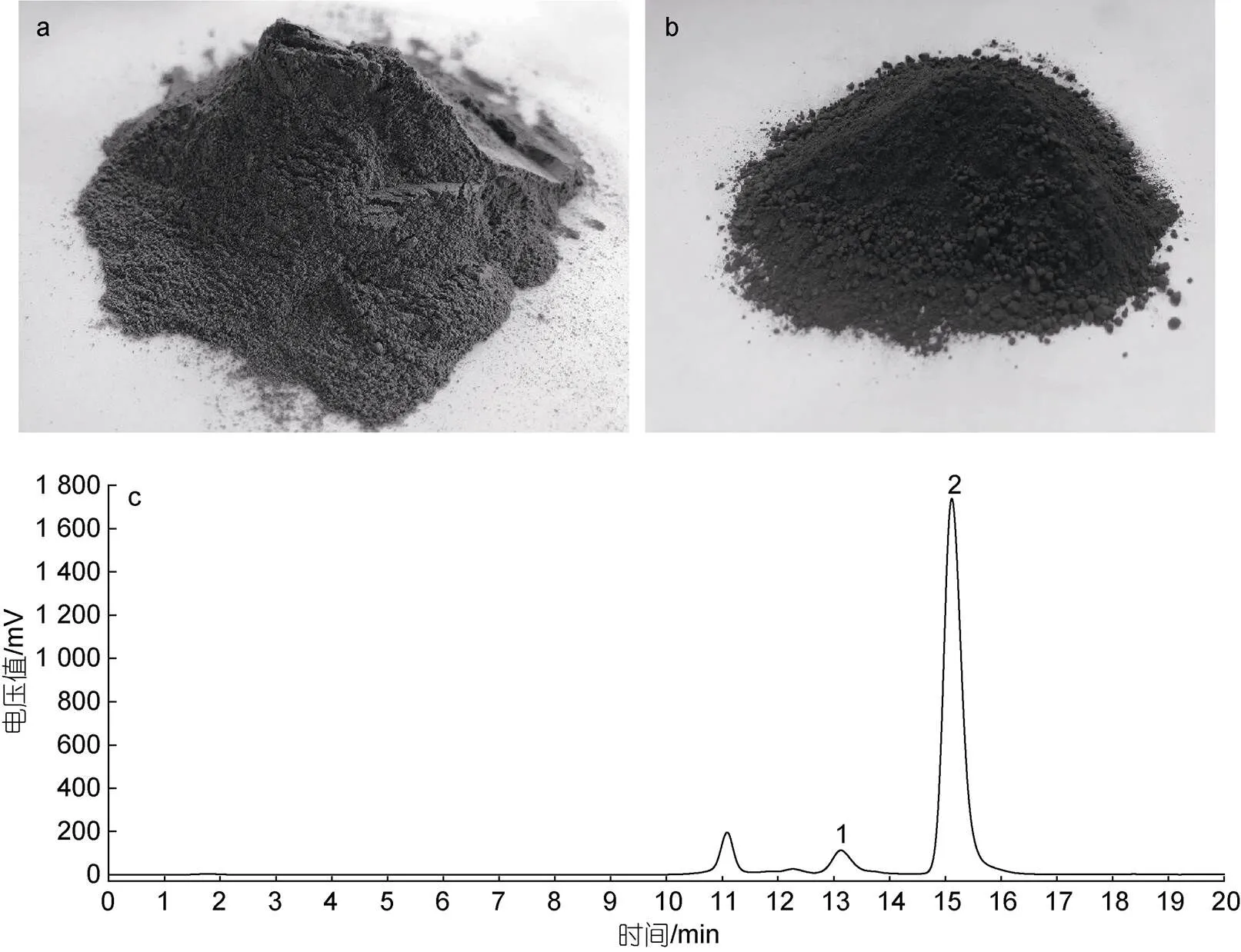
图5 海带渣糖化前后的外观和糖化液的液相色谱图
注: a: 海带渣外观; b: 糖化余料外观; c: 糖化液的单糖组成(1: 纤维二糖; 2: 葡萄糖)

表2 不同培养方式下小球藻SCSIO-559的生物量
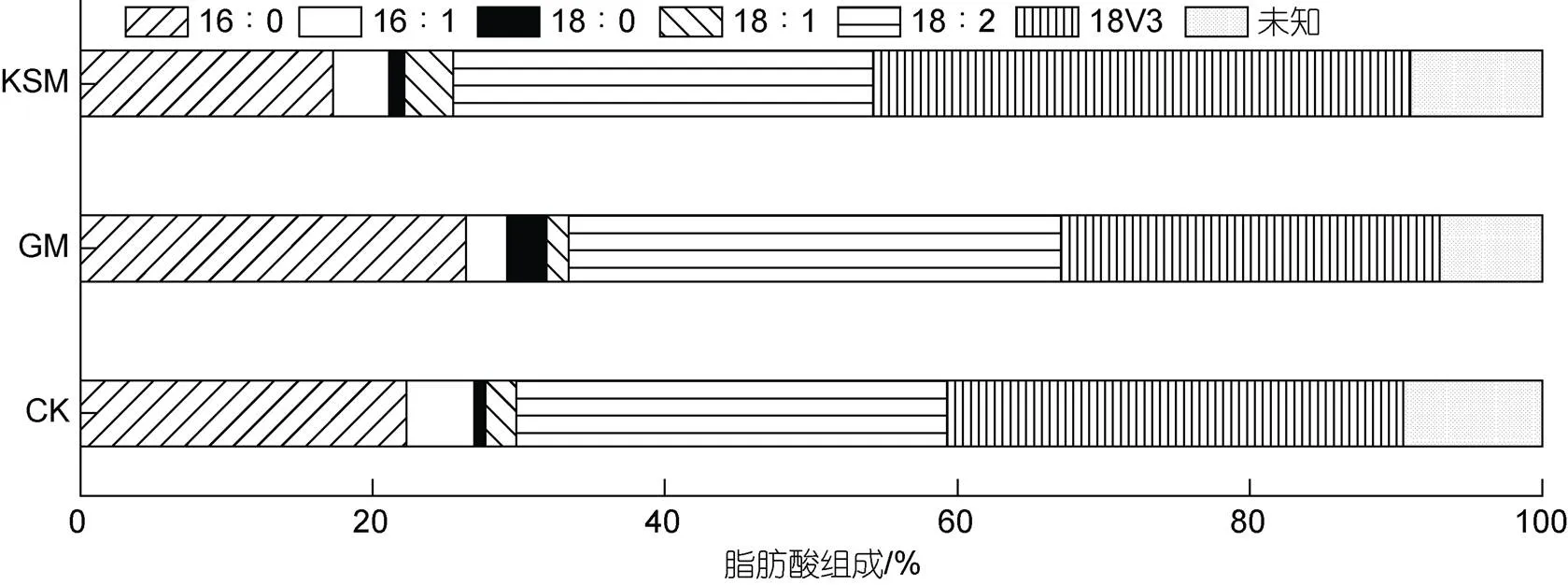
图6 不同培养方式对小球藻SCSIO-559脂肪组分的影响
注: CK: 自养对照组; GM: 葡萄糖培养组; KSM: 海带渣糖化液培养组
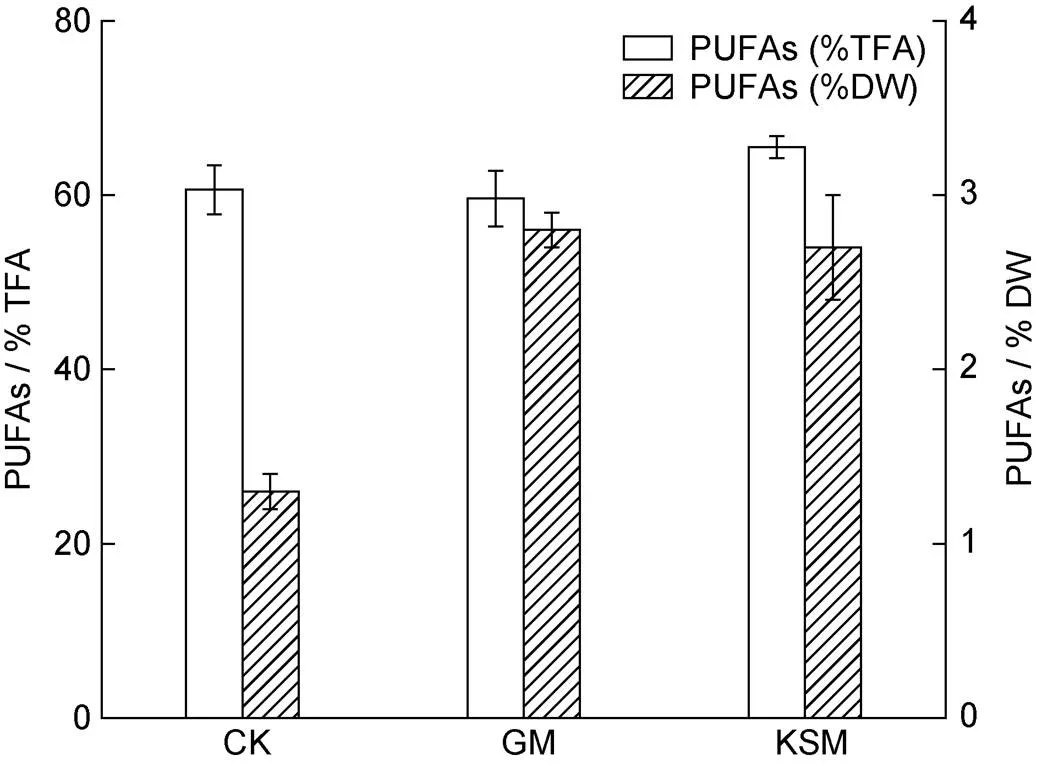
图7 不同培养条件下10 d的多不饱和脂肪酸在总油脂与细胞干重中的比重
注: CK: 自养对照组; GM: 葡萄糖培养组; KSM: 海带渣糖化液培养组; PUFAs: 多不饱和脂肪酸; TFA: 总脂肪酸; DW: 干重
高压稀酸水解是早期预处理纤维原料的办法之一, 主要是降解纤维原料中的半纤维素组成, 以提高酶解效率。本文对高压稀酸水解后的海带渣进行酶解, 发现糖化液中的还原糖质量浓度和还原糖得率随着稀硫酸浓度增加而减少, 这可能是高压稀酸水解处理有助于半纤维素的降解, 但稀硫酸浓度过高时, 会加速半纤维素转化成其他副产物, 如5-羟甲基糠醛或糠醛, 这些副产物会对酶解效率产生不利影响(Fonseca, 2011)。吴佐浩(2014)在120 °C、3 h条件下, 采用不同硫酸浓度(1%~6%)对海带渣进行预处理, 结果显示总还原糖质量浓度随着预处理酸浓度的升高呈先上升后下降的趋势, 这与本文结果相似。此外, 高压稀酸水解时间也会影响纤维素酶解效率, 本文中预处理时间为4 h时, 其酶解效率及还原糖质量浓度与3 h时相比明显降低(图3d)。Liu等(2017)研究发现, 稀酸水解过程中, 稀酸会对纤维素无定形区域进行侵蚀, 由此推测, 高压稀酸水解处理时间越长, 对纤维素无定形区域侵蚀越厉害, 从而导致纤维素酶解转化为糖的效率降低。
稀硫酸浸泡处理后的海带渣酶解进行纤维素酶添加量、酶水解时间和料液比进行优化, 结果显示纤维素酶50 IU/g、酶解36 h, 料液比1︰5, 总还原糖收率可达98.9%, 该糖化工艺成本低、对环境友好。此外, 糖化液主要由葡萄糖和少量纤维二糖组成(图5), 这与本文选用的酶种类有关, 纤维素酶是由外切、内切葡聚糖酶及β-葡萄糖苷酶等组成的复合酶, 有关纤维素酶降解纤维素机理研究表明最终水解产物为葡萄糖(Enari, 1987)。葡萄糖是微生物生长中最常用的碳源, Bouarab等(2004)在培养基中添加葡萄糖, 微芒藻生物量从0.38 g/L增加到0.94 g/L; Cheirsilp等(2012)研究表明, 添加葡萄糖使小球藻积累大量油脂。本文中的糖化液葡萄糖质量浓度为48.0 g/L, 可在微藻培养基中添加海带渣的糖化液, 从而促进微藻生长。
葡萄糖作为常用微藻的有机碳源, 被广泛应用于小球藻、斜生栅藻等藻种的培养, 取得了不错的培养效果(Jin, 2020; Wang, 2021), 而在本研究中, 海带渣糖化液培养小球藻SCSIO-559的生物量明显高于自养组与葡萄糖组(表2), 说明废渣糖化液作为小球藻培养碳源具有可行性。微藻高值化油脂(含多不饱和脂肪酸)是微藻领域重要的发展方向之一, 本文利用海带渣糖化液培养小球藻, 小球藻SCSIO-559的多不饱和脂肪酸含量明显高于自养组与葡萄糖组(图7), 说明海带渣糖化液不仅可以作为小球藻生长的有机碳源, 还可以提高小球藻的营养价值。海带渣糖化液具有比单纯葡萄糖更好的培养效果, 原因可能是: 海带渣糖化液除了含有葡萄糖之外, 还可能存在一些金属离子、微量元素和小分子有机物, 这些物质有可能促进小球藻的生长。本研究中获得的海带渣糖化液在成本上仍然较高, 后续我们将在成本降低方面开展更多的工作, 并尝试优化培养基中的氮、磷等主要元素的比例, 进一步提高小球藻的生物量和多不饱和脂肪酸含量。
4 结论
(1) 海带渣的生化组成中粗纤维与蛋白质含量丰富, 具备资源化利用的前景。
(2) 实验结果表明常温常压稀硫酸预处理耦合纤维素酶分解是一种高效的海带渣糖化方法。初步得到了海带渣糖化工艺条件, 纤维素酶用量为50 IU/g, 酶解时间为36 h, 料液比为1︰5。
(3) 海带渣糖化效率高(总还原糖得率98.9%)、糖化液的单糖组成均一(液相色谱检测结果), 利用海带渣糖化液培养小球藻SCSIO-559生物量(0.93 g/L)显著优于自养与葡萄糖兼养, 且对于小球藻SCSIO-559多不饱和脂肪酸积累效果明显, 具备作为微藻工业化生产兼养(或异养)碳源的潜力。
于殿江, 施定基, 何培民, 等, 2021. 微藻规模化培养研究进展[J]. 微生物学报, 61(2): 333-345.
王闻, 杨康, 朱顺妮, 等, 2016. 小球藻在蔗渣酶解液中的异养生长及其脂肪酸生成[J]. 化工学报, 67(4): 1549-1556.
卢茳虹, 林宗毅, 崔春, 等, 2012. 柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J]. 食品工业科技, 33(23): 93-96.
刘辉, 2020. 2种海带渣糖化工艺的对比研究[J]. 粮食与油脂, 33(3): 61-64.
农业农村部渔业渔政管理局, 2020. 中国渔业统计年鉴[M]. 北京: 中国农业出版社: 23.
杜兆林, 陈洪安, 安毅, 等, 2019. 木质纤维素基重金属吸附剂的制备技术研究进展[J]. 农业环境科学学报, 38(12): 2659-2671.
李涛, 许瑾, 吴华莲, 等, 2018. 不同氮浓度对一株产油绿球藻生长、脂类积累及脂肪酸分布的影响[J]. 生物技术通报, 34(5): 154-162.
吴佐浩, 2014. 南极真菌QP8产低温纤维素酶在海带渣降解转化中的辅助应用及盐碱地碱蓬纤维素乙醇的小试[D]. 济南: 齐鲁工业大学.
陈雪艳, 2020. 两步法预处理增强木质纤维素糖化的研究[D]. 镇江: 江苏大学.
周德庆, 李振, 柳淑芳, 等, 2006. 藻类食品安全性评价与产品开发[J]. 中国食品学报, 6(1): 396-401.
房景辉, 何为, 毛玉泽, 等, 2021. 桑沟湾标准化与传统养殖模式海带的营养成分比较[J]. 渔业科学进展, 42(2): 170-175.
高凤芹, 景媛媛, 德英, 等, 2020. 稀硫酸预处理对杂交狼尾草木质纤维素化学组分和表征结构的影响[J]. 中国农业科学, 53(21): 4516-4526.
董学前, 张艳敏, 张永刚, 等, 2018. 海带中褐藻糖胶分级纯化及结构分析[J]. 食品工业, 39(6): 182-186.
ALVIRA P, TOMÁS-PEJÓ E, BALLESTEROS M,, 2010. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review [J]. Bioresource Technology, 101(13): 4851-4861.
ASHAYERIZADEH O, DASTAR B, POURASHOURI P,, 2020. Study of antioxidant and antibacterial activities of depolymerized fucoidans extracted from[J]. International Journal of Biological Macromolecules, 151: 1259-1266.
BOUARAB L, DAUTA A, LOUDIKI M, 2004. Heterotrophic and mixotrophic growth ofFresenius in the presence of acetate and glucose: effect of light and acetate gradient concentration [J]. Water Research, 38(11): 2706-2712.
CHEIRSILP B, TORPEE S, 2012. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: effect of light intensity, glucose concentration and fed-batch cultivation [J]. Bioresource Technology, 110: 510-516.
CHEN X W, KUHN E, WANG W,, 2013. Comparison of different mechanical refining technologies on the enzymatic digestibility of low severity acid pretreated corn stover [J]. Bioresource Technology, 147: 401-408.
DUBOIS M, GILLES K A, HAMILTON J K,, 1956. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 28(3): 350-356.
ENARI T M, NIKU-PAAVOLA M L, 1987. Enzymatic hydrolysis of cellulose: is the current theory of the mechanisms of hydrolysis valid? [J]. Critical Reviews in Biotechnology, 5(1): 67-87.
FONSECA B G, DE OLIVEIRA MOUTTA R, DE OLIVEIRA FERRAZ F,, 2011. Biological detoxification of different hemicellulosic hydrolysates usingCCTCC M 206097 yeast [J]. Journal of Industrial Microbiology and Biotechnology, 38(1): 199-207.
ISLAM M Z, KITAMURA Y, YAMANO Y,, 2016. Effect of vacuum spray drying on the physicochemical properties, water sorption and glass transition phenomenon of orange juice powder [J]. Journal of Food Engineering, 169: 131-140.
JIN H, ZHANG H, ZHOU Z W,, 2020. Ultrahigh-cell-density heterotrophic cultivation of the unicellular green microalgaand application of the cells to photoautotrophic culture enhance biomass and lipid production [J]. Biotechnology and Bioengineering, 117(1): 96-108.
KHOZIN-GOLDBERG I, SHRESTHA P, COHEN Z, 2005. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga[J]. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 1738(1/2/3): 63-71.
LARSEN J, PINEDA-SÁNCHEZ H, DELGADO-ARELLANO I,, 2017. Interactions between microbial plant growth promoters and their effects on maize growth performance in different mineral and organic fertilization scenarios [J]. Rhizosphere, 3: 75-81.
LEE J Y, LI P, LEE J,, 2013. Ethanol production fromusing an optimized extremely low acid pretreatment followed by simultaneous saccharification and fermentation [J]. Bioresource Technology, 127: 119-125.
LIU Z H, LI X P, XIE W,, 2017. Extraction, isolation and characterization of nanocrystalline cellulose from industrial Kelp () waste [J]. Carbohydrate Polymers, 173: 353-359.
MANCINI G, PAPIRIO S, RICCARDELLI G,, 2018. Trace elements dosing and alkaline pretreatment in the anaerobic digestion of rice straw [J]. Bioresource Technology, 247: 897-903.
MOTA T R, OLIVEIRA D M, SIMISTER R,, 2021. Design of experiments driven optimization of alkaline pretreatment and saccharification for sugarcane Bagasse [J]. Bioresource Technology, 321: 124499.
SLUITER A, HAMES B, RUIZ R,, 2008. Determination of structural carbohydrates and lignin in biomass [R]. NREL/TP-510-42618, Golden, CO: NREL.
WANG Q K, YU Z Y, WEI D,, 2021. Mixotrophicas cell factory for ultrahigh-efficient removal of ammonium from catalyzer wastewater with valuable algal biomass coproduction through short-time acclimation [J]. Bioresource Technology, 333: 125151, doi: 10.1016/j. biortech.2021.125151.
RESOURCE UTILIZATION OF KELP RESIDUE AND APPLICATION INCULTURE
WANG Ming1, 2, PENG Min-Lin1, 3, XU Jin4, LIANG Cui-Yi4, XIANG Wen-Zhou2, 3, LI Tao2, 3
(1. School of Eco-Environmental Engineering, Guizhou Minzu University, Guiyang 550025, China; 2. CAS Key Laboratory of Tropical Marine Bio-resources and Ecology, Guangdong Key Laboratory of Marine Materia Medica, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China; 4. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, CAS Key Laboratory of Renewable Energy, Guangdong Provincial Key Laboratory of New and Renewable Energy Research and Development, Guangzhou 510640, China)
Kelp residue is a type of solid waste from kelp processing. It is of great significance to utilize it to produce high value-added products. Therefore, kelp residue and was used as raw material and saccharified. The total reducing sugar concentration, monosaccharide composition, andcultivation effect of the saccharification liquid were used as the main indexes to evaluate the effects of different pretreatment methods on enzymatic hydrolysis of kelp residue, and the feasibility of kelp residue resource utilization and cultivation of microalgae. The results show that: (1) crude fiber and ash are the main components of kelp residue. (2) After pretreatment with dilute sulfuric acid at room temperature and atmospheric pressure, the total reducing sugar concentration of saccharification solution was increased from 2.7 to 26.3 g/L. Under the optimal saccharification conditions (cellulase dosage 50 IU/g, enzymolysis time 36 h, solid-liquid ratio 1:5), the total reducing sugar concentration of saccharification solution reached (53.4±0.3) g/L, the yield of total reducing sugar was 98.9%. (3) The monosaccharide of saccharification solution included mainly glucose, and its mass concentration was 48.0 g/L. (4) The biomass (0.93 g/L) ofsp. scsio-559 cultured in 2 g/L saccharification solution was significantly higher than that of autotrophic group and 2 g/L glucose group, which is conducive to the accumulation of polyunsaturated fatty acids. Therefore, the saccharified liquid of kelp residue has obvious advantages forcultivation, and is potential to be used as an organic carbon source for microalgae cultivation. This study provided a data support for better resource utilization of kelp residue, and a theoretical basis for improving high value application of kelp residue while reducing production cost and environmental pollution in the microalgae industry.
kelp residue; resource utilization; pretreatment; enzyme; organic carbon source
X798
10.11693/hyhz20210700156
*广东省新能源和可再生能源研究开发与应用开放基金, E039kf0301号; 南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项, GML2019ZD0406号; 贵州省教育厅青年科技人才成长项目, 黔教合KY字[2016] 160号; 广东省自然科学基金研究团队项目, 2016A030312007号。王 铭, 副教授, E-mail: firefoxming@gzmu.edu.cn
李 涛, 硕士生导师, 副研究员, E-mail: taoli@scsio.ac.cn
2021-07-07,
2021-09-14

