miR-7-5p调控NF-κB/RelA信号通路对Ⅱ型肺泡上皮细胞间质转化的作用机制研究
李同林 秦克 宫帅
特发性肺纤维化(IPF)是进展性的呼吸系统疾病,吡非尼酮可治疗IPF,但发病率正在上升[1-3],控制IPF进展的机制仍不清楚。microRNAs是一个长度为22nt的非编码RNA,可结合mRNA的3'UTR调节基因表达[4-5],识别特异性miRNA可以进一步了解发病机制。研究表明miRNAs在肺纤维化在内的疾病中发挥作用[6-8]。例如miR-21介导肺成纤维细胞的纤维化激活。研究发现miR-7-5p参与了疾病的发展,如miR-7-5p过表达调控TK6细胞的增殖[9]。上皮间质转化(Epithelial-mesenchymal transition, EMT)在胚胎发育和肿瘤发展中发挥作用,在此期间,E-cadherin表达丢失,Vimentin和N-cadherin表达增强,细胞获得侵袭能力[10]。TGF-β在细胞发育或肿瘤发展条件下会诱导EMT发生,单纯的TGF-β刺激可诱导细胞EMT[11]。因此,本研究主要是探讨miR-7-5p在TGF-β1诱导的Ⅱ型肺泡上皮细胞间质转化中的意义及作用机制。
资料与方法
一、主要材料
Ⅱ型肺泡上皮细胞A549细胞由中国科学院上海细胞库提供;DMEM(Dulbecco's-modified Eagle's medium)培养基、2.5g/L胰酶和Turbofect购于Thermo Fisher Scientific; Trizol、PrimeScriptTMRT reagent Kit with gDNA Eraser来自日本Takara公司;Transwell小室购自Conring公司;结晶紫由Sigama公司提供;E-cadherin、N-cadherin、Vimentin抗体来自英国Abcam;miR-7-5p mimics、miR-7-5p inhibitor来自GenePharma公司;RelA siRNA质粒来自上海生工生物工程有限公司。
二、实验方法
1 细胞培养 取状态良好的A549细胞,培养于含10% FBS的DMEM培养基中,将培养皿置于37℃、5% CO2,95%湿度的培养箱,细胞汇合度为95%左右时传代培养。
2 细胞转染 将A549细胞培养至细胞密度达75%时,弃培养液,PBS清洗,用空DMEM培养基覆盖单层,取Turbofect、重组质粒、Opti-MEM混匀于新的EP管,静置20 min,缓慢滴加于细胞中,晃匀后置于培养箱,2h后弃上清,添加10% FBS的DMEM培养基,转染48h后收集RNA样和蛋白样。
3 双荧光素酶报告基因活性检测 根据TargetScan软件的预测结果,PCR扩增目的片段,构建RelA wt载体。序列比对正确后再通过点突变试剂盒构建RelA mut载体。将A549细胞培养至细胞密度达75%时,用空DMEM培养基覆盖单层,将RelA wt、RelA mut分别与miR-7-5p mimics、mimics NC质粒共转染至A549细胞,48 h后使用双荧光素酶检测试剂盒测定荧光素酶活性强度。
4 细胞侵袭实验 取4 ℃融化的matrigel,用DMEM稀释至其浓度为1mg/mL,每孔铺100μL matrigel添于每个小室中,干燥使其成胶状。将状态良好的A549细胞添加到Transwell小室,下室添加完全DMEM培养基,37℃恒温培养48h,拭去matrigel胶,用多聚甲醛固定20 min, 0.1%结晶紫染色20 min,显微镜下观察细胞侵袭情况,拍照并记数。
5 细胞划痕愈合实验 将各组稀释后的单细胞悬液按3×105个/孔的密度铺在6孔板,观察细胞铺满板底后,取200 μL枪头,制造细胞线性划痕,PBS清洗2次,加入空培养基,48 h后观察细胞迁移距离。拍照并使用ImageJ软件分析结果。
6 实时荧光定量PCR(RT-qPCR) 取出保存RNA样品,提取细胞总RNA,按cDNA合成试剂盒说明书分别将RNA反转录为cDNA。按照荧光定量PCR试剂盒配置反应体系,用(表1)引物进行实时荧光定量PCR,程序:预变性95℃,10 min,变性95℃,10 s,退火60℃,20 s,延伸72℃,30 s,40个循环,所有反应均设有3个复孔,用2-△△Ct法分析结果。

表1 引物序列
7 Western blot 转染48h后细胞蛋白样,提取总蛋白,使用BCA试剂盒测定蛋白浓度后,配置蛋白胶,取50μg蛋白点样,进行SDS-PAGE凝胶电泳,转移蛋白到PVDF膜,PVDF膜浸泡于5%脱脂奶粉配置的封闭液,3 h后将PVDF膜置于特异性一抗,4℃摇床孵育,TBST清洗,PVDF膜置于二抗中,室温摇床孵育1 h,TBST洗脱PVDF膜,用增强型化学发光液进行蛋白曝光。
三、统计学分析
实验数据均使用SPSS 19.0软件进行统计分析。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,当P>0.05时,表示差异不显著;当P<0.05时,表示差异显著或极显著。
结 果
一、miR-7-5p在TGF-β1诱导的Ⅱ型肺泡上皮细胞A549细胞中表达下调
由(图1A) Western blot和(图1B)结果表明,10 ng/mL TGF-β1处理A549细胞12 h、24 h 和48h后,EMT 相关蛋白 E-cadherin 表达明显下调(P<0.05),N-cadherin 表达明显上调(P<0.05),Vimentin 表达明显上调(P<0.05),表明TGF-β1 作用A549 细胞后明显诱导细胞发生了EMT。由(图1C) RT-qPCR结果可知,和Control组相比,10 ng/mL 的TGF-β1处理 A549细胞12 h、24 h 和48h后细胞内miR-7-5p表达量明显降低(P<0.01)。以上结果表明miR-7-5p在TGF-β1诱导的A549细胞中表达下调。
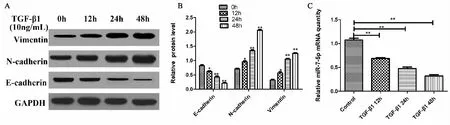
图1 miR-7-5p在TGF-β1诱导的Ⅱ型肺泡上皮细胞A549细胞中表达下调
二、过表达miR-7-5p抑制A549细胞侵袭、迁移和EMT
由(图2A)可知,和Control或mimics NC组相比,miR-7-5p mimics组的miR-7-5p表达量明显升高(P<0.01)。由(图2B-2C)细胞侵袭实验结果可知,和mimics NC组相比,miR-7-5p mimics组的细胞侵袭数目明显减少(P<0.01)。由(图2D-2E)细胞划痕愈合实验结果可知,和mimics NC组相比,miR-7-5p mimics组细胞划痕愈合率明显降低(P<0.01)。由(图2F-2G) Western blot结果可知,和mimics NC组相比,miR-7-5p mimics组细胞N-cadherin蛋白表达量明显下降(P<0.01),Vimentin 表达明显下降(P<0.01),E-cadherin 表达明显上升(P<0.01)。以上结果表明过表达miR-7-5p抑制A549细胞侵袭、迁移和EMT。
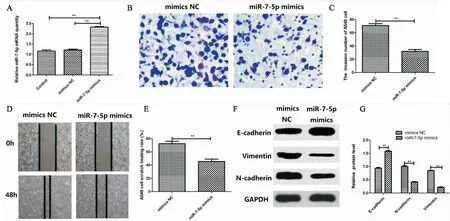
图2 过表达miR-7-5p抑制A549细胞侵袭、迁移和EMT
三、下调miR-7-5p促进A549细胞增殖、侵袭和EMT
由(图3A)可知,和Control或inhibitor NC组相比,miR-7-5p inhibitor组的miR-7-5p表达量明显降低(P<0.01)。由(图3B-3C)细胞侵袭实验结果可知,和inhibitor NC组相比,miR-7-5p inhibitor组的细胞侵袭数目明显增加(P<0.01)。由(图3D-3E)细胞迁移实验结果可知,和inhibitor NC组相比,miR-7-5p inhibitor组细胞划痕愈合率明显升高(P<0.01)。由(图3F-3G) Western blot结果可知,和inhibitor NC组相比,miR-7-5p inhibitor组细胞N-cadherin蛋白表达量明显上升(P<0.01),Vimentin蛋白表达明显上升(P<0.01),E-cadherin蛋白表达明显降低(P<0.01)。以上结果表明下调miR-7-5p促进A549细胞侵袭、迁移和EMT。
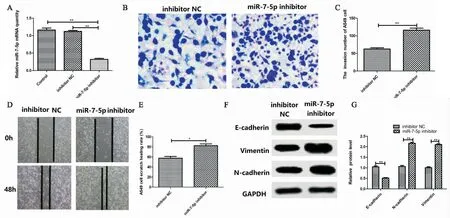
图3 下调miR-7-5p促进A549细胞侵袭、迁移和EMT
四、miR-7-5p对NF-κB信号通路的影响
由(图4A-4B)结果可知,和mimics NC组相比,miR-7-5p mimics组细胞内TAK1和p65磷酸化水平明显降低,p-TAK1/TAK1和NF-κB p-p65/NF-κB p65比值明显降低(P<0.01);和inhibitor NC组相比,miR-7-5p inhibitor组细胞内TAK1和p65磷酸化水平明显升高,p-TAK1/TAK1和NF-κB p-p6/NF-κB p65比值明显增加(P<0.01);。以上结果表明,下调miR-7-5p能够激活细胞内NF-κB信号通路。
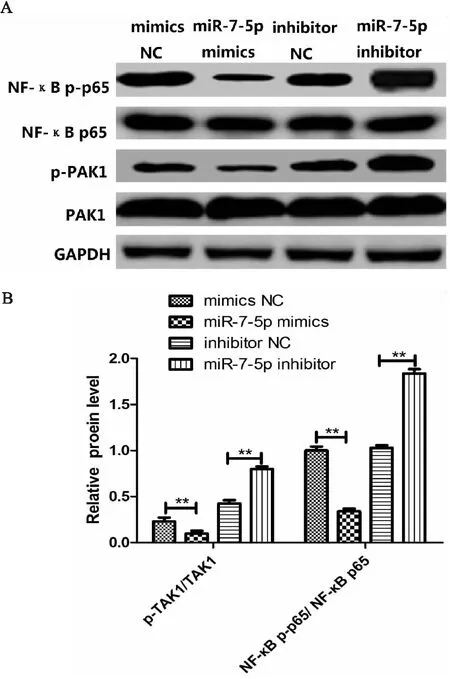
图4 miR-7-5p对NF-κB信号通路的影响
五、miR-7-5p与NF-κB/RelA的靶向和负调控关系
生物学信息软件TargetScan预测miR-7-5p和RelA之间的结合位点见(图5A)。由(图5B)结果可知,和RelA wt+mimics NC组相比,RelA wt+miR-7-5p mimics组细胞荧光素酶活性显著降低(P<0.01),和HRelA mut+mimics NC组相比,RelA mut+miR-7-5p mimics组细胞荧光素酶活性无明显变化(P>0.05)。由(图5C)结果可知,和mimics NC组相比,miR-7-5p mimics组RelA基因表达量明显降低(P<0.01);和inhibitor NC组相比,miR-7-5p inhibitor组RelA基因表达量明显升高(P<0.01)。以上结果表明,miR-7-5p与HOXA5之间具有靶向和负调控关系。
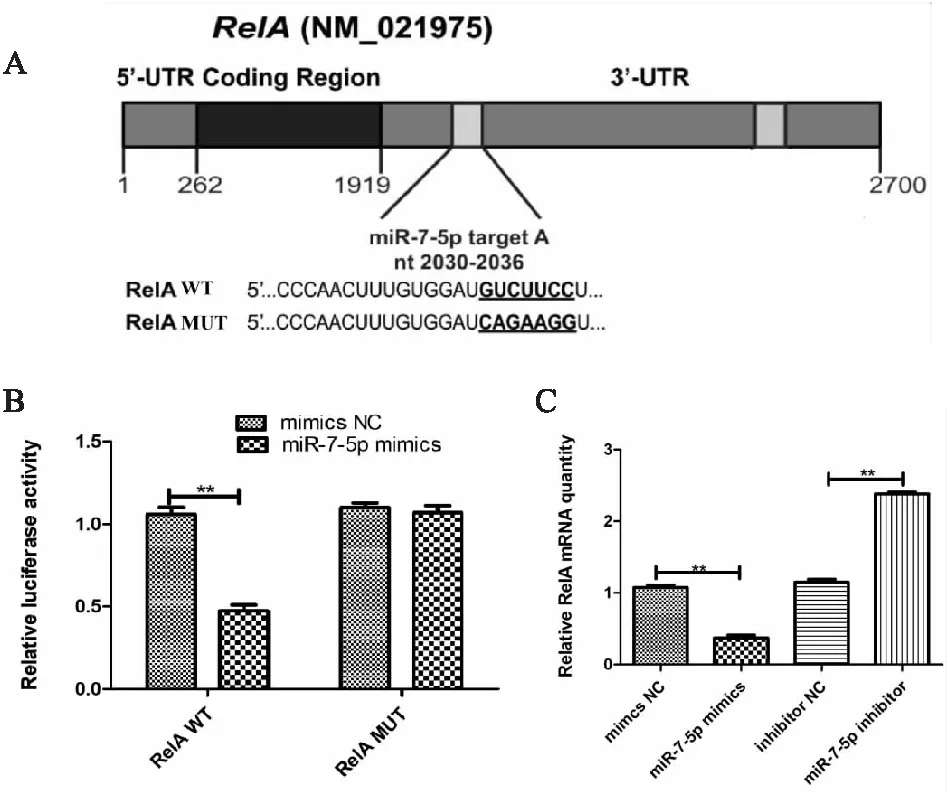
图5 miR-7-5p与NF-κB/RelA的靶向和负调控关系
六、下调RelA抑制A549细胞侵袭、迁移和EMT
由(图6A) RT-qPCR结果可知,和Control组相比,10 ng/mL 的TGF-β1处理 A549细胞12 h、24 h 和48h后细胞内RelA表达量明显升高(P<0.01)。由(图6B)可知,和Control或siRNA NC组相比,RelA siRNA组的RelA表达量明显降低(P<0.01)。由(图6C-6D)细胞侵袭实验结果可知,和siRNA NC组相比,RelA siRNA组的细胞侵袭数目明显减少(P<0.01)。由(图6E-6F)细胞划痕愈合实验结果可知,和siRNA NC组相比,RelA siRNA组细胞划痕愈合率明显降低(P<0.01)。由(图6G-6H) Western blot结果可知,和siRNA NC组相比,RelA siRNA组细胞N-cadherin蛋白表达量明显下降(P<0.01),Vimentin 表达明显下降(P<0.01),E-cadherin 表达明显上升(P<0.01)。以上结果表明下调RelA抑制A549细胞侵袭、迁移和EMT。
讨 论
特发性肺纤维化( IPF)是一种严重的肺部疾病,其特征是不可逆的、进行性的肺功能丧失,迅速导致呼吸衰竭和死亡率增加[12],诊断时的生存率与肺恶性肿瘤是相似的。对IPF发病机制的最新研究表明,异常的伤口愈合、有缺陷的再上皮化、成纤维细胞向肌成纤维细胞转变、以及在成纤维细胞灶处增生性肺炎细胞和细胞外基质成分的过量积累,导致肺结构破坏[13]。近些年研究表明直接参与纤维化、肌成纤维细胞增殖和细胞外基质过度沉积的microRNAs包括miR-21、miR-29和let-7家族成员[14]。IPF成纤维细胞和上皮细胞中miR-21表达增强,这在恶性疾病也可见。miR-29家族是在肺、心脏和肝脏纤维化疾病中发现的首批下调的microRNAs之一。miR-29通过抑制ECM(包括胶原蛋白)以及调节胶原蛋白合成,交联和降解的酶发挥作用[15]。根据之前的报道,在IPF发病机制中对miR-210、miR-185、miR-302c-3p、miR-376c和miR423-5p在慢速和快速IPF进展中差异表达。以上研究表明,microRNAs与IPF的发展具有一定的联系。而在本实验中我们选择了miR-7-5p进行探讨,结果发现miR-7-5p在TGF-β1 诱导的肺泡上皮细胞 EMT 模型中表达下调,结果提示我们miR-7-5p的异常表达参与了肺纤维化的发展,可能通过影响肺泡上皮细胞 EMT进程进而发挥作用。

图6 下调RelA抑制A549细胞侵袭、迁移和EMT
研究表明EMT 在癌症转移和多种纤维化疾病包括肺纤维化的发生、发展中发挥关键作用,是一个可逆过程。EMT在癌症转移和侵袭过程中会使上皮细胞演变成不规则的间充质细胞。在此过程中,细胞间粘附减少,继而使细胞迁移和侵袭能力增加。细胞发生EMT过程时,上皮标志物如 E-cadherin 蛋白表达明显下调,而间质标志物如 Vimentin、N-cadherin和α-SMA蛋白出现上调[16-17]。受此启发,我们在后续实验过程中评估了miR-7a-5p在A549细胞侵袭、迁移和 EMT过程中的作用。结果表明在A549细胞,上调miR-7a-5p表达后,E-cadherin蛋白表达上调、而N-cadherin、Vimentin表达下调,且A549细胞的侵袭和迁移能力明显受到抑制。另外下调miR-7a-5p表达后,明显促进了A549细胞的侵袭、迁移和EMT。我们猜想,miR-7a-5p可能通过调影响A549细胞的EMT而参与肺纤维化进程。近些年有很多文献报道了NF-κB/RelA与各种癌症以及肺纤维化疾病之间的关系。如磷酸化的RB通过抑制NF-κB活化和PD-L1表达来提高癌症免疫力[18]。抑制NF-κB通路可通过下调胰腺癌中的Bcl-2来增强卡巴他赛的抗肿瘤作用[19]。另外还发现HMGB1通过NF-κB激活TGF-β1诱导的特发性肺纤维化疾病。林箐等人发现肺组织中PPARγ的表达减弱,NF-κB的表达增强在肺纤维化的发病过程中起作用[20]。TAKl是丝裂原激活蛋白激酶家族的重要组成部分,结合TAB1蛋白的C端后被激活,磷酸化TAKl修饰活化环上的Ser192、 Thr168、 Thr187 残基,激活了下游信号通路,另外活化后的TAK1会激活NIK最终活化NF-κB通路。而在本研究中我们发现下调miR-7-5p使p-TAK1/TAK1和NF-κB p-p65/NF-κB p65比值明显升高,激活了细胞内NF-κB通路,另外用TargetScan预测还发现miR-7-5p和RelA具有靶向作用,双荧光素酶实验和RT-qPCR验证了二者的相互作用和负调控关系。且RelA在TGF-β1 诱导的肺泡上皮细胞 EMT 模型中表达上调,siRNA下调RelA表达后明显抑制了A549细胞的侵袭、迁移和 EMT。表明miR-7-5p对A549细胞间质转化的调控作用可能是通过RelA实现的。然而在细胞发育过程和肿瘤发生发展等病理过程中,胞内很多信号通路如PI3K-AKT、Wnt/β-catenin、JAK-STAT和ERK/MAPK等都会参与其中,而在本研究中我们只讨论了NF-κB通路和RelA一个作用靶点,这也是本文的不足之处,miR-7-5p可能会通过其它靶点或者是其它通路来发挥其功能,因此miR-7-5p调控A549细胞发展的具体作用机制还需要进一步深入研究。
综上所述,本研究表明miR-7-5p调控NF-κB/RelA信号通路促进A549细胞的上皮间质转化,为深入探讨肺纤维化的发病机制提供了新的理论依据。

