肺腺癌患者差异甲基化区域分析
李晓晗 曹国磊 牛海文 何丽丽 王清鹤 曹嘉芮 袁梦 阿丽亚·奥斯曼 李蕊 罗琴
肺癌是目前全世界死亡率最高的恶性肿瘤[1],其中肺腺癌约占肺癌50%,五年存活率低至20%[2]。DNA甲基化为DNA化学修饰的一种形式,能够在不改变DNA序列的前提下改变遗传表现[3]。研究表明甲基化在正常人群中一直趋于稳定,但是在肿瘤细胞中却呈现出异常表达的征象[4]。差异甲基化区域(DMR)是指基因组上不同组间甲基化值有显著差异的一个片段。目前关于肺腺癌患者差异甲基化区域分析的研究鲜有报道。本研究拟通过850K芯片甲基化检测平台于全基因组水平检测肺腺癌组与正常对照组甲基化区域,利用Bump hunter的方法寻找两组差异甲基化区域,并利用Gene Ontology数据库和KOBAS软件对差异甲基化区域所对应目的基因行进一步GO分析和KEEG分析,旨在探讨差异甲基化区域在肺腺癌发病中的作用机制,为肺腺癌的诊治提供新的理论依据。
资料与方法
一、 一般资料
纳入与排除标准:收取新疆医科大学附属肿瘤医院2019年1月至2019年12月肺腺癌患者与正常对照人群外周血标本各4例,并对其进行DNA提取。肺腺癌患者的诊断标准为:经组织病理学明确诊断为肺腺癌,不患有其他病理学类型肿瘤,无慢性阻塞性疾病,无其他心血管疾病,无栓塞的患者。对照组选取标准:同时期就诊我院的无恶性肿瘤疾病,无慢性阻塞性肺疾病,无心血管疾病,无栓塞等的正常人群作为对照组。所有入组人员均签署相关知情同意书,并经新疆医科大学附属肿瘤医院伦理委员会批准(伦理审批号为:2019BC007)。
二、Illumina Infinium MethylationEPIC BeadChip 芯片(850K芯片)甲基化检测平台对各样本差异甲基化区域进行检测和分析。
1 提取DNA以及样品质检 使用试剂盒(TIANGEN BIOTECH,BEIJING)提取外周血中的基因组DNA。对于DNA,先用分光光度计定量,并将样品调到标准浓度50 ng/μL,20 μL,然后用0.8%的琼脂糖凝胶电泳。样品电泳主带清晰,通常不小于10 kb,没有明显降解,总量5 μg以上,可进行下游的甲基化芯片实验。
2 亚硫酸盐转化 根据ILLumina官方推荐的Zymo EZ DNA Methylation Kit优化方法进行亚硫酸盐转化。
3 DNA扩增 制备MSA3板 在样本中加入0.1N NaOH使DNA变性为单链,经中和后加入全基因组扩增试剂,在37℃恒温条件下过夜孵育。
4 DNA的片段化、重悬 DNA片段化 扩增后产物,经过酶解处理,得到片段化DNA。DNA沉淀:加入异丙醇在4℃下离心沉淀DNA片段。DNA重悬:沉淀后的DNA在空气中干燥后,加入杂交缓冲试剂使DNA沉淀重新溶解。
5 DNA与芯片的杂交 将重悬后的DNA样本与准备好的芯片杂交,置于杂交炉内过夜。在杂交过程中,片段化的DNA经过变性,与特异位点的50个碱基退火。
6 芯片清洗、单碱基延伸、染色 洗去未杂交和非特异杂交的DNA,以捕获到的DNA为模板,在芯片上加入可检测的荧光基团,从而区分样本的甲基化状况。包被芯片:将反应完成的芯片放入XC4试剂中,使其表面包裹上一层粘性透明液体,再将其放入真空环境下干燥1小时,从而将芯片包被,保护其信号稳定较长的时间。
7 芯片扫描和数据提取 提前下载相应的manifest文件,将处理好的芯片放入扫描仪,利用激光激发芯片上单碱基延伸产物的荧光基团,扫描仪获取由荧光基团发出的荧光,并生成原始数据,记录扫描结果存放的位置。由此所得的数据直接导入R包ChAMP软件进行分析,从而就得到每个样本每个位点的甲基化水平数据。
三、数据分析
1 将扫描得到的原始数据,通过R包ChAMP,获得每个位点的原始信号值和DetectionP等信息,然后对数据进行质控,再对探针类型偏倚校正后得到最终可用于差异分析的甲基化水平(Beta值)。
2 差异甲基化区域分析 采用Bumphunter的方法寻找差异甲基化区域,该方法首先根据位点距离信息来聚簇cluster,然后再在每个cluster中筛选出甲基化水平一致的连续候选区段,Bumphunter根据候选区段构建线性统计模型,筛选出明显差异的区段(P<0.05)。
3 功能富集分析 将筛选出来的差异甲基化区域进行GO功能和KEGG途径分析,了解该区域的功能和可能参与的通路。
结 果
一、差异甲基化区域对比分析
肺腺癌患者与正常对照组对比,发现七个差异基因甲基化区域,分别为DMR-1,DMR-2,DMR-3,DMR-4,DMR-5,DMR-6,DMR-7;其中DMR-1、DMR-2、DMR-3 、DMR-4、DMR-6位于6号染色体上,DMR-5位于11号染色体上,DMR-7位于20号染色体上(P<0.05)(表1)。DMR-1(33048254-33048879)宽度为625bp;DMR-2(31148332-31148666)宽度334bp;DMR-3(28557047-28557765)宽度718bp;DMR-4(29648452-29649084)宽度632bp;DMR-5(18433500-18434354)宽度854bp;DMR-6(31539539-31540121)宽度582bp; DMR-7(3051954-3052345)宽度391bp。(P<0.05)。 肺腺癌组DMR-1,DMR-2,DMR-4,DMR-5,DMR-7其CPG位点甲基化水平均高于正常对照组,其目的基因分别是HLA-DPB1、HLA-DPA1,POU5F1,2FP57,LDHC,OXT,差异具有统计学意义(P<0.05)(表2)。而肺腺癌组DMR-3,DMR-6其CPG位点甲基化水平位点低于正常对照组,其目的基因分别是RP5-1186N24.3、SCAND3,LTA,差异具有统计学意义(P<0.05)。
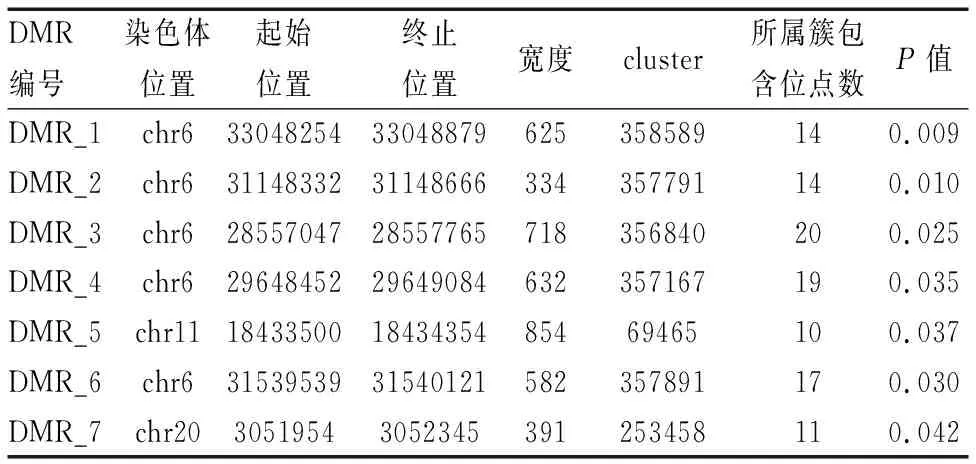
表1 肺癌组与正常对照组差异甲基化区域对比
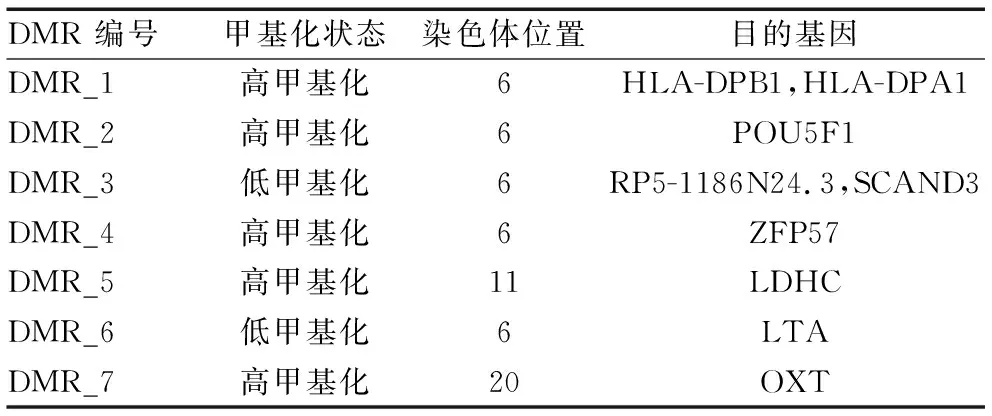
表2 肺癌组与正常对照组差异甲基化区域所含甲基化位点及目的基因
二、目的基因的基因本体论和KEGG途径分析
1 GO功能富集分析 GO富集分析(Gene Ontology,GO)主要包括三个部分,即生物学途径(Biological process),细胞成分(cellular component)和分子功能(Molecular Function)。本课题组以P<0.05为标准,根据这三个部分分别筛选出差异甲基化可能参与的30个GO功能,结果显示肺腺癌差异甲基化基因在多种不同的功能领域中表达,功能富集最显著的有生物学途径中的正向调节干扰素-γ|GO:0032729,乳酸氧化|GO:0019516,丙酮酸的乳酸生物合成过程|GO:0019244,后肠收缩的积极调节|GO:0060450,慢性炎症反应对抗原刺激的正向调节|GO:0002876等途径;细胞成分中的MHCⅡ类蛋白复合物|GO:0042613,内质网膜腔侧的积分成分|GO:0071556,膜的管腔侧|GO:0098576,clathrin-包膜内细胞囊泡膜|GO:0030669,ER至高尔基转运囊泡膜|GO:0012507等成分;分子功能中的催产素受体结合|GO:0031855,神经垂体激素活性|GO:0005185,升-乳酸脱氢酶活性|GO:0004459,肽抗原结合|GO:0042605,肿瘤坏死因子受体结合|GO:0005164等功能;其中在生物学途径方面,主要在正向调节干扰素-γ|GO:0032729中;在细胞成分方面,主要在MHCⅡ类蛋白复合物|GO:0042613中;在分子功能中,主要与催产素受体|GO:0031855等有着一定的关系。
2 KEGG信号通路分析 根据筛选出来的肺腺癌差异甲基化区域进行KEGG分析,以P<0.05为标准筛选出统计学上最显著的30条通路,然后发现肺腺癌差异甲基化区域参与多种疾病中,其中在l型糖尿病|hsa04940、NF-κB信号通路|hsa04064等中与肿瘤的发生有着紧密的联系(图1)。
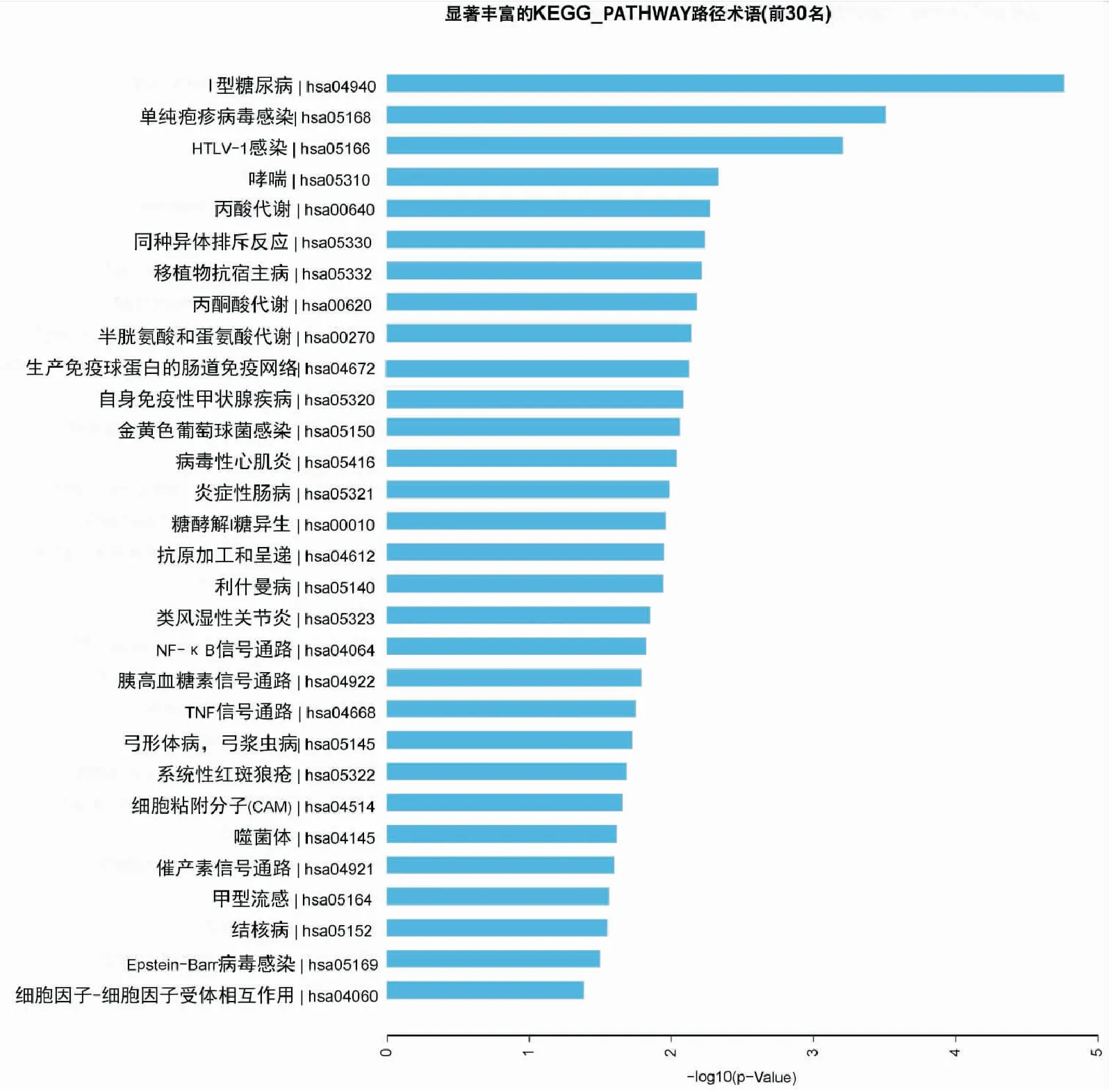
图1 差异甲基化区域在KEGG中的通路图注:上述为差异甲基化区域在KEGG Pathway中所表达的最显著的通路,纵坐标为通路名称,坐标为-log10(P值)。
讨 论
大量研究表明,在表观遗传学上研究最深入的就是DNA甲基化[4],差异甲基化区域是指基因组上不同组间甲基化值明显不同的一个片段。DNA的异常甲基化与癌症等相关疾病有着紧密的联系,它能同时调控原癌基因和抑癌基因的表达,如果原癌基因启动子区域的DNA低甲基化,那么它可以激活原癌基因的表达,而如果抑癌基因启动子区域的高甲基化则使其转录受到抑制作用[5],这样就对肿瘤的产生、发展、治疗以及预后起着至关重要的作用[3]。表观遗传学改变可能不适当地激活或抑制了各种信号通路,从而导致癌症[6]。例如Yang Zhaoyang等学者研究表明PAK1等基因的甲基化在LUAD的发展过程中起着重要的作用,主要通过将多种细胞外信号对癌细胞的侵袭和转移进行一定的影响[7]。
本研究利用高通量甲基化检验平台对肺腺癌组患者及正常组人群全基因组水平检测其目的基因甲基化水平,并对其差异甲基化区域进行进一步的研究,共筛选出了七组差异甲基化区域DMR-1、DMR-2、DMR-3、DMR-4、DMR-5、DMR-6、DMR-7。本研究发现的七组差异甲基化的区域DMR-1的目的基因是HLA-DPB1、HLA-DPA1,DMR-2的目的基因是POU5F1,DMR-3的目的基因是RP5-1186N24.3、SCAND3,DMR-4的目的基因是2FP57,DMR-5的目的基因是LDHC,DMR-6的目的基因是LTA,DMR-7的目的基因是OXT。现已有研究表明HLA-DPB1与EGFR阳性肺腺癌显著相关[8],HLA-DPB1、HLA-DPA1高甲基化与糖尿病有关[9],这与我们课题组在KEGG中的研究相符合,所以我们猜测HLA-DP基因的高甲基化可能导致糖尿病的产生,进而增加了肿瘤的发病率。既往研究表明HLA-DPA1在肝癌中呈现低甲基化状态[10],SCAND3基因在肝癌中甲基化异常增高,这与我们课题组的实验结果不同,但这两个基因都在肺腺癌中有高表达现象,所以还有待我们课题组进一步研究验证,或者其甲基化的状态对肿瘤的产生也有双面效应。已有研究表明POU5F1其启动子高甲基化,可使其在体细胞中表达沉默[11],POU5F1与肿瘤微血管密度呈正相关,肿瘤微血管密度与肿瘤的生物学行为密切相关,POU5F1在肺腺癌中高表达,其表达上调可预测肺癌的发生[12]。现已有研究表明LDHC是癌症患者典型的炎症标记物[13],Koslowski等人进行的一项研究中,也表明NSCLC细胞系可由LDHC高甲基化所介导。曾有研究表明LTA低甲基化在某些炎症中表达,众所周知,炎症反应可以促进肿瘤的发生,而且DNA低甲基化被认为通过诱导基因组不稳定性和原癌基因的活化而促进了肿瘤的发生[3]。关于OXT基因目前仅发现该基因的高甲基化在精神性疾病中呈现高表达趋势,2FP57目前尚无文献报道,但在本研究中却发现2FP57、OXT基因的不同甲基化状态与肺腺癌相关,为广大学者提供了新的探讨方向。
在本研究中,我们为了进一步研究目的基因甲基化的作用机制,为此对其进行了GO分析和KEGG分析。分析表明,这些基因在IFN-γ、MHC Ⅱ类蛋白复合体、催产素及NF-κB信号通路中呈现高度富集状态。有研究表明MHCⅡ类在NSCLC中的肿瘤浸润免疫细胞和肿瘤细胞上表达,并通过免疫系统在肿瘤的进化、抗肿瘤以及促进炎症因子的产生中发挥着重要作用,IFN-γ可以诱导不同的癌细胞系表达MHC-Ⅱ类[14],也在炎症、抗感染、肿瘤免疫检测以及抗肿瘤中发挥重要作用,并限制其清除肿瘤细胞的能力[15],这些与我们的研究一致。众所周知,神经内分泌激素包括催产素,曾有报道与神经内分泌肿瘤有关,如小细胞肺癌,同时还调节着人类的情绪、社会认知、社会行为和压力相关疾病[16];但关于肺腺癌尚未见报道,课题组拟进一步研究。目的基因的各种甲基化状态还主要参与了NF-κB信号通路,NF-κB转录因子调节与炎症、增殖、致癌和凋亡相关的基因有关[17],我们知道癌症的产生、发展等都取决于细胞的生存状况与死亡信号之间的平衡,以上的研究都表明NF-κB参与了癌变过程中的多个步骤,也已经有相关动物模型和细胞培养的研究表明NF-κB与肺癌发生之间的联系,这也证实了本课题组的实验结果。关于通路中富集首位的Ⅰ型糖尿病,有研究表明糖尿病患者的癌症发生率比无糖尿病的人高20~25倍[18]。关于HAS和HTLV-1的感染,目前研究只局限于炎症、某些肿瘤有关,与肺腺癌的关系尚无报道,所以我们考虑由于HAS和HTLV-1都属于病毒感染,而有研究表明长期的炎症感染可能是导致肿瘤发生的一个重要条件,那这两种病毒的感染与肺腺癌的关系值得我们进一步探讨。
综上所述,肺腺癌患者DNA甲基化的状态可能是引起肺腺癌发生的关键因素,第一,HLA-DP,POU5F,以及LDHC的甲基化状态在肺腺癌的发生中起着重要的作用;第二,在GO功能和KEGG通路中,也表明DNA甲基化异常参与了疾病发展的作用机制。总之,这些差异甲基化区域、基因以及信号可能参与了肺腺癌的发生,本课题组拟进行扩大样本含量,同时获取肺腺癌及癌旁的组织学标本,进一步对此进行验证,为肺腺癌的诊治提供新的、深入的理论依据。

