基于不同提取方法对藜麦淀粉性质的比较
李敏,张倩芳,栗红瑜,孟晶岩
(山西农业大学山西功能食品研究院,特色农产品加工山西省重点实验室,山西 太原 030031)
藜麦(Chenopodium quinoa)属觅科藜亚科藜属,双子叶植物[1],距今已有近7000年的历史,最早发现于南美洲安第斯山脉。藜麦米的形状与小米相似,呈扁圆状,颜色分黑、白、红3大类。20世纪80年代,藜麦开始在我国种植,近年来,我国的藜麦产量不断增加,特别是甘肃、青海和山西等地[2]。藜麦对气候和土壤条件有极高的抗性,由于生长地区的海拔和降雨量差异显著,因此培育出了众多不同的藜麦品种,部分品种甚至能够承受海水的盐度[3]。藜麦营养丰富且不含麸质,是麸质过敏者理想的膳食选择。藜麦具有优质完全蛋白,蛋白含量高于大麦、大米和玉米[4],与牛肉相当,赖氨酸含量几乎是小麦和玉米的2倍[5],膳食纤维、矿物质和维生素等比例均衡,是一种可以满足人体基本营养需求的单体植物,享有“营养黄金”和“超级谷物”的美誉[6-8]。藜麦不饱和脂肪酸占脂肪总量83%以上,脂肪酸种类多且配比平衡,含有人体无法合成的亚油酸(ω-6)和α-亚麻酸(ω-3),其含量分别可以达到48.2%~56.0%和3.8%~8.3%[9-10],有维持细胞膜流动性和提高机体记忆力等功效。
藜麦淀粉含量低于水稻和玉米[11],主要分布在外胚乳中,以单独或球形聚合物形式存在,其晶体特性、溶解性、膨胀能力和冻融稳定性等理化特性对藜麦相关食品的加工至关重要。研究开发实用、高效的藜麦淀粉提取方法,对于提高藜麦的经济效益和社会效益具有重要意义。目前,国内外学者对藜麦淀粉的研究主要集中于分离、提取、纯化、特性研究及物化改性等方面[12-14],本研究采用水磨法、碱法及酶法工艺提取藜麦淀粉,并对其性质进行详细地对比分析,分析不同工艺来源的淀粉性质差异,为藜麦淀粉的实际应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
藜麦:静乐田园生态农业综合开发有限公司;蛋白酶(200 000 U/g):北京索莱宝科技有限公司;碘、碘化钾、无水乙醇、氢氧化钠(均为分析纯):天津化工有限公司。
1.2 仪器与设备
HK-8603KW五谷杂粮磨粉机:郑州旭众机械设备有限公司;JS31-300多功能搅拌机:浙江绍兴苏泊尔电器有限公司;TG1850-WS离心机:上海卢湘仪离心机仪器有限公司;Whiteness Checker NW-1色差仪:日本电色工业株式会社;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;DGH-9140A鼓风干燥箱:上海一恒科学仪器有限公司;BCD-238S电冰箱:青岛海尔股份有限公司;HH数显恒温水浴锅:江苏金坛市金城国胜实验仪器厂;JSM-7001F场发射扫描电子显微镜:日本电子株式会社(JEOL);D8 ADVANCE A25型X-射线粉末衍射仪:德国布鲁克AXS GmbH公司。
1.3 试验方法
1.3.1 淀粉化学成分测定
水分:参照GB 5509.3—2016《食品安全国家标准食品中水分的测定》中直接干燥法进行测定。
蛋白质:参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中凯氏定氮法进行测定。
灰分:参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》中方法进行测定。
脂肪:参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中索氏抽提法进行测定。
淀粉:参照GB 5009.9—2016《食品安全国家标准食品中淀粉的测定》中酸水解法进行测定。
1.3.2 提取工艺流程
1.3.2.1 水磨法
藜麦→浸泡 5 h→磨浆[料水比 1∶5(g/mL)]→120 目筛过滤得滤液→离心→去杂→反复清洗离心3次→低温烘干→水磨法提取的藜麦淀粉(quinoa starch extracted by water grinding,WQS)
1.3.2.2 碱法
藜麦→粉碎过筛→碱液浸泡5h[料水比1∶5(g/mL)、NaOH浓度0.2%]→120目筛过滤得滤液→离心→去杂→反复清洗离心3次→低温烘干→碱法提取的藜麦淀粉(quinoa starch extracted by alkali soaking,AQS)
1.3.2.3 酶法
藜麦→粉碎过筛→加蛋白酶酶解[料水比1∶5(g/mL)、加酶量0.5%、酶解时间30 min、温度45℃]→120目筛过滤得滤液→离心→去杂→反复清洗离心3次→低温烘干→酶法提取的藜麦淀粉(quinoa starch extracted by enzymolysis method,EQS)
1.3.3 凝沉性测定
分别准确称取3种淀粉各1 g,配制成质量分数为1%的淀粉乳,沸水浴20 min,其间不断搅拌,糊化结束后冷却至室温25℃,将3种淀粉糊分别转入25 mL带刻度的试管中,于室温(25℃)下静置,以淀粉糊上层清液析出率表示淀粉的凝沉性,上层清液析出率计算公式如下。

1.3.4 溶解度及膨胀度的测定
参照LI等[15]的方法,分别称取3种淀粉配制成质量分数为 2%的淀粉乳,在 60、65、70、75、80、85、90 ℃的水浴锅中,用玻璃棒不断搅拌加热30 min后将淀粉乳离心,分别称取沉淀和上清液中干物质的质量,根据以下公式计算溶解度及膨胀度。

1.3.5 透光度测定
将3种淀粉分别配制成1%的淀粉乳,在沸水中加热30min成淀粉糊,其间不断搅拌,冷却至室温25℃后,以蒸馏水做空白,在波长为650 nm处测定其透光度,之后将淀粉糊置于4℃冰箱冷藏,每隔24 h测定一次透光度。
1.3.6 白度的测定
参照张正茂等[16]的方法,采用色差仪测量,以白板为参照标准,得出 L(明暗度)、a(红绿色)、b(黄蓝色)值,并按如下公式计算白度W。
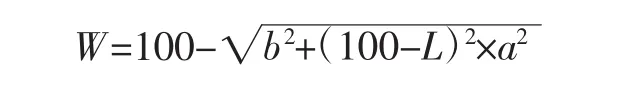
1.3.7 淀粉-碘复合物可见光谱分析
分别准确称取3种淀粉各1 g,配制成质量分数为1%的淀粉乳;再分别取3种淀粉乳各2.5 mL,加80 mL蒸馏水加热糊化,冷却至室温25℃后加入0.5 mL碘液显色,定容至100 mL,充分摇匀后备用。利用分光光度计在波长420 nm~800 nm对待测溶液进行扫描,即得淀粉-碘复合物的可见光谱。
1.3.8 冻融稳定性的测定
将3种淀粉分别配制成5%的淀粉乳,于95℃水浴加热30 min得淀粉糊,不断搅拌后分装到离心管中,经快速冷却后,将淀粉糊在-20℃条件下冷冻,每隔24 h取出,在30℃水浴条件下解冻2 h,离心弃上清液,称取沉淀物质量,按以下公式计算析水率。

1.3.9 外貌形态观察
分别取0.2 g淀粉样品于100 mL烧杯中,加入20 mL无水乙醇进行超声波分散,超声功率为100 W,时间为1 min,用滴管吸取少量超声波处理过的样品分别滴于电镜硅片上,待乙醇挥发后将承载硅片的平皿放于50℃烘箱内烘干,得到分散度较好的扫描电镜样品,对电镜样品喷金处理,利用扫描电子显微镜放大到适当倍数观察淀粉颗粒形态。
1.3.10 晶体特性测定
利用D8 ADVANCE A25型X-射线粉末衍射仪检测,测定条件为电压 40 kV,电流 200 mA,衍射角(2θ)的旋转范围为 5 °~40 °,步长 0.02 °。
1.4 数据处理
采用Origin 9软件作图,SPSS 24.0进行数据分析,结果以平均值±标准偏差表示。
2 结果与讨论
2.1 藜麦淀粉化学成分
3种提取方法得到的藜麦淀粉化学成分如表1所示。

表1 藜麦淀粉化学成分Table 1 Chemical composition of quinoa starch %
由表1可知,提取方法对藜麦淀粉的提取率影响显著,AQS提取率最高,为88.76%,WQS提取率最低,为67.89%。3种淀粉干基纯度都达到了98%以上。不同提取方法提取出的淀粉之间水分、灰分含量差异不显著,脂肪含量差异显著(P<0.05)。因碱性溶液会破坏蛋白质分子中的氢键,使一部分蛋白质分子溶解在碱溶液中,提高蛋白质和淀粉的分离效果,所以AQS中蛋白质含量最低,为 0.46%,与 WQS、EQS差异显著(P<0.05)。
2.2 凝沉性
提取方法对藜麦淀粉凝沉性的影响见图1。

图1 不同提取方法对藜麦淀粉凝沉性的影响Fig.1 Effects of different extraction methods on starch settability of quinoa
由图1可知,提取方法对藜麦淀粉凝沉性的影响差异较大,3种方法提取的淀粉随着时间的延长上清液析出率都逐渐增大。WQS在静置6 h~48 h,上清液析出率迅速增大,淀粉糊沉降较快,60 h时上清液析出率达到23.73%,AQS和EQS静置48 h后,上清液析出率几乎不再增加,静置60 h时,上清液析出率分别达到11.63%、4.43%。凝沉是与糊化相反的一种现象,淀粉在一定水分环境中加热糊化形成淀粉糊,在低温环境中静置一段时间后,淀粉分子自动重排,葡萄糖分子间的羟基不断缔合,分子集聚形成致密的淀粉微晶束,从而沉淀析出[17],析出水分越多,凝沉性越差。在实际应用中,淀粉类食品的凝沉可能是淀粉凝沉、蛋白质交联及水分迁移共同作用的结果[18],试验结果得出,EQS凝沉性最佳,AQS次之,WQS最差。
2.3 溶解度及膨胀度
提取方法对藜麦淀粉膨胀度和溶解度的影响见图2。
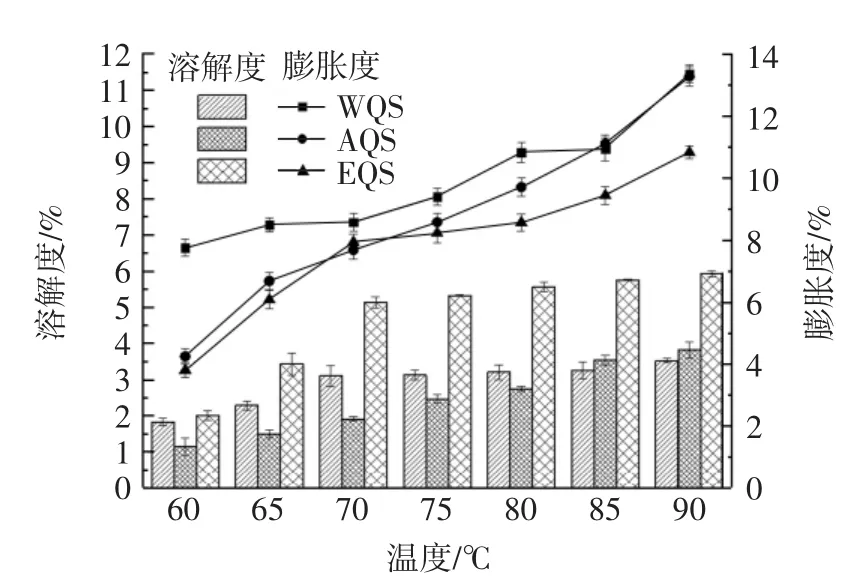
图2 不同提取方法对藜麦淀粉溶解度及膨胀度的影响Fig.2 Effects of different extraction methods on starch solubility and expansion degree of quinoa
由图2可知,3种方法提取的藜麦淀粉膨胀度与溶解度随温度升高均呈现上升趋势,与焦梦悦[19]的研究一致。溶解度结果显示,在60℃~70℃,溶解度快速增大,70℃之后增势不明显,WQS、AQS在60℃~70℃溶解度不超过3%,90℃时分别达到3.54%、3.82%;EQS溶解度明显高于前两者,70℃时已超过5%,90℃时达到5.95%,温度对EQS溶解度的影响相对于WQS与AQS更明显。
膨胀度可以反映淀粉分子与水的结合力,随着温度升高,水的势能增大,首先进入淀粉非结晶区域,淀粉在一定程度内膨胀,温度继续升高,水分子可进入淀粉结晶区,与淀粉分子结合,体积继续快速膨胀,形成凝胶状,达到较高的膨胀度。从膨胀曲线可以看出,藜麦淀粉属于限制性膨胀淀粉,随温度的升高分为初期膨胀期和迅速膨胀期。在70℃时上升趋势出现了明显的转折点,60℃升高到90℃时,WQS膨胀度从7.77%增长到13.39%,该结果与JAN等[20]的研究结果(12.53%)接近,AQS初始阶段膨胀度较低为4.27%,温度大于80℃时,与WQS接近,90℃时增长到13.30%,EQS膨胀度较前两者低,从3.82%增长到10.90%。综上所述,藜麦淀粉溶解度对比为EQS>AQS>WQS,膨胀度对比为 WQS>AQS>EQS。
2.4 透光度
透光度是研究淀粉外在特征的重要指标。淀粉乳吸热糊化过程中,微晶体吸水解体,分子间缔合作用减弱,有序的分子结构变成无序排列,光线从糊化淀粉乳中穿过,晶体的散射与反射现象消失,光的透过性增大,体现为淀粉糊的透光度增大。随着放置时间的增加,糊化淀粉分子重新排列,发生老化,透光度减弱。透光度对比如图3所示。
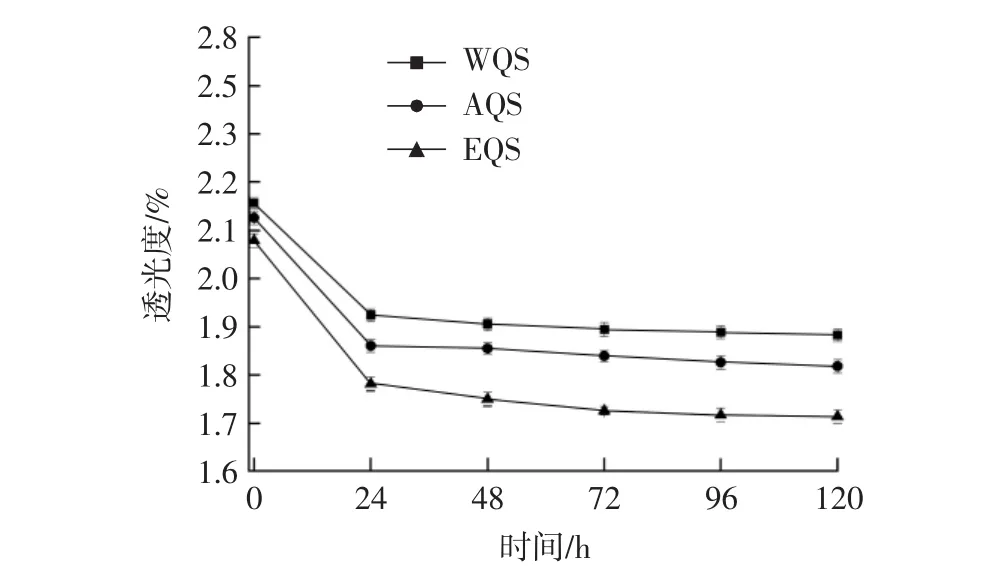
图3 不同提取方法对藜麦淀粉透光度的影响Fig.3 Effects of different extraction methods on starch transmittance of quinoa
由图3可知,3种提取方法得到的藜麦淀粉在放置一段时间后透光度都明显减弱,且在放置24 h后,减弱趋势渐缓,WQS>AQS>EQS,EQS 透光度低于 AQS和WQS,与孔露等[21]、翟娅菲等[22]的研究结果接近,分析其原因可能是酶解过程中产生了有色素的小分子物质,附着在淀粉上影响了淀粉透光度。
2.5 白度
提取方法对藜麦淀粉白度的影响见图4。
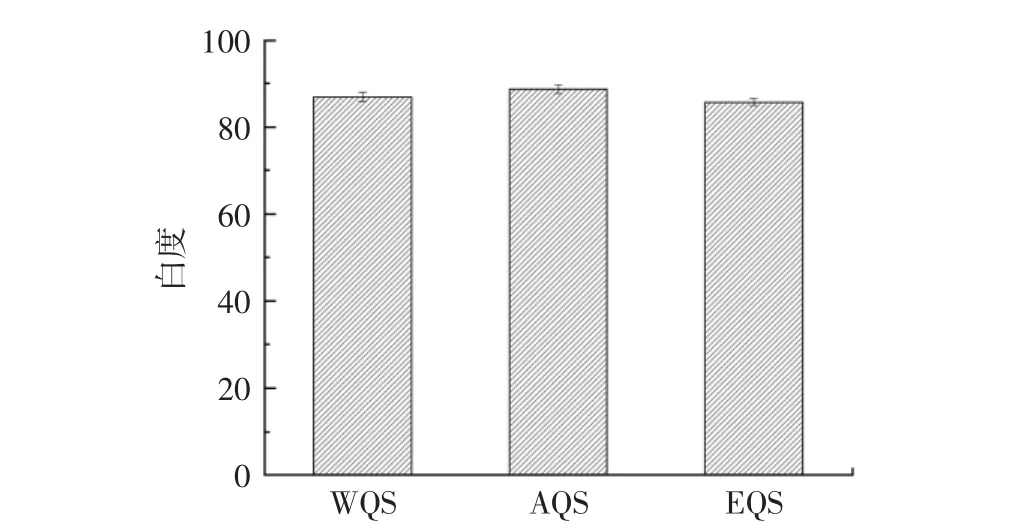
图4 不同提取方法对藜麦淀粉白度的影响Fig.4 Effects of different extraction methods on starch whiteness of quinoa
由图4可知,3种方法提取的藜麦淀粉白度都达到85以上,均符合GB 31637—2016《食品安全国家标准食用淀粉》感官要求。AQS最高,为88.65,EQS白度略低,在酶解过程中有深色的酶解物吸附在藜麦淀粉分子上,常规的清洗没有完全使其脱离下来,导致酶法得到的藜麦淀粉白度偏低[23]。
2.6 淀粉-碘复合物可见光谱分析
提取方法对藜麦淀粉-碘复合物可见光谱的影响见图5。
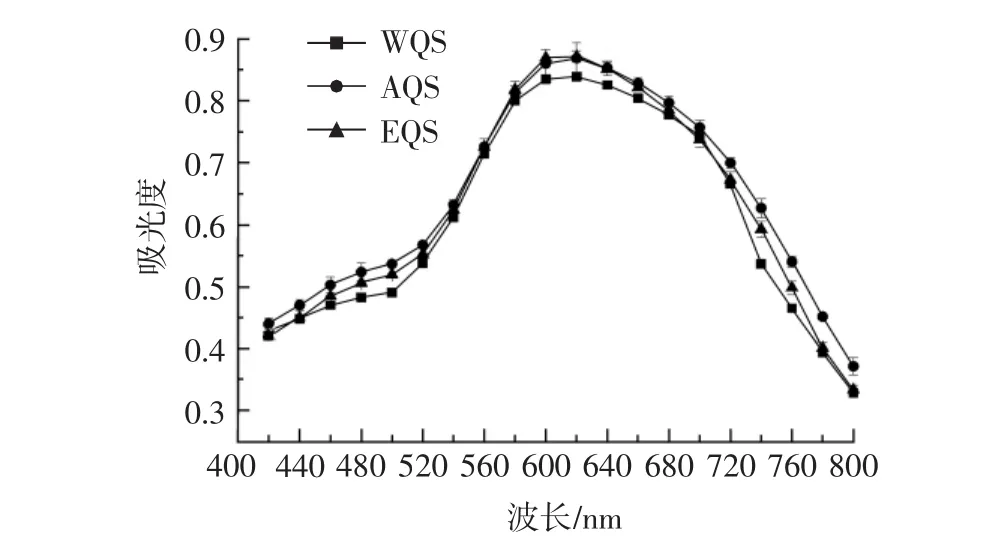
图5 不同提取方法对藜麦淀粉淀粉-碘复合物吸光度的影响Fig.5 Effects of different extraction methods on starch-iodine visible light absorption of quinoa starch
淀粉-碘复合物的吸光度可以反映淀粉直链淀粉的含量,碘蓝值较大者直链淀粉含量较高[24]。由图5可以看出,3种方法提取的藜麦淀粉-碘复合物可见光谱图类似于正态分布曲线,形状非常相似,3条曲线都有最高点且都出现在620 nm处,说明藜麦淀粉的紫外可见光最大吸收波长在620 nm左右,提取方法对藜麦淀粉-碘复合物吸光度的影响差异不大,陈子月等[24]对不同工艺提取的大米淀粉-碘复合物的光谱图分析也得出了相似的结论。
2.7 冻融稳定性
提取方法对藜麦淀粉冻融稳定性的影响见表2。

表2 不同提取方法对藜麦淀粉冻融稳定性的影响Table 2 Effects of different extraction methods on freeze-thaw stability of quinoa starch
冻融稳定性是考察淀粉是否适用于冷冻食品的重要指标,淀粉糊在反复冻结和融化之后析出的水分越少,说明冻融稳定性越好,反之,直链淀粉与支链淀粉分子聚集发生脱水缩合,淀粉胶体结构被破坏,水分析出,会影响食品质构与货架期。淀粉的颗粒大小也会影响冻融稳定性,WQS受到的机械损伤较小,淀粉破损程度低,淀粉颗粒较大,而藜麦在干法制粉过程中会使破损淀粉比例增大,因此AQS和EQS析水率较接近,可能与原料加工方式有关。由表2可知,3种方法提取的藜麦淀粉析水率均不超过50%,EQS最低,为32.55%,WQS最高,为42.04%,资料显示马铃薯、绿豆、藕粉和小麦淀粉析水率均高于50%[25],所以藜麦淀粉更适合冷冻食品的开发,此结果与于跃等[26]、LI等[27]的研究结论一致。
2.8 扫描电镜结果
利用扫描电镜观察3种藜麦淀粉颗粒的表面形态特征,结果如图6所示。

图6 藜麦淀粉扫描电子显微镜图Fig.6 Scanning electron microscope of quinoa starch
由图6可知,藜麦淀粉颗粒形状为不规则的多边形,WQS与EQS的表面较为光滑,无明显孔洞,AQS有少量明显的刻蚀孔洞,说明碱法提取工艺对藜麦淀粉有一定程度破坏。WQS的颗粒大小较为均匀,粒径范围为 1.21 μm~1.97 μm,而 AQS、EQS 中存在少量小颗粒淀粉,分析其原因可能是在样品制备时,通过磨粉机干法研磨,破坏了淀粉原本的形态,出现少量破损淀粉,两者粒径范围较大,为 0.75 μm~1.89 μm。通过扫描电镜图分析,提取方法对藜麦淀粉的表观形态存在一定的影响。
2.9 藜麦淀粉的晶体特性
对3种淀粉的晶体结构进行测定,结果如图7所示。
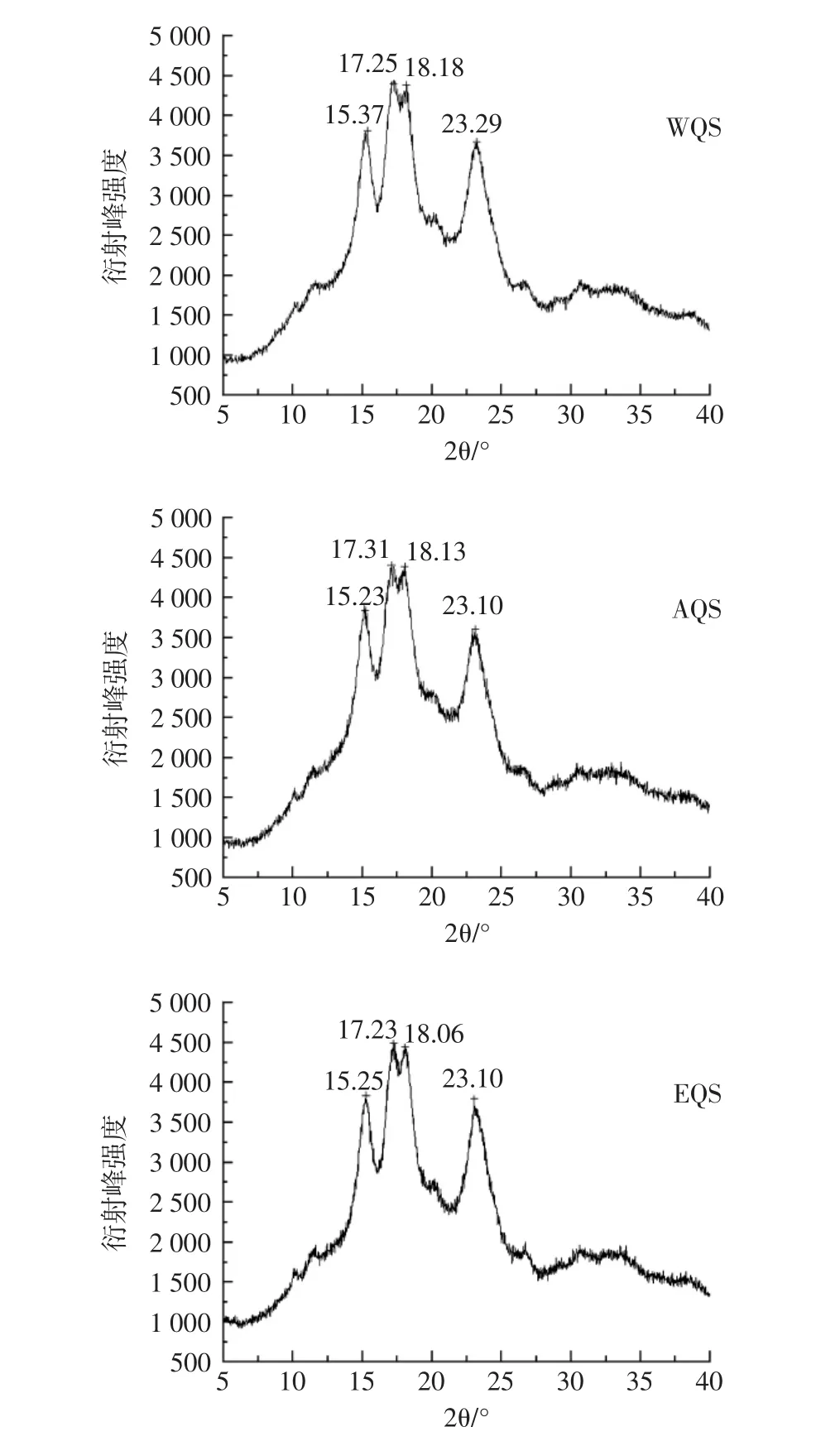
图7 藜麦淀粉X-射线衍射图Fig.7 X-ray diffraction spectrogram of quinoa starch
由图 7 可知,3 种淀粉在 15°、17°、18°和 23°附近均有强的衍射峰,其中17°和18°附近的衍射峰为相连的双峰,证明藜麦淀粉的晶体结构是A-型[28],峰值出现的位置相同,说明提取方法未对藜麦淀粉的晶体结构造成明显改变。经计算得出WQS、AQS、EQS的结晶度分别为38.32%、39.18%、37.53%,三者数值虽有区别但相近,说明提取方法对淀粉结晶层的结晶区和半结晶层的无定形区有微弱影响。
3 结论
本研究采用水磨法、碱法及酶法工艺提取藜麦淀粉,并对其性质进行对比分析,得出不同方法提取的淀粉理化性质存在差异。3种方法的提取率分别为67.89%、88.76%、81.53%。提取方法对藜麦淀粉凝沉性差异影响较大,3种淀粉的溶解度与膨胀度随温度变化规律不一。藜麦淀粉糊透光度较其他谷物低,提取方法对淀粉-碘复合物可见光吸光度影响差异不大,三者的光谱图形状类似,白度都达到85以上。藜麦淀粉的冻融稳定性较好,可用于冷冻食品开发,经冻融后,EQS的析水率最低为32.55%。扫描电镜显示藜麦淀粉粒径小于2 μm,碱法提取工艺对淀粉有一定破坏作用,酶法和碱法提取方法会增大破损淀粉比例。通过X-射线衍射图谱得出藜麦淀粉晶体为A型,结晶度分别为38.32%、39.18%、37.53%,提取方法未改变淀粉晶型。研究提取方法对藜麦淀粉性质的影响,对藜麦淀粉及淀粉类食品的开发应用有积极的促进作用,在实际应用中,可根据对淀粉不同理化性质的需求选择相应的提取方法制备藜麦淀粉。

