门冬胰岛素30注射液中硫酸鱼精蛋白的含量测定
栗凤娟,王军军,梅丽,韩玮璐
(江苏万邦医药科技有限公司,江苏徐州 221004)
一直以来,胰岛素均是治疗糖尿病的有效药物[1-2],但是普通胰岛素存在作用时间短、吸收变异大、有明显作用峰值及较高的低血糖发生率等诸多问题[3-4],因此正逐渐被胰岛素类似物替代[4]。门冬胰岛素是一种胰岛素类似物,用于治疗糖尿病[5-8],门冬胰岛素30注射液是一种预混胰岛素类似物,该药物于2000年8月获得欧洲药物管理局(EMA)批准,2001年11月获得美国食品药品监督管理局(FDA)批准,2003年3月获得中国原食品药品监督管理局批准。门冬胰岛素30注射液中30%为速效成分(门冬胰岛素),70%为中效成分(鱼精蛋白门冬胰岛素),因此既可以提供速效胰岛素成分用于降低餐后血糖,也可以提供中效胰岛素成分用于降低空腹和基础血糖。与精蛋白人胰岛素注射液相比,门冬胰岛素30注射液中速效部分具有起效时间更短,维持时间更短,即快速起效、快速回落的优点,更加符合生理性胰岛素分泌特征[9]。门冬胰岛素30注射液作为通过口服降糖药不能很好控制血糖的患者的胰岛素起始治疗方案,对餐后血糖水平改善更好,对血糖控制更全面,并且不会增加发生低血糖事件的风险。
门冬胰岛素30注射液中的硫酸鱼精蛋白是从鱼类的精子或者成熟的睾丸细胞核中提取的聚阳离子抗菌短肽的硫酸盐,它包括4种主要多肽[10]。鱼精蛋白的含量和质量在很大程度上影响门冬胰岛素30注射液的起效时间、峰值浓度及持续作用时间等[11],因此需要建立一个操作简便,且精密度和准确度均良好的方法来测定门冬胰岛素30注射液中硫酸鱼精蛋白的含量。SNYCERSKI等人报道可以使用HPLC法测定硫酸鱼精蛋白含量,采用粒径为10 μm的二氧化硅填充柱,流动相为0.15%三氟乙酸-乙腈(92∶8),pH值为2.5,流速为1.0 mL/min,柱温为25 ℃,检测波长为214 nm,在15~100 μg/mL范围内,硫酸鱼精蛋白峰面积与浓度呈线性关系(r=0.9926)[12]。但是在该色谱条件下,制剂中的胰岛素和防腐剂等物质不能快速洗脱出来,因此不适用于门冬胰岛素30注射液中硫酸鱼精蛋白的检测。HOFFMANN等人研究发现,使用C8色谱柱,以0.1 mol/L磷酸二氢钠缓冲液(pH值为2.0)∶乙腈(97.5∶2.5)为流动相,流速为1.0 mL/min,柱温为25 ℃,可以分离出硫酸鱼精蛋白中4个主要多肽[13],但是该方法中多肽峰的分离度及保留时间易受流动相中乙腈含量的影响,重复性差。
因此本文开发了一种适用于门冬胰岛素30注射液中硫酸鱼精蛋白的高效液相色谱检测方法,旨在解决上述方法的弊端。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
乙腈,色谱纯,Merck KGaA;二水合磷酸二氢钠,分析纯,国药集团化学试剂有限公司;磷酸,质量分数≥85.0%,国药集团化学试剂有限公司;硫酸鱼精蛋白,1 kg/瓶,批号3JC0001,BioChem Corporation;试验产品为门冬胰岛素30注射液,3 mL:300单位,批号201903504,江苏万邦生化医药集团有限责任公司。
1.1.2 仪器
SPD-M20A高效液相色谱仪,日本岛津公司;FE20酸度计、XS105分析天平,梅特勒国际贸易有限公司。
1.2 试验方法
1.2.1 色谱条件
0.1 mol/L磷酸二氢钠缓冲液(pH值为1.8):取二水合磷酸氢二钠20.7 g,加水900 mL溶解,用磷酸调pH至1.8,加水至1 000 mL,经微孔滤膜(水系0.45 μm)过滤。
流动相A为0.1 mol/L磷酸二氢钠缓冲液(pH1.8),流动相B为0.1 mol/L磷酸二氢钠缓冲液(pH值为1.8)-乙腈(65∶35)。
色谱柱:Hypersil GOLD C18(250 mm×4.6 mm,5 μm);柱温:55 ℃;流速:1.0 mL/min;检测波长:214 nm;进样器温度:5 ℃;进样量:100 μL。
按表1进行梯度洗脱,将4~15 min所有峰面积之和作为硫酸鱼精蛋白的总峰面积,以外标法计算出硫酸鱼精蛋白的含量。
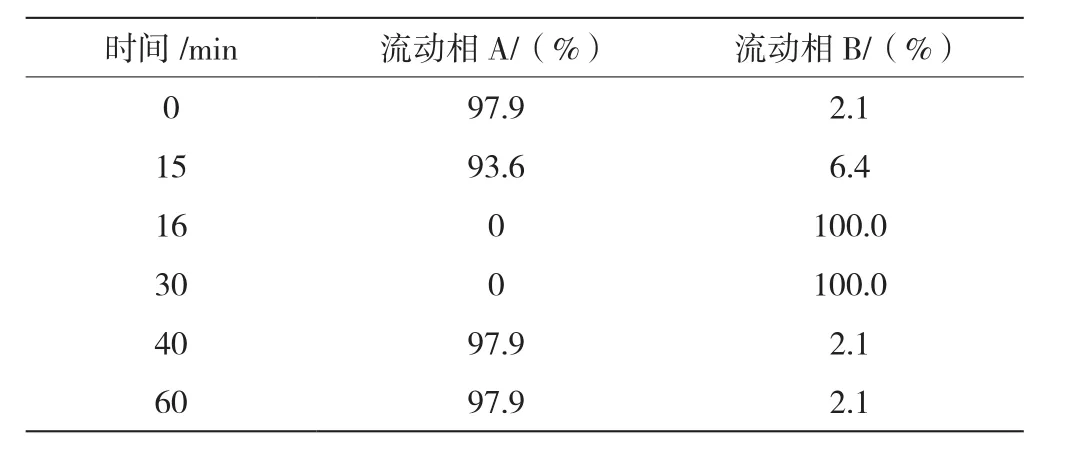
表1 门冬胰岛素30注射液硫酸鱼精蛋白含量测定梯度洗脱表
1.2.2 对照溶液的制备
称取硫酸鱼精蛋白适量,精密称定,用0.01 mol/L盐酸溶液稀释并定量制成每毫升中含鱼精蛋白0.32 mg的溶液,混匀,过滤即得对照品溶液。
1.2.3 空白溶液的制备
按门冬胰岛素30注射液的处方配制不含硫酸鱼精蛋白的溶液,每毫升溶液中加入9.6 mol/L的盐酸溶液3 μL酸化,混匀后过滤即得空白溶液。
1.2.4 供试品溶液的制备
(1)标准曲线溶液:精密称取硫酸鱼精蛋白约140 mg,置于50 mL容量瓶中,用0.01 mol/L盐酸溶解,摇匀;依次稀释,分别制成溶度为0.196 mg/mL、0.224 mg/mL、0.252 mg/mL、0.280 mg/mL、0.308 mg/mL、0.336 mg/mL和0.364 mg/mL的对照品溶液。
(2)稳定性溶液:取门冬胰岛素30注射液适量,每毫升中加入9.6 mol/L盐酸3 μL酸化,混匀后过滤。分 别 于 0 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h和48 h时进样测定。
(3)重复性溶液:取门冬胰岛素30注射液,每毫升中加入9.6 mol/L的盐酸溶液3 μL酸化,混匀后过滤。平行处理6份。
(4)中间精密度溶液:取门冬胰岛素30注射液,每毫升中加入9.6 mol/L盐酸溶液3 μL酸化,用0.45 μm的滤膜过滤。两名分析人员分别平行处理6份,分别记为中间精密度1~6和中间精密度7~12,并使用不同的仪器测定。
(5)准确度溶液:按照门冬胰岛素30注射液处方量配制含鱼精蛋白为80%、100%、120%处方量的3个浓度的制剂,分别平行3份,每个样品运行2次。
2 结果与分析
2.1 专属性
空白溶液、对照品溶液、供试品溶液图谱分别见图1、图2、图3。结果表明,硫酸鱼精蛋白多肽峰(4~15 min)与门冬胰岛素、苯酚峰及间甲酚峰(22~25 min)的分离度大于10,且硫酸鱼精蛋白多肽峰出峰时间区域无其他峰干扰。
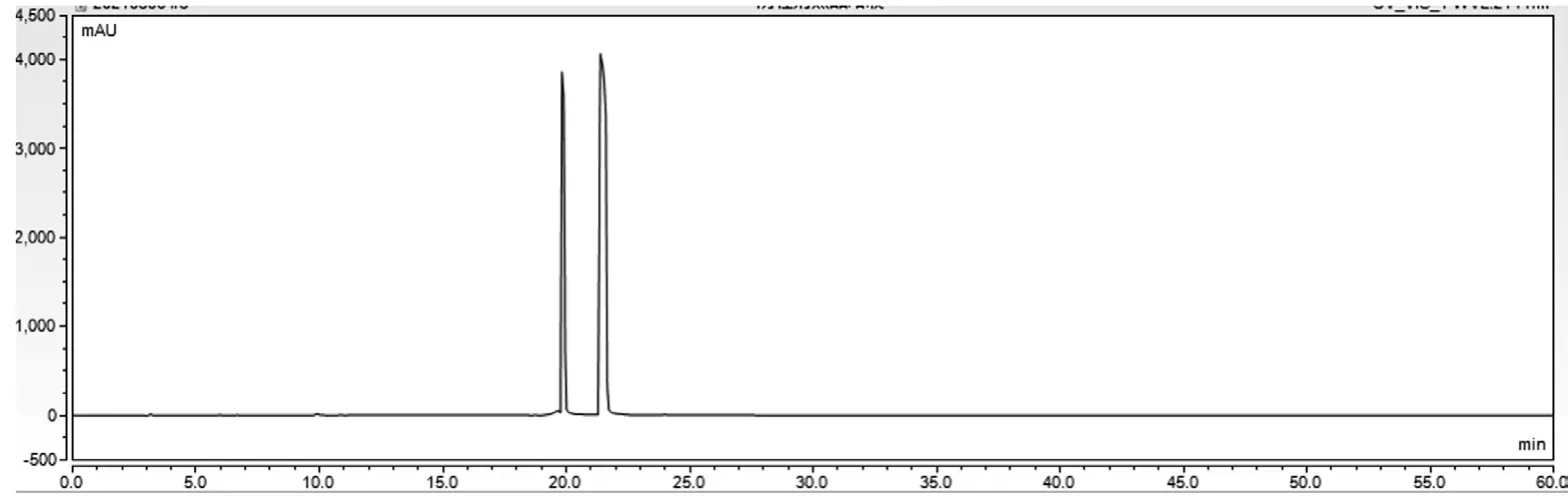
图1 空白溶液图谱
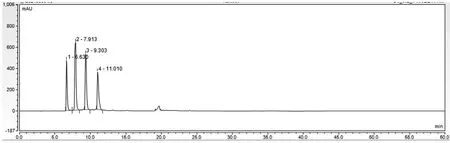
图2 对照品溶液图谱
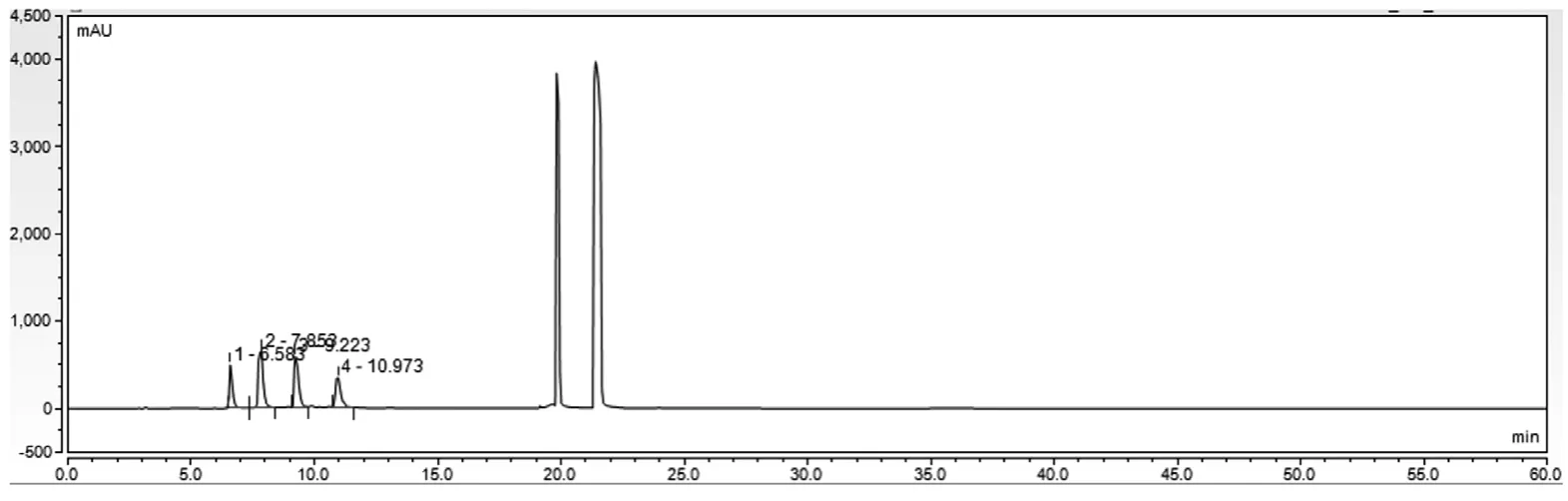
图3 供试品溶液图谱
本文使用流动相A为磷酸盐缓冲液(pH值为1.8),流动相B为磷酸盐缓冲液(pH 1.8)-乙腈(65∶35),硫酸鱼精蛋白多肽在前15 min通过低浓度的乙腈进行梯度洗脱时分离出来;门冬胰岛素和防腐剂在流动相B的比例提高到100%时快速洗脱出来;然后流动相从30 min恢复到初始比例,并运行至60 min结束。按照洗脱顺序,前4个洗脱峰Pro-1、Pro-2、Pro-3、Pro-4为硫酸鱼精蛋白的4个主要的多肽,代表了硫酸鱼精蛋白的主要成分[14]。以4~15 min洗脱出来的所有作为硫酸鱼精蛋白的总峰面积,按外标法计算硫酸鱼精蛋白含量[15]。
2.2 线性与范围
门冬胰岛素30注射液硫酸鱼精蛋白含量测定线性结果见表2,以硫酸鱼精蛋白的峰面积(A)对浓度(C)进行线性回归,线性回归方程为A=1 654.9C+4.4146,相关系数r=0.9999,线性关系良好。
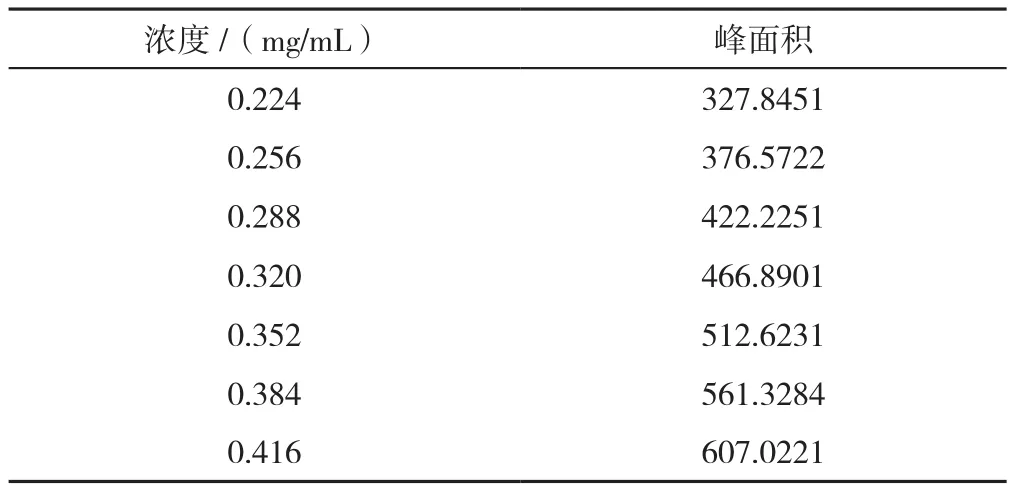
表2 门冬胰岛素30注射液硫酸鱼精蛋白含量测定线性结果
2.3 稳定性
稳定性溶液硫酸鱼精蛋白峰面积RSD(n=9)为0.81%,表明供试品溶液至少在48 h内稳定,见表3。
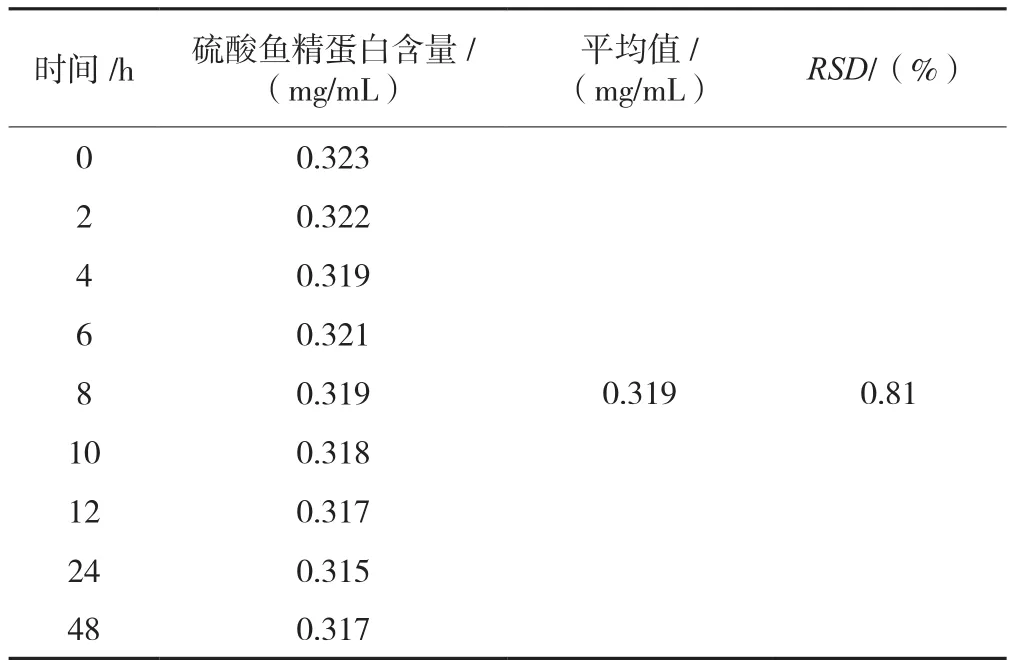
表3 门冬胰岛素30注射液硫酸鱼精蛋白含量稳定性测定结果
2.4 重复性
重复性溶液的RSD(n=6)为0.43%,表明该方法重复性良好,见表4。
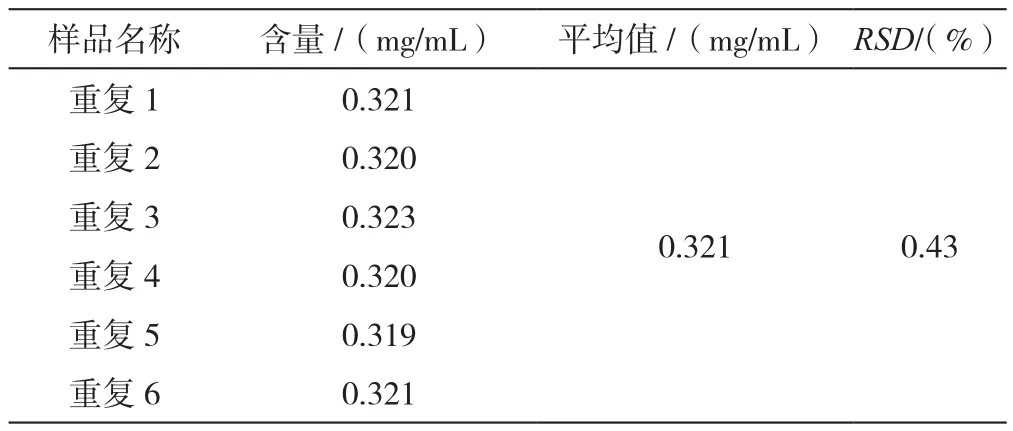
表4 门冬胰岛素30注射液硫酸鱼精蛋白含量测定重复性结果
2.5 中间精密度
中间精密度溶液的RSD(n=12)为0.41%,表明该方法中间精密度良好,见表5。
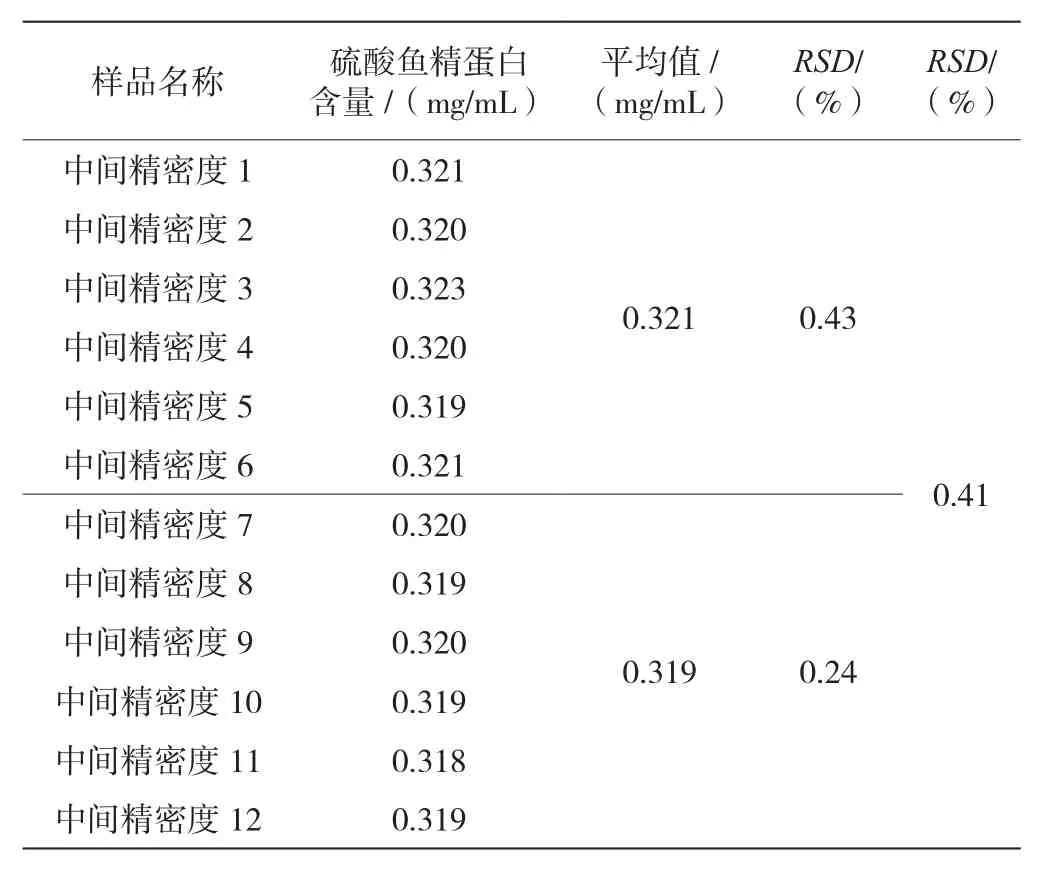
表5 门冬胰岛素30注射液硫酸鱼精蛋白含量测定中间精密度结果
2.6 准确度
80%、100%、120%浓度的平均回收率为100.32%,RSD为0.78%(n=9),表明回收率良好,见表6。
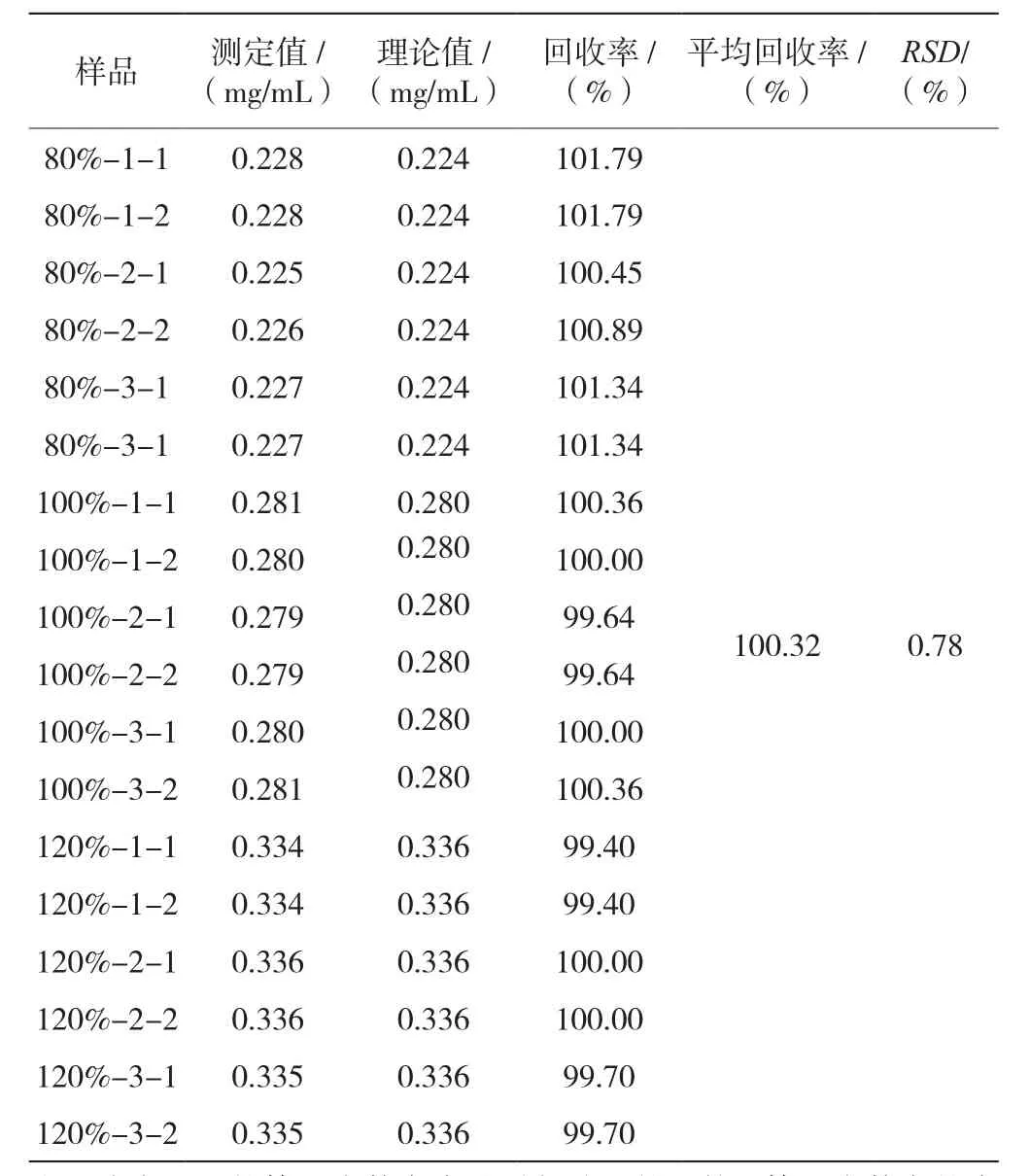
表6 门冬胰岛素30注射液硫酸鱼精蛋白含量测定回收率结果
3 结论
本文建立了门冬胰岛素30注射液中硫酸鱼精蛋白的测定方法,该方法以0.1 mol/L磷酸二氢钠缓冲液(pH1.8)为流动相A,0.1 mol/L磷酸二氢钠缓冲液(pH1.8)-乙腈(65∶35)为流动相B,色谱柱为Hypersil GOLD C18(250 mm×4.6 mm,5 μm);柱温为55 ℃;流速为1.0 mL/min;检测波长214 nm;进样量为100 μL。此法可以快速、简便、准确地测定门冬胰岛素30注射液中硫酸鱼精蛋白的含量。

