DWI和PWI对宫颈癌放疗效果的预测及放疗前后影像学特征与病灶径线变化的相关性
庞奇峰 金蕴菁 徐栋
宫颈癌是常见的女性生殖系统肿瘤,其发病率仅次于乳腺癌,我国每年约有13万例的新发病例[1]。目前,宫颈癌的治疗以手术治疗和放疗为主,化疗为辅,其中放疗包括外照射和腔内放疗,适用于各期宫颈癌,具有不可替代性[2]。既往研究显示,Ⅰ~Ⅳ期宫颈癌患者放疗后5年生存率均较理想[3]。但因为肿瘤存在异质性,对放疗敏感性也有不同,所以在治疗前判断肿瘤的放疗敏感性对制定治疗方案有着重要意义。MRI检查是评价宫颈癌放疗疗效的最佳方法之一,但常规MRI检查只能观察肿瘤的形态、大小、信号等形态结构特征,而扩散加权成像(diffusion weighted imaging,DWI)可检测组织内水分子的扩散运动,与表观弥散系数(apparent diffusion coefficient,ADC)相结合还可在肿瘤发生形态结构改变前反映其微观变化[4]。灌注加权成像(perfusion weighted imaging,PWI)可检测组织内血流灌注的变化,通过测量强化峰值(peak height,PH)、最大上升斜率(maximun slope of increase,MSI)和达峰时间(time to peak,TTP),进一步判断肿瘤内部的微血管生成情况,在脑部肿瘤中得到广泛应用。PWI能在肿瘤出现形态改变之前就探测到肿瘤内微血管生成的状态[5]。近年来,宫颈癌患者的放疗敏感性评估是妇科肿瘤临床研究的重点。笔者通过检测宫颈癌患者放疗前后ADC、PH、MSI、TTP的变化,探讨上述指标变化与肿瘤径线的相关性,并分析4项指标单独及联合检测对宫颈癌患者放疗效果的预测效能,以期为宫颈癌患者放疗敏感性评估提供依据,现报道如下。
1 对象和方法
1.1 对象 选取2019年10月至2021年9月绍兴第二医院就诊并接受放疗的宫颈癌患者57例为放疗组,年龄 41~69(54.91±7.00)岁,BMI 14.90~28.90(21.50±3.04)kg/m2;已婚39例,未婚18例;按照国际妇产科协会(International Federation of Gynecology and Obstetrics,FIGO)2009宫颈癌分期[2],分为Ⅱb期11例、Ⅲa期19例、Ⅲb期13例、Ⅳa期11例、Ⅳb期3例。纳入标准:(1)病理检查诊断为宫颈癌,且病理类型为鳞癌;(2)临床评定无法手术治疗;(3)既往无手术史及放化疗史。排除标准:(1)临床资料不完整;(2)MRI检查等资料缺失;(3)合并其他恶性肿瘤。另选取同院同期无宫颈疾病史、无MRI检查禁忌证的宫颈炎患者32例作为对照组,年龄 41~68(53.53±6.48)岁,BMI 13.50~26.10(21.16±2.97)kg/m2;已婚 25 例,未婚 7例。两组患者年龄、BMI、婚姻情况比较差异均无统计学意义(均P>0.05)。本研究经绍兴第二医院医学伦理委员会批准,患者及其家属均签署知情同意书。
1.2 方法
1.2.1 放疗 选用德国Siemens公司Primus 6MV-X射线仪,采用调强放疗方案,嘱患者排空直肠、充盈膀胱后取仰卧位,依据CT扫面图像勾画肿瘤病灶靶区、临床靶区、计划靶区及受照射所危及的器官。外照射剂量为95%以上的计划靶区照射剂量达47~50 Gy,5次/周,危及器官受照剂量要求:小肠V45<20%、膀胱V45<30%、直肠 V45<40%、双侧股骨头 V30<25%、骨盆V40<40%。腔内照射1次/周,剂量5~10 Gy,总剂量35~45 Gy。
1.2.2 MRI检查 使用德国Siemens公司Magnetom Verio 1.5 T磁共振仪,以髂骨上缘至耻骨联合下缘为扫描区域,对所有研究对象均进行常规MRI、DWI、PWI以及MRI增强扫描。对照组治疗前行MRI检查,放疗组分别在放疗前1周及放疗结束后1个月进行MRI检查。
T1WI采用快速自旋回波(fast spin echo,FSE)序列:重复时间(repetition time,TR)/回波时间(echo time,TE)=700 ms/20 ms,层厚/间距=4 mm/1 mm,矩阵256×256;T2WI采用反转快速自旋回波(fast recovery fast spin echo,FRFSE)序列:TR/TE=3 000 ms/100 ms,层厚/间距=4 mm/1 mm,矩阵256×256;轴位DWI采用平面回波成像(echo planar imaging,EPI)序列:TR/TE=4 025 ms/63.5 ms,层厚/间距=4 mm/0 mm,矩阵 128×96,b值取 0、800 s/mm2。PWI扫描采用快速小角度激发(fast low angle shot,FLASH)序列,以肿瘤最大层面为病灶中心层进行扫描:TR/TE=5.0 ms/1.5 ms,层厚/间距=3.6 mm/1 mm,视野(field of view,FOV)=260 mm,VOXEL SIZE=2.06 mm×4 mm,MATRIX:192×136,信号平均次数(number of excitation,NSA)=1,20层,每层35期扫描,时间间隔为0.58 s,采用高压注射器以3 ml/s静脉团注对比剂二乙三胺五乙酸钆络合物/钆喷酸葡甲胺盐(Gd-DTPA),剂量为0.1 mmol/kg,随后以相同的速率注射0.9%氯化钠注射液15 ml冲洗管道,静脉团注开始后启动扫描。于灌注扫描结束后行常规增强扫描,采用FSE序列T1WI成像,分别行冠状位、矢状位、横断位 T1WI,TR/TE=4.0 ms/1.9 ms,FOV=320 mm,层厚=4 mm,重建厚度=2 mm,MATRIX:320×160。由2位副主任医师独立进行影像分析,若结果不一致,经讨论后统一诊断结果。
将扫描数据导入Mean Curve软件包分析,以肿瘤强化最显著的区域为感兴趣区,生成时间-强度曲线,并计算相关灌注参数值,包括PH、MSI及TTP。
1.3 观察指标 (1)比较两组患者的ADC、PH、MSI、TTP;(2)比较放疗前后宫颈癌患者的ADC、PH、MSI、TTP,记录放疗前后病灶最大横径和最大纵径,计算放疗前后病灶径线变化率,横径变化率=(放疗前横径-放疗后横径)/放疗前横径×100%,纵径变化率=(放疗前纵径-放疗后纵径)/放疗前纵径×100%;(3)根据放疗前后病灶最大径的变化将宫颈癌患者分为放疗有效组(病灶完全消失或病灶最大径缩短≥30%)和放疗无效组(病灶最大径缩短<30%或增大),比较放疗有效组和放疗无效组间病灶最大横径和最大纵径以及ADC、PH、MSI、TTP。
1.4 统计学处理 采取SPSS 22.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;计数资料以频数[例(%)]表示,组间比较采用χ2检验;采用Spearman秩相关分析放疗前后病灶径线变化率与放疗前各项参数的相关性;采用ROC曲线分析ADC、PH、MSI、TTP及4项指标联合检测对宫颈癌患者放疗效果的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 放疗有效组与放疗无效组患者临床资料的比较 放疗有效组41例,放疗无效组16例。两组患者年龄、BMI、婚姻状况等方面比较差异均无统计学意义(均P>0.05);放疗无效组FIGO分期Ⅳ期占比明显高于放疗有效组,差异有统计学意义(P<0.05),见表1。

表1 放疗有效组与放疗无效组患者临床资料的比较
2.2 放疗组和对照组ADC、PH、MSI、TTP的比较 放疗组ADC、TTP较对照组低,PH、MSI较对照组高,差异均有统计学意义(均P<0.05),见表2。

表2 放疗组和对照组ADC、PH、MSI、TTP比较
2.3 放疗前后宫颈癌患者ADC、PH、MSI、TTP的比较 与放疗前比较,放疗后宫颈癌患者ADC、TTP明显升高,PH、MSI明显降低,差异均有统计学意义(均P<0.05),见表3。
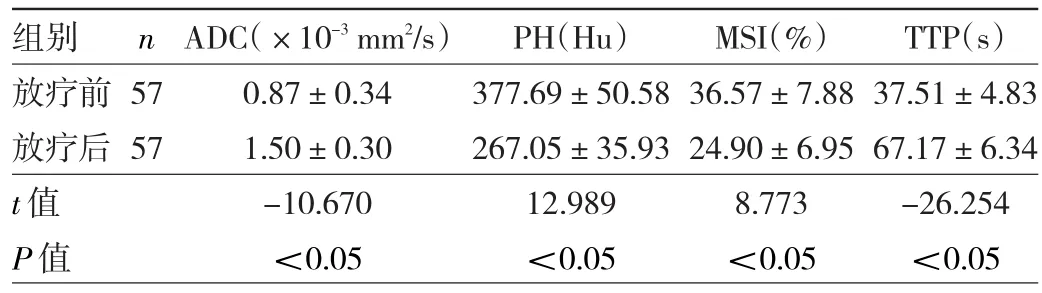
表3 宫颈癌患者放疗前后ADC、PH、MSI、TTP的比较
2.4 放疗有效组与放疗无效组患者治疗前ADC、PH、MSI、TTP以及最大横径、最大纵径的比较 放疗有效组放疗前ADC、PH、MSI均高于放疗无效组,最大横径和最大纵径均小于放疗无效组(均P<0.05),但两组TTP比较差异无统计学意义(P>0.05),见表4。

表4 放疗有效组与放疗无效组患者放疗前ADC、PH、MSI、TTP以及最大横径、最大纵径的比较
2.5 放疗前后病灶径线变化率与DWI、PWI参数的相关性分析 结果显示,最大横径变化率、最大纵径变化率与放疗前MSI均呈负相关(r=-0.623、-0.713,均P<0.05),但与ADC、PH、TTP均无相关性(均P>0.05),见图1、2。
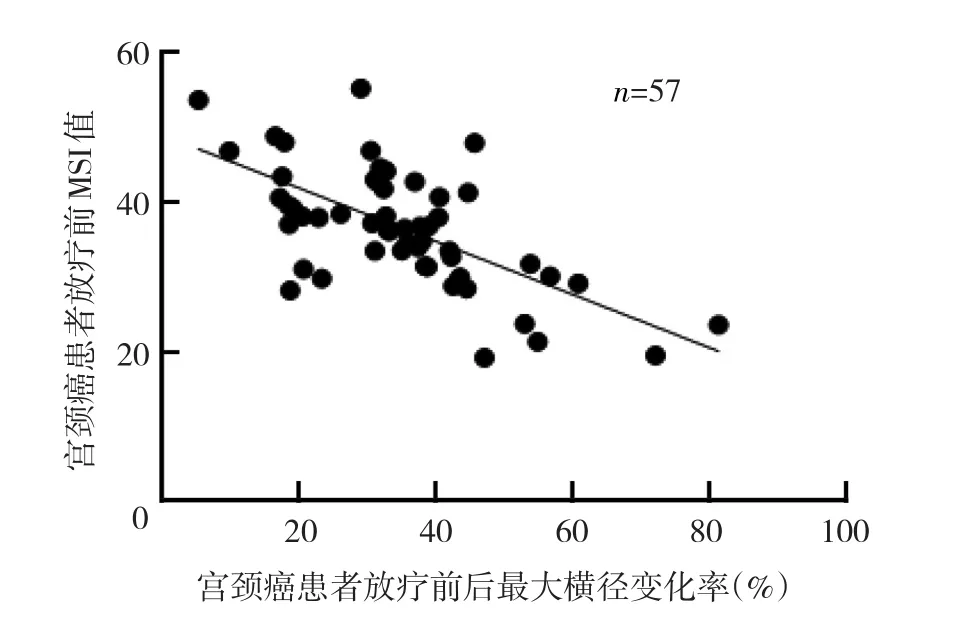
图1 宫颈癌患者放疗前后最大横径变化率与放疗前MSI值关系散点图

图2 宫颈癌患者放疗前后最大纵径变化率与放疗前MSI值关系散点图
2.6 ADC、PH、MSI、TTP及4项指标联合检测对宫颈癌患者放疗效果的预测效能 将宫颈癌患者放疗前ADC、PH、MSI和TTP与放疗效果(放疗有效=1,放疗无效=0)进行ROC曲线分析,其AUC分别为0.780、0.738、0.774、0.639,4项指标联合检测的AUC为0.925,见表5、图3。

表5 ADC、PH、MSI、TTP及4项指标联合检测对宫颈癌患者放疗效果的预测效能分析

图3 ADC、PH、MSI、TTP及4项指标联合检测预测宫颈癌患者放疗效果的ROC曲线
3 讨论
宫颈癌的病因较为复杂,除人乳头瘤病毒感染为其首要病因外,还受性行为、分娩、遗传及生活方式的影响[6]。近年来,宫颈癌的发病率有所上升,患病年龄有年轻化趋向,严重威胁女性生活质量及健康[7]。由于宫颈癌发生早期无典型的临床症状,导致患者就诊时多已处于中晚期,进而影响预后[8]。及时、准确的对放疗效果评估,可最大程度上减少对正常组织的损伤,也可帮助医师及时调整方案,保证疗效,有利于患者预后。MRI检查可清晰地显示软组织结构、显现肿瘤病灶与癌旁组织的位置关系、判断肿瘤的扩散情况及其性质,在宫颈癌的临床诊断中具有重要价值[9]。MRI检查多用来观察肿瘤形态结构的改变,但形态结构的改变常发生于分子水平改变之后[10]。
DWI对水分子的微观运动极其敏感,可通过检测组织中水分子扩散状态间接反映组织微观结构的变化,具有无辐射、重复性强等优点,可用来评估肿瘤患者的疗效、随访情况[11]。ADC为DWI的定量指标,计算ADC用于肿瘤的诊断及其效果评价已成功应用于乳腺癌[12]、脑胶质瘤[13]等疾病。本研究中,放疗组ADC低于对照组;与放疗前比较,放疗后宫颈癌患者ADC升高,但仍低于对照组。宫颈癌患者病灶处肿瘤细胞快速增殖,进而对DWI检查中水分子扩散的阻碍更大,导致ADC减小,放疗可不同程度的杀死肿瘤细胞,病灶处肿瘤细胞数量减少,对水分子扩散的阻碍减小,ADC升高[14]。多项研究表明,在肿瘤治疗成功后ADC会有所增加,反映水分子扩散限制减少和细胞密度的降低,肿瘤形态结构的变化比水分子扩散运动变化慢[15-17],与本研究结果一致。因此,DWI结合ADC可于肿瘤组织形态结构发生改变前从微观角度来评价疗效。PWI以对比剂作为媒介,通过对指定区域的接快速成像,来获得灌注参数,反映肿瘤组织内微血管状况,PH、MSI和TTP是与血管灌注率关系较为密切的指标。因此,观察PWI参数可了解组织内血流动力学改变情况,得到血流灌注信息,从而了解组织的微血管分布及毛细血管通透性。PH反映对比剂流入量,间接反映微血管数量及容积;MSI反映对比剂流入的速度大小,与肿瘤微血管密度有关,密度越高血供越丰富,MSI越大;TTP是指组织强化达到峰值的时间,反映血管阻力,与灌注速率成反比。本研究中,放疗组PH、MSI高于对照组,TTP低于对照组;与放疗前比较,放疗后宫颈癌患者PH、MSI明显降低,TTP升高。宫颈癌患者化疗后肿瘤体积缩小、肿瘤细胞数目降低,内部微血管密度及数量减少,PH、MSI降低;肿瘤组织的坏死纤维化等导致血管阻力增大,血流灌注减少,TTP增大。提示宫颈癌患者放疗前肿瘤细胞增殖迅速,微血管密度及数量较高,放疗后肿瘤细胞坏死继而纤维化,局部血管内皮增厚、管腔闭塞,进一步减少病灶处血流灌注,中断肿瘤细胞的营养供给,加快肿瘤细胞的死亡。ROC曲线分析显示,宫颈癌患者放疗前ADC、PH、MSI、TTP及4项指标联合检测均对放疗效果有较好的预测效能,提示DWI、PWI可用于从微观角度出发,来评估宫颈癌患者放疗效果。
综上所述,DWI可通过测量ADC提供肿瘤评估的相关依据,PWI可通过测量PH、MSI、TTP来判断肿瘤内部微血管变化情况,两者结合可较为全面的评估放疗效果,为临床医师制定及调整治疗方案提供依据。
——辽异1号

