再喂养综合征与急诊重症患者细胞免疫功能以及院内死亡的关系分析
邬媛 刘仲 张茹 高扬 宏欣
再喂养综合征(refeeding syndrome,RFS)是一种与临床营养治疗相关的代谢疾病,系营养不良患者在开始营养治疗后从分解代谢状态转变为合成代谢状态导致,临床表现以电解质耗竭和失衡、体液超负荷(水肿、心动过速和呼吸急促)为主,可导致呼吸、循环、泌尿和神经等多个系统功能障碍[1]。营养不良是导致免疫缺陷的主要原因,营养不良会降低患者免疫功能,抑制T细胞增殖,减弱宿主对感染产生足够的保护性免疫反应并加重营养缺乏程度,增加死亡率[2]。目前,营养不良患者接受营养支持治疗后合并RFS是否影响免疫功能尚不清楚,其对患者院内生存情况的影响报道较为少见,尚无一致性结论。因此,本研究拟探讨RFS与急诊重症患者细胞免疫功能以及院内死亡的关系,以期为临床治疗、预后判断提供参考。
1 对象和方法
1.1 对象 回顾2020年1月至2022年1月西安交通大学第二附属医院收治的营养不良接受营养支持治疗后出现RFS的患者122例(RFS组),男69例,女53例,平均年龄(55.00±6.13)岁。纳入标准:(1)入院ICU时间>5 d;(2)年龄18周岁以上;(3)营养风险筛查(nutritional risk screening,NRS)2002评分≥3分;(4)符合RFS诊断标准[3];(5)临床基线资料、细胞免疫以及电解质相关实验室检查结果完整。排除标准:(1)脑死亡、甲状腺疾病、恶性肿瘤患者;(2)入院时已接受营养支持、肾脏替代治疗患者;(3)濒死状态;(4)入院前高磷血症患者;(5)神经性厌食症患者;(6)患有胃肠道疾病,对营养支持治疗禁忌者。RFS诊断标准[3]:无或极少营养摄入≥5 d;喂养后72 h内磷酸盐(PO43-)较基线下降>30%或<0.6 mmol/L或任何两种电解质变化低于正常值[镁离子(Mg2+)<0.75 mmol/L,PO43-<0.80 mmol/L,钾离子(K+)<3.5 mmol/L];排除其他因素引起的RFS。另选择同期EICU收治的营养不良接受营养支持治疗后未出现RFS患者131例作为对照组,男75例,女56例,平均年龄(54.96±6.72)岁。两组患者性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经本院医学伦理委员会批准。
1.2 方法
1.2.1 实验室指标检测 收集患者入院时(基线)T淋巴细胞亚群(CD3+T细胞、CD4+T细胞、CD8+T细胞)、NK细胞(CD3-CD56+NK细胞)及其亚群[CD56brightNK细胞(CD3-CD56+CD16+)、CD56dimNK细胞(CD3-CD56-CD16-)]、基线以及营养支持第 3 天时血清 PO43-、K+、Mg2+、白蛋白水平。T淋巴细胞、NK细胞采用FACS Calibur型流式细胞仪(美国BD公司)检测,抗体CD3-PE/CD4-FITC、CD3-PE/CD8-FITC、CD3-PE/CD56-FITC/CD16-APC均购自北京四正柏生物科技有限公司。PO43-、K+、Mg2+、白蛋白采用AU5800全自动生化分析仪(美国贝克曼库尔特公司)检测。
1.2.2 临床资料 收集患者性别、年龄、入院诊断、基线和营养支持第3天BMI、NRS 2002评分、营养支持方式、RFS风险分层、每日热量摄入、每日蛋白质摄入、RFS诊断前是否补磷及补维生素B1治疗,基线以及营养支持后第3天血清PO43-、K+、Mg2+、白蛋白水平、急性生理学及慢性健康状况评分(acute physiology and chronic health evaluationⅡ,APACHEⅡ)[4]、序贯器官衰竭评分(sequential organ failure assessment,SOFA)[5]、并发症(心律失常、急性肾损伤、心力衰竭、呼吸衰竭)以及院内存活情况。RFS风险分层参考美国肠外和肠内营养学会标准[6]:血清PO43-、K+和(或)Mg2+任何水平下降10%~20%为轻度,下降20%~30%为中度,下降>30%和(或)由于PO43-、K+、Mg2+或硫胺素缺乏引起的器官功能障碍为重度。根据院内存活情况将患者分为死亡组和存活组。
1.3 统计学处理 采用SPSS 25.00统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验。非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验。计数资料以率表示,组间比较采用χ2检验。绘制Kaplan-Meier生存曲线,采用log-rank检验比较不同分组患者院内存活率的差异。采用Cox风险比例回归模型分析造成急诊重症患者院内死亡的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 RFS组和对照组患者基本资料的比较 两组患者入院诊断、营养支持方式、每日热量摄入和每日蛋白摄入量比较差异均无统计学意义(均P>0.05)。RFS 组基线和营养支持第 3天BMI、PO43-、Mg2+、K+、白蛋白水平均低于对照组(均P<0.05),NRS 2002评分、APACHEⅡ评分、SOFA评分均高于对照组(均P<0.05);RFS组补磷、补维生素B1占比均低于对照组(均P<0.05),心律失常、心力衰竭、急性肾损伤、呼吸衰竭发生率均高于对照组(均P<0.05),见表1。

表1 RFS组和对照组患者基本资料的比较
2.2 两组患者细胞免疫指标比较 RFS组CD3+T细胞、CD4+T细胞、CD4+/CD8+、CD3-CD56+NK 细胞、CD56brightNK细胞、CD56dimNK细胞占比低于对照组(均P<0.01),两组CD8+T细胞比较差异无统计学意义(P>0.05),见表2。

表2 两组患者细胞免疫指标的比较
2.3 两组患者生存情况的比较 253例患者中院内死亡80例,RFS组院内死亡61例,存活61例,存活率为50.00%;对照组院内死亡19例,存活112例,存活率为85.50%,RFS组院内存活率低于对照组(log-rankχ2值=36.500,P<0.01),见图1。

图1 RFS组、对照组院内生存曲线
2.4 造成急诊重症患者院内死亡的危险因素分析253例患者中死亡80例,存活173例。死亡组基线PO43-水平、营养支持第 3天PO43-、Mg2+、K+水平、CD4+T细胞、CD4+/CD8+、CD3-CD56+NK细胞占比以及补磷、补维生素B1占比均低于存活组(均P<0.05),RFS、RFS重度占比、APACHEⅡ评分、SOFA评分以及并发急性肾损伤、并发心力衰竭发生率均高于存活组(均P<0.01),见表3。以急诊重症患者院内存活情况为因变量(赋值:0=存活,1=死亡),基线PO43-、营养支持第3天PO43-、Mg2+、K+、CD4+T细胞、CD4+/CD8+、CD3-CD56+NK细胞、补磷(赋值:0=否,1=是)、补维生素B1(赋值:0=否,1=是)、RFS(赋值:0=否,1=是)、RFS风险分层(赋值:0=轻度、中度,1=重度)、APACHE Ⅱ评分、SOFA评分、并发急性肾损伤(赋值:0=否,1=是)、并发心力衰竭(赋值:0=否,1=是)为自变量,向后逐步法排除无关变量(α入=0.05,α出=0.10),结果发现RFS、并发心力衰竭是急诊重症患者院内死亡的危险因素(均P<0.01),营养支持第3天血PO43-水平、补磷是保护因素(均P<0.01),见表4。
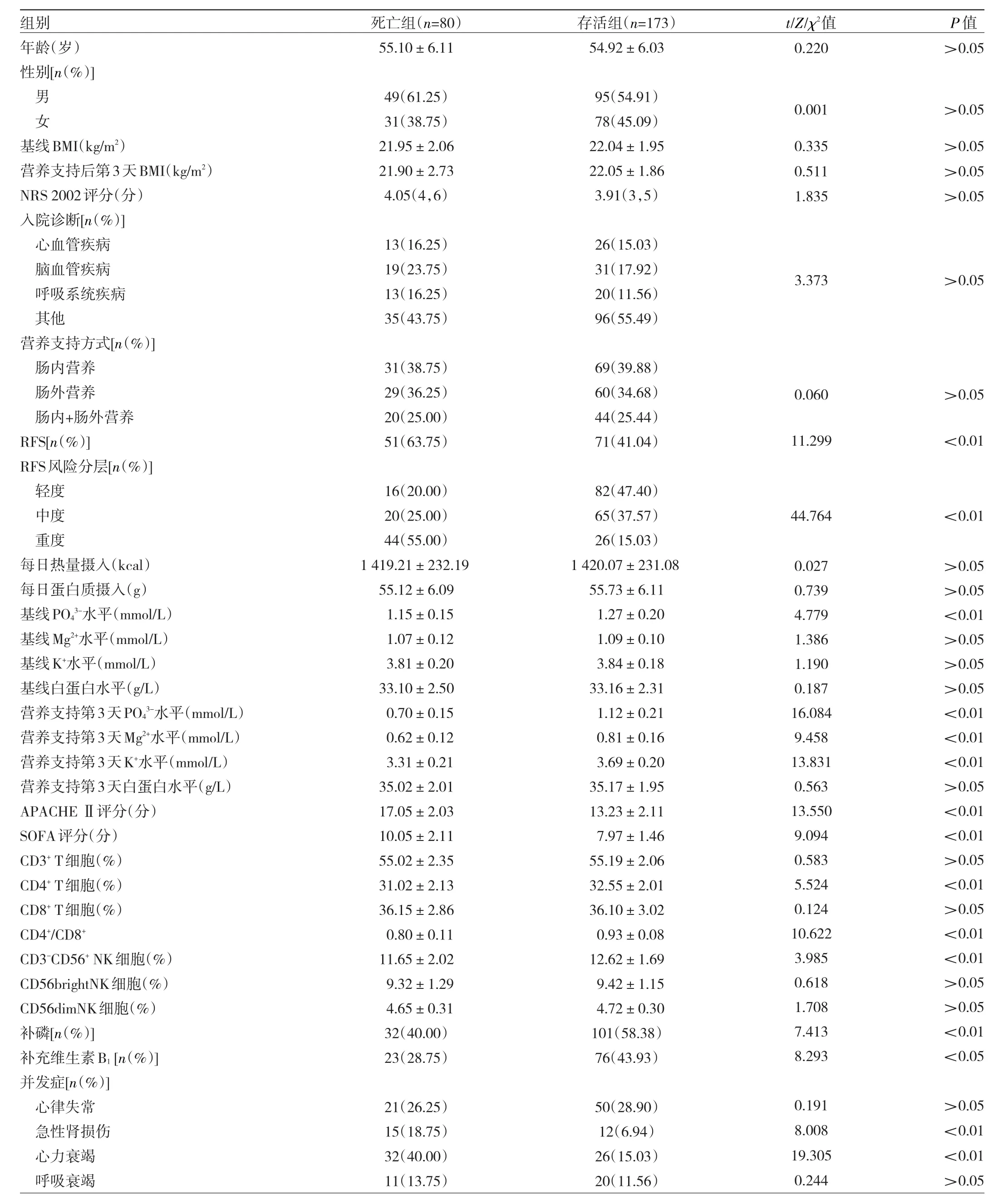
表3 影响急诊重症患者院内死亡的单因素分析结果

表4 影响急诊重症患者院内死亡的Cox风险比例回归模型分析
3 讨论
RFS是营养不良患者接受营养支持治疗后机体从饥饿状态转变为进食状态的代谢反应,其特点是血糖升高、电解质紊乱(特别是低磷血症、低钾血症和低镁血症)、维生素耗竭(尤其是维生素B1、硫胺素)、体液失衡和钠潴留,从而导致心律失常和多器官功能受损[3]。RFS症状通常在营养支持后2~5 d内出现,轻重不一,症状严重程度取决于先前存在的营养不良程度[7]。本研究中RFS患者基线BMI、基线白蛋白水平均低于对照组,NRS 2002评分高于对照组,表明RFS的发生与基线营养状态有关,营养不良程度越重可能在再喂养后出现RFS的风险越大。龙兴霞等[8]分析了ICU肠内营养患者发生RFS的因素,其中NRS 2002评分增高、白蛋白水平<30 g/L是引起RFS的危险因素之一。
本研究发现RFS患者基线PO43-、Mg2+、K+水平均低于对照组,表明在RFS发生之前已经存在电解质消耗现象,检测基线血清PO43-、Mg2+、K+水平有望预测RFS的发生和病情严重程度。Friedli等[9]报道也指出入院时PO43-、Mg2+、K+水平降低与开始营养支持后RFS风险增加有关。分析原因为在饥饿状态下或长时间禁食时,细胞内矿物质(PO43-、Mg2+、K+)消耗,引起血清中矿物质浓度下降,而在提供营养后,尤其是碳水化合物会增加胰岛素分泌,刺激钠钾ATP酶转运,将葡萄糖和钾转运到细胞中并排出钠,促进细胞摄取PO43-和镁,加剧细胞外 PO43-、Mg2+、K+水平降低[10]。临床对于营养不良患者,在开始营养治疗前应进行RFS风险以及分层评估,对于基线PO43-、Mg2+、K+水平偏低患者应注意补充电解质,维持电解质平衡,以预防营养支持治疗期间RFS的发生。
营养是保持免疫功能正常的关键,营养物质-脂质、氨基酸和葡萄糖衍生的丙酮酸氧化磷酸化为ATP,为免疫细胞代谢提供能量来源,免疫细胞代谢异常影响免疫细胞增殖和分化,营养不良无法满足免疫细胞快速增殖分化、产生细胞因子,调节功能性免疫反应的需求,导致免疫细胞数量减少[11]。目前鲜有报道RFS对免疫功能的影响,本研究发现RFS患者CD3+T细胞、CD4+T细胞、CD4+/CD8+、CD3-CD56+NK细胞、CD56brightNK细胞、CD56dimNK细胞均低于对照组,表明RFS可加重T淋巴细胞和NK细胞免疫功能障碍,可见在营养支持治疗后出现RFS可能不会改善患者免疫抑制状态,反而加重免疫功能损伤。分析原因为PO43-属于人体必需的营养素,是ATP合成、信号转导过程中必需的元素之一[12],PO43-消耗则导致细胞ATP合成受限,进而影响免疫细胞代谢和功能。Mg2+作为ATP磷酸化的辅助因子,其耗竭也影响能量的合成,另Mg2+可调节NK和T细胞的细胞毒功能,Mg2+水平降低会导致NK和T细胞中程序性细胞死亡蛋白1的表达缺陷,降低其细胞毒活性,导致免疫功能障碍[13]。K+可调节T细胞代谢,将代谢状态从消耗细胞外能量转为自噬和线粒体驱动的能量生产,在T细胞激活以及正常功能维持中发挥重要作用[14],K+减少可能影响T细胞功能,导致免疫功能障碍。
本研究Kaplan-Meier生存曲线分析发现RFS患者院内存活率低于对照组,陈曦等[15]研究结果显示老年急危重症患者合并RFS病死率为52.3%,明显高于无RFS患者的15.0%。进一步回归分析结果显示RFS是导致院内死亡的主要危险因素之一,表明合并RFS患者存活率较低,可能与PO43-、K+、Mg2+严重消耗引起的器官功能障碍有关。心力衰竭是RFS常见的严重并发症,其发生与PO43-失衡有关,PO43-水平降低可引起室性心律失常和心肌功能障碍,引起心脏收缩力降低和心力衰竭[16],影响患者临床结局。营养支持后第3天血PO43-水平、补磷是急诊重症患者院内死亡的保护因素,表明维持血PO43-正常水平对降低急诊重症患者院内病死率有积极的意义。推测原因为PO43-是一种细胞内矿物质,参与细胞代谢酶促过程,在能量产生和转移中起关键作用,PO43-消耗增加导致ATP和2,3-二磷酸甘油酸的产生减少,引起心脏和呼吸功能受损,进而增加不良结局的发生风险。陈曦等[15]报道结果也显示低磷血症患者病死率高于未出现低磷血症患者(37.8%比19.1%)。
综上所述,急诊重症RFS患者确诊前存在一定程度的PO43-、K+、Mg2+消耗,合并RFS患者存在基线营养状态较差和细胞免疫功能障碍。RFS患者院内存活率较未发生RFS患者低,RFS、并发心力衰竭是急诊重症患者院内死亡的危险因素,营养支持后第3天血PO43-水平、补磷是保护因素,积极补充PO43-、K+、Mg2+,尤其是PO43-,维持电解质平衡对改善急诊重症患者临床结局有重要意义。

