基于网络药理学和分子对接方法探讨络石藤治疗类风湿关节炎的作用机制
李成蹊,关智宇,蒋太平,刘志伦,刘昭明
(1.贵州中医药大学,贵州 贵阳 550000;2.贵州中医药大学第一附属医院骨科,贵州 贵阳 550001)
现代医学认为,类风湿关节炎(rheumatoid arthritis,RA)是一种以侵袭性关节滑膜炎为主要症状的自身免疫系统疾病,其具体病因未明[1]。特征为身体多关节的对称性、侵蚀性炎症,临床表现有关节晨僵、肿胀、疼痛及功能障碍等症状(最常见于手、足小关节),实验室检查可见血清类风湿因子阳性。如未得到恰当治疗,可能造成患者永久性骨质破坏并最终出现残疾,甚至累及脏器和神经系统而危及生命[2]。目前临床常见的治疗RA药物的主要局限性在于单一的靶向作用,这使得它们虽然可在短期内改善患者的临床症状,但长期的治疗效果往往欠佳,且存在的不良反应和较大的经济负担使得很多患者不能维持用药。故而探寻并利用长效、低毒、价廉的中草药对RA患者进行治疗,一直是近些年来临床研究的一个热点。
RA属中医“痹症”“尪痹”范畴。中医理论认为痹症是由于体虚之人受到风、寒、湿、热等邪气侵袭,进而使经络闭阻,气血运行不畅,所谓“不通则痛”“不荣则痛”,最终导致肢体肌肉废用,关节红肿热痛、变形等症状的一种疾病。在长期的临床实践过程中,我国古代医家对此病有了较为系统的认知,在许多中医典籍中都有对类似病症的总结。《黄帝内经》最早提出了风、寒、湿三种外邪相合而致痹症,《素问·痹论》[3]曰:“风寒湿三气杂至合而为痹也”;对风湿的认知发展至宋代,有《太平圣惠方》云:“风湿腰痛,连腿膝,顽痹不能运动”,《太平惠民和剂局方》[4]又载:“体虚,风邪入血,肌肤顽痹”,都强调了体虚是痹病之根本原因,此后风湿之邪从外侵犯而成痹证。从古至今中医对RA的治法也以祛风胜湿,通络止痛为主。《中国药典》[5]记载络石藤为夹竹桃科植物络石[Trachelospermumjasminoides(Lindl.)Lem.]的干燥带叶藤茎。味苦,性微寒。归心、肝、肾经。有祛风通络,凉血消肿的功效。中医常将其用于风湿痹症、腰痹筋挛、红肿热痛、跌扑损伤等治疗。《本草纲目》[6]有载:“络石,气味平和,其功主筋骨关节风热痈肿”。通过长期的临床实践,人们发现在古今众多经方运用过程中,络石藤往往可有效延缓各种关节炎症的发展,改善患者临床症状。但由于中草药的成分混杂、机制不明等原因,其类似“黑箱理论”的运作形式在多种临床疾病治疗过程中的作用依然受到质疑。本文旨在运用现代化的网络药理学和分子对接方法,分析络石藤所含的主要活性物质基础及其可能的作用机制,为明确络石藤对于RA的治疗效果提供数据支持与理论依据。
1 材料与方法
1.1 主要软件与数据库 Cytoscape 3.8.0、R语言、perl document、ChemBio3D Ultra、PyMOL、AutoDockTools、Vina、中药系统药理学数据库与分析平台(TCMSP)、GeneCards基因数据库、在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)、PubChem数据库、Uniprot蛋白质数据库、STRING蛋白互作关系数据库、PubChem有机小分子生物活性数据库、RCSB蛋白质数据库(PDB)。
1.2 络石藤活性成分及作用靶点的筛选 在TCMSP中,以“络石藤”为检索词,获取络石藤已知的药物成分,将口服生物利用度大于等于30%(OB≥30%),化合物类药性大于等于0.18(DL≥0.18)设定为筛选标准,得到络石藤所含化合物中活性度较高的成分,之后利用数据库进一步搜索这些成分所作用的靶点基因,再将药物所有的作用靶点导入UniProt数据库进行比对、去重后,获得络石藤可作用的靶点基因名称。
1.3 类风湿关节炎靶点的筛选 在GeneCards、OMIM两种数据库中同时检索关键词“rheumatoid arthritis”,将检索物种设定为“homo sapiens(人类)”,得到较为全面的RA疾病人源靶点基因。
1.4 “药物-活性成分-靶点-疾病”网络的构建 得到络石藤活性成分作用靶点与RA潜在靶点基因后,运行perl document程序获取“药物-疾病”交集靶点,再利用R语言将交集靶点输出为Venn图,运用Cytoscape 3.8.0软件将络石藤及其活性成分、RA及其靶点基因之间的作用关系进行可视化分析。
1.5 靶蛋白互作网络(PPI)的构建 检索STRING数据库,导入“药物-疾病”交集靶点,生成蛋白互作网络(PPI)后,将网络图保存为TSV格式的数据文件后导入到Cytoscape 3.8.0中进行筛选,得到络石藤活性成分作用的核心靶点基因。
1.6 分子对接 首先使用PubChem数据库搜索核心靶点对应的活性成分,导入ChemBio3D Ultra软件绘制活性成分的3D结构,得到小分子配体文件。之后从RCSB蛋白质数据库(PDB)下载核心靶点的三维结构,用PyMOL软件删除配体并除水,得到蛋白受体文件。将二者导入AutoDockTools进行加氢修饰,设定搜索范围和评分参数,形成活性口袋。最后利用Vina软件进行分子对接。
1.7 GO富集分析与KEGG通路富集分析 下载Bioconductor程序包并利用R语言运行,对之前获取的“药物-疾病”交集靶点进行GO富集分析和KEGG通路分析,将阈值设定为P<0.05以提高分析准确性,将分析结果按照涉及的靶点数目从高到低进行排列,选取GO富集分析中生物过程(BP)、细胞组成(CC)和分子功能(MF)的前10 个条目及KEGG通路富集的前20 个信号通路,进一步探讨络石藤治疗RA的生物学过程及其作用的信号通路。
2 结果
2.1 络石藤活性成分及作用靶点 通过TCMSP数据库共检索出络石藤25 个已知化学成分,再将OB≥30%和DL≥0.18设置为筛选条件,最终得到9 个活性度较高的化合物,可推测为络石藤活性成分(见表1)。将活性成分导入TCMSP数据库,获取每个活性成分所作用的靶点基因,为避免不同活性成分存在重复的作用靶点,故将全部靶点基因利用UniProt数据库进行比对、去重,获得90 个络石藤治疗RA的潜在靶基因名称。
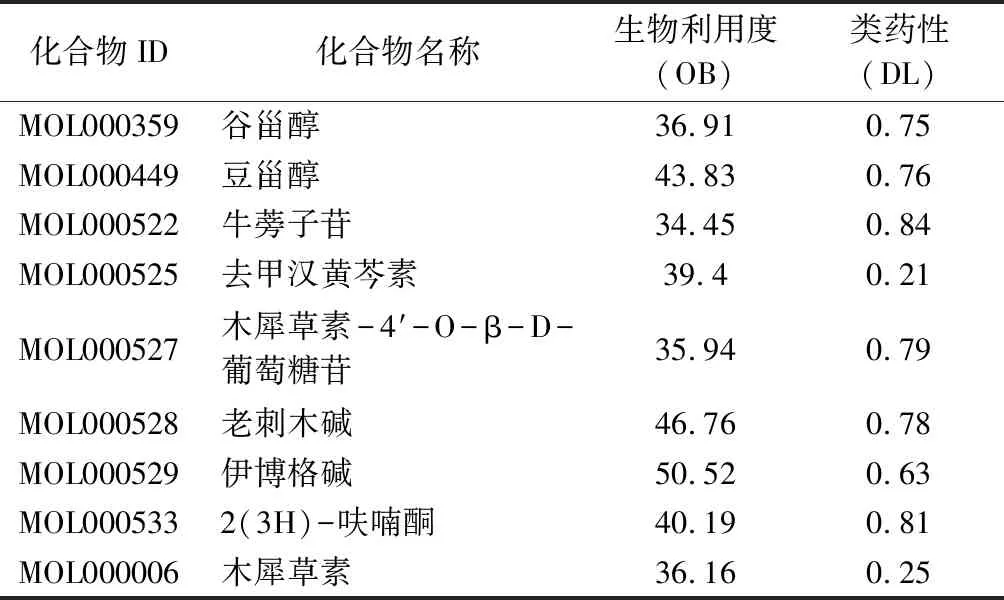
表1 络石藤活性成分
2.2 类风湿关节炎靶点的筛选 在GeneCards数据库、OMIM数据库中检索关键词“rheumatoid arthritis”,物种设定为“homo sapiens”,得到RA的人源靶点基因4 427 个,结合络石藤治疗RA的潜在靶点,运行perl document取“药物-疾病”交集靶点,利用R语言输出为Venn图,发现67 个络石藤作用靶点与类风湿关节炎重合的靶点基因。
2.3 “药物-活性成分-靶点-疾病”网络构建 将药物活性成分和疾病交集靶点导入Cystoscope 3.8.0软件,得到“药物-活性成分-靶点-疾病”网络图(见图1)。网络图中共包含158 个节点,其中六边形代表药物,矩形代表药物活性成分,椭圆形代表靶点,菱形代表疾病,连接线表示两个元素之间存在相互关系。根据网络中络石藤活性成分与疾病靶点连接度的多少筛选出排名前四的有效活性分子,分别为木犀草素、伊博格碱、谷甾醇、豆甾醇,各有8 个以上的靶点基因与这些成分发生作用,推测是络石藤在RA治疗中起主要作用的活性成分,体现了中药多靶点的特性。
2.4 靶蛋白互作网络(PPI)的构建 检索STRING数据库,将范围设为“Multiple proteins”,物种设为“Homo sapiens”,导入“药物-疾病”交集靶点,初步生成蛋白互作网络(PPI)后,调整“minimum required interaction score”为0.9并隐藏游离靶点,其余参数为默认值,绘制更明晰的蛋白互作关系(见图2),节点之间连线越粗代表互作关系越密切。将互作网络保存为TSV格式的数据文件,导入到Cytoscape 3.8.0中对靶蛋白作用程度进行打分,筛选两次后得到6 个蛋白互作网络核心基因(见图3),分别为RB1、MAPK1、AKT1、JUN、IL-6、RELA,确定为络石藤活性成分作用的核心靶点。

图1 “药物-活性成分-靶点-疾病”网络

图2 蛋白互作网络(PPI)

图3 蛋白互作网络核心基因筛选
2.5 分子对接 将筛选出的6 个核心靶点与络石藤活性成分进行分子对接验证,其结果见表2,可见木犀草素是与6 个核心靶点对接的活性成分,运用PyMOL软件输出对接模式图(见图4)。分子对接的结合能(affinity)越小,表示配体与受体结合的越牢固。对接结果显示,络石藤活性成分与RA核心靶点的结合能介于-7.7 kcal·mol-1与-9.8 kcal·mol-1之间(低于-5.0 kcal·mol-1),表明活性成分与核心靶点具有较好的结合活性,预测结果比较可靠。

表2 活性成分与核心靶点对接结果

图4 络石藤活性成分与RA核心靶点对接模式
2.6 GO富集分析与KEGG通路富集分析 将筛选出的67 个“药物-疾病”交集靶点进行GO富集分析与KEGG通路富集分析,制作富集图形。本次GO富集分析共显示1 888个生物过程(BP)、84 个细胞组成(CC)、91 个分子功能(MF),各取其中前10 个条目进行可视化分析(见图5)。交集靶点基因在BP富集过程中主要表现在对生物碱的反应(response to alkaloid)、肌肉细胞增殖(muscle cell proliferation)、细胞对化学应激的反应(cellular response to chemical stress)、调节平滑肌细胞增殖(regulation of smooth muscle cell proliferation)、对金属离子的反应(response to metal ion)、腺体发育(gland development)、对氧化应激的反应(response to oxidative stress)、对类固醇激素的反应(response to steroid hormone)、对活性氧的反应(response to reactive oxygen species)等生物过程;在CC富集过程中主要表现为突触后膜(postsynaptic membrane)、突触膜(synaptic membrane)、突触前膜(presynaptic membrane)、细胞膜筏(membrane raft)、细胞膜微区(membrane microdomain)、细胞膜区(membrane region)等细胞组成;在MF富集过程中主要表现在儿茶酚胺结合(catecholamine binding)、G蛋白偶联的胺受体活性(G protein-coupled amine receptor activity)、药物结合(drug binding)、神经递质受体活性(neurotransmitter receptor activity)、肽结合(peptide binding)等分子功能。

图5 络石藤治疗RA的GO富集分析
本次KEGG通路富集分析显示了125 条通路,取前20 个条目进行可视化分析(见图6)。交集靶点主要富集于PI3K-Akt信号通路、多种癌症相关通路、人巨细胞病毒感染、乙型肝炎、HIF-1信号通路、IL-17 信号通路、TNF信号通路等,多为癌症、感染、炎症和免疫相关通路。

图6 络石藤治疗RA的KEGG通路富集分析
3 讨论
经过TCMSP数据库筛选后,本次研究共得到络石藤中9 个药动学特征良好的化合物作为潜在活性成分,通过“药物-活性成分-靶点-疾病”网络图反映出其中木犀草素、伊博格碱、谷甾醇、豆甾醇4个成分可能为发挥RA治疗作用的关键成分。木犀草素是一种天然黄酮类化合物,具有抗肿瘤、抗炎、抗病毒、抗氧化、免疫调节等药理作用。Aziz等[7]通过体内及体外实验证实了木犀草素具有较好的抗炎作用,其主要通过NF-κB、MAPK通路发挥作用。徐强等[8]认为木犀草素可以通过下调基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达,防止软骨降解,促进新合成的细胞外基质(extracellular matrix,ECM)的积累,并抑制滑膜成纤维细胞增殖,最终缓解关节部位的炎症反应。部分关于急性痛风性关节炎模型大鼠的实验也证实了木犀草素缓解试验模型足踝关节肿胀的作用,是通过下调IL-1β、IL-6、IL-17、TNF-α等的水平达到的[9]。谷甾醇是植物甾醇的重要组成成分,其作用于多种慢性疾病,具有抗炎、抗氧化及抗肿瘤等作用[10]。Liao等[11]发现β-谷甾醇可以通过抑制表皮细胞、巨噬细胞中炎症小体NLRP3的激活,来抑制CAS1的产生及MAPK信号通路的活化,从而显著减少细胞中的TNF-α、IL-1β、IL-6、IL-8生成以起到抗炎作用。曾莉萍等[12]发现β-谷甾醇可使成骨细胞护骨素与破骨细胞分化因子的比值增高,发挥雌激素样作用,促进卵巢颗粒细胞分泌雌二醇,从而与骨膜上的雌激素受体结合,促进成骨作用以及抑制破骨作用来调节女性骨代谢的平衡。关于豆甾醇及伊博格碱的相关文献报道较少,豆甾醇的作用主要涉及抗癌方面,而伊博格碱主要用于阻断某些药物或毒品的依赖性,本文不做详细讨论。故推测木犀草素和谷甾醇为络石藤抗RA的关键活性成分。
而分子对接的结果也表明,在通过PPI网络筛选出的核心靶点基因RB1、MAPK1、AKT1、JUN、IL-6、RELA中,络石藤活性成分木犀草素与核心靶点具有较好的结合活性,进一步证实了络石藤药物成分可以与受体稳定结合并发挥治疗RA的作用,为络石藤作用于核心靶点以干预RA病情提供了更多数据支持。
在筛选出的核心靶点基因中,又以MAPK1、AKT1、JUN三个基因的自由度最高。MAPK(基质金属蛋白酶)信号通路是经典的炎性反应通路,有研究表明,对胶原诱导的关节炎大鼠给予MAPK信号转导通路抑制剂后,与未给信号通路抑制剂的对照组相比,给药组在抑制滑膜炎症、骨质破坏和关节软骨破坏的方面有显著效果[1]。说明该信号通路对炎症、增生和骨破坏这三大RA病理过程均起到重要的调节作用。AKT1可通过磷酸化其下游底物来促进细胞生长、代谢、凋亡等重要的细胞生物学过程[13]。JUN(转录因子AP-1)主要由C-Fos家族和C-jun家族结合形成的二聚体构成,JUN位于多条信号通路的下游,主要调控炎性因子(TNF-α、IL-1β、IL-1、IL-6、IL-17等)和金属蛋白酶(MMPs)等的释放,参与细胞增殖、分化、凋亡,影响机体的免疫和炎性反应[2]。
GO富集分析结果表明,络石藤对RA的治疗过程包括了金属离子、蛋白质等多种物质的参与,涉及细胞器、细胞膜细胞,可影响肌肉细胞增殖、药物结合、神经递质受体活性、肽结合,对各种有机环状化合物反应、对生物碱反应、对非生物刺激反应、对类固醇激素反应和对含氧化合物等反应的一个复杂的过程。KEGG通路富集分析可归纳靶基因作用于疾病时所途径的信号通路,便于更加清稀、明确地总结药物发挥治疗作用的过程。IL-17在RA患者病理活检中均可检测到,且研究表明IL-17是通过PI3K-Akt途径刺激RA-FLS分泌IL-6、IL-8及血管内皮细胞生长因子受体(VEGFR)[14-15]。而更多研究还发现,PI3K-Akt可以通过影响FLS的增殖与凋亡干预RA滑膜炎症,进行对TNF-α诱导B淋巴细胞诱导成熟蛋白1(Blimp 1)表达的调控干预RA骨破坏 ,其参与了RA进展的全部过程[16]。有研究表明[2],RA成纤维样细胞异常增生,并展现出了类癌细胞特点,RA纤维样滑膜细胞异常增生可能与癌症相关通路有关联,络石藤对多种癌症相关通路的调控也可能对RA发挥治疗作用。
综上所述,本研究利用网络药理学与分子对接方法,搜集到络石藤9种活性成分及可能作用的90 个潜在靶点,4 427个RA疾病的相关靶点,其中包括“药物-疾病”交集靶点67个,构建关于这些靶点基因的蛋白互作网络(PPI),发现络石藤可能是通过作用于RB1、MAPK1、AKT1、JUN、IL-6、RELA等靶点发挥对RA的治疗作用,分子对接显示,其中发挥主要治疗作用的活性成分为木犀草素。通过对核心靶进行GO富集分析和KEGG通路富集分析,络石藤可能通过调控PI3K-Akt信号通路、癌症相关通路、细胞凋亡通路、IL-17信号通路等通路,发挥抑制炎症反应、调节免疫功能及调控细胞凋亡等作用来治疗类风湿关节炎。这些结果通过数据证明了络石藤治疗RA的有效性,体现了中草药治疗特定疾病可以发挥多种要素协同作用的特点,也说明网络药理学和分子对接方法运用于中医药研究的科学性和有效性。同时,本研究尚存在需要改进之处,如检索的数据库种类较少,所获取的信息可能不完全,获取的小分子配体及核心靶点数量有限,无法更加全面地揭示中草药的药理作用;作者查阅、引用的文献及凭借网络数据构建的框架、列表、绘图中存在对当前研究热点的倾向性,可能一定程度上影响到本次研究的结果,故得出的结论仍需进一步以实验为基础加以验证,以更加准确地揭示中药络石藤治疗RA的具体作用机制。

