DNA加合物组的预处理及检测方法研究进展
李昕冉,孙铜,郭娜,张峻颖,吴春勇*
(1.中国药科大学药物质量与安全预警教育部重点实验室,江苏 南京 210009;2.中国药科大学药物分析教研室,江苏 南京 211198;3.山东省食品药品检验研究院,山东 济南 250101;4.济南市食品药品检验检测中心,山东 济南 250102;5.中国药科大学中药制剂教研室,江苏 南京 211198)
近年来,缬沙坦、雷尼替丁和二甲双胍等已上市药物中意外发现遗传毒性杂质引发了人们的极大关注。研究发现,遗传毒性物质广泛存在于环境中,譬如汽车尾气、香烟、烧烤中的4-氨基联苯[1]、苯并[α]芘[2]等多种多环芳烃、真菌产生的黄曲霉素B1[3]、染料中2-萘胺[1]、马兜铃酸[4]和他莫昔芬[5]等。除了外源性暴露,内源性因素如脂质过氧化产生的低分子量醛类也能造成遗传毒性[6]。
DNA加合物是导致遗传毒性的重要原因之一。所谓DNA加合物,是指暴露于外源或内源的亲电性物质或经代谢激活后具有亲电性的物质与DNA亲核位点共价结合形成的化合物。若不能及时修复损伤,修饰核苷酸可能会妨碍正常的未修饰核苷酸配对,从而导致碱基的错配、置换[7];大体积的修饰物或DNA链内交联可能使DNA链扭曲甚至断裂[8],干扰DNA复制和RNA转录[9]。H-ras原癌基因、p53抑癌基因等重要基因的突变以及突变蛋白引起的表型改变在肿瘤的发展过程中具有重要作用[6,9]。因此,DNA加合物被认为是癌症的早期生物标志物以及必要不充分条件[10-11]。
1 DNA加合物的形成
许多致癌物都需要代谢激活才能DNA反应形成DNA加合物,譬如苯并[α]芘(B[α]P)[12]、2-萘胺(2-NA)[21]、3-硝基苯并蒽酮(3-NBA)[13]、2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉(MeIQx)[14]、2-氨基-3甲基咪唑并[4,5-f]喹啉(IQ)[15]等多环芳烃或芳香胺、N-亚硝基二甲胺(NDMA)和N-亚硝基二乙胺(NDEA)等亚硝胺类物质[16]、二氯甲烷和二氯乙烷等烷基卤化物[17-18]、马兜铃酸[19]等。Ⅰ 相和Ⅱ相代谢酶在遗传毒性物质代谢中的作用是复杂的,体内P450酶的解毒与代谢激活作用并存,代谢平衡影响其遗传毒性[20]。
相比DNA中其他位点[21-23],碱基加合物的发生频率更高[24]。修饰物最常加合在碱基的氮氧原子、嘌呤的C8原子以及嘧啶的C5和C6上[10](见图1)。由于亲核性最高,鸟嘌呤的N7(如黄曲霉素B1的加合物AFB1-N7-Gua)和腺嘌呤的N3是最易被攻击的位点,且位于DNA双螺旋大沟中的鸟嘌呤N7比位于小沟的腺嘌呤N3位点更容易形成加合物。多环芳烃、芳香胺等遗传毒性物质更多加合在嘌呤的C8位[8](如4-氨基联苯的加合物dG-C8-4-ABP)。乙醛[25]、巴豆醛[26]等醛类物质还可以与鸟嘌呤的N1和环外氮成环(如形成加合物1,N2-propano-dG)。氮芥(nitrogen mustard)形成单加合物后又形成了新的亲电中间体(G-NM-G),可以与蛋白质亲核侧链反应产生DNA-蛋白质交联[27]或攻击另一个碱基形成DNA链内或链间交联[28-29]。
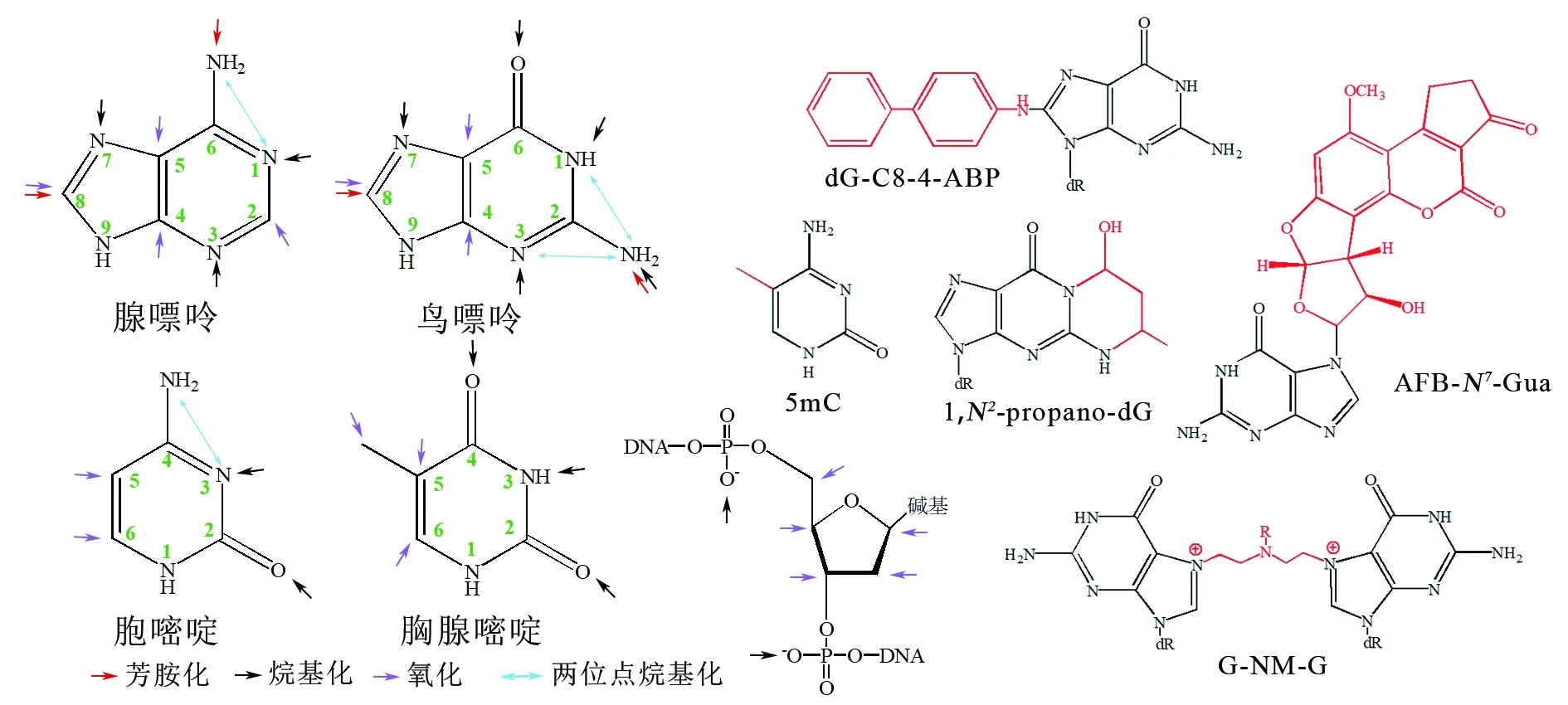
图1 常见的DNA反应位点及DNA加合物[5,10,15,25]
2 DNA加合物的分析方法
DNA加合物的发生频率很低,106~109个核苷中才会产生一个加合物[30],因此加合物分析极具挑战性。32P-后标记法曾经是最常使用的检测方法[31],1~10 μg DNA可以检测到1个加合物/1010个碱基[32]。但32P-后标记操作烦琐,不同加合物的酶解和32P标记效率不同,重现性较差,放射性元素的使用也大大限制了此法的使用[6,32]。免疫分析方法利用抗原抗体的特异性结合,将加合物的定量信息转化为荧光或放射信号,可对加合物进行原位分析,观察其在组织或细胞中的分布[33]。免疫分析不需要酶解DNA,操作简便,结合校正曲线可实现加合物的半定量[33]。但此法所需的样品量较大,需要有待测加合物对应的特异性抗体,可能存在的交叉免疫反应也会出现高估情况[34-35]。
液质联用法具有优秀的选择性以及与32P后标记法相当的灵敏度,加之能提供加合物的结构信息,近来已成为DNA加合物最广泛使用的检测方法[6,36]。提取的DNA进行水解,得到2′-脱氧核苷混合物,经液相分离后进入质谱检测器,由于含有能量较低的糖苷键,容易失去2′-脱氧核糖部分(dR),从而发生-116 Da(高分辨率116.047 3 Da)的中性丢失[37],利用这一特征可对加合物进行定性定量分析。有的DNA加合物在热解或中度酸性条件下稳定性较差,碱基易从加合物上脱落,质谱分析还可以对碱基的中性丢失进行扫描[24,38]。
已知DNA加合物的检测可以根据其分子量、热稳定性等性质,设计具体的靶向检测方案。然而,环境中的遗传毒性物质来源复杂,仅从个别DNA加合物的角度解释其与特定肿瘤之间的关系可能并不全面,有必要同时检测多个已知或未知的DNA加合物,筛查潜在的遗传毒性物质。“组学”能从整体角度研究机体变化,其概念早已运用于基因组学、蛋白组学和代谢组学,也适用于DNA加合物的检测。Yao等[39]以此法在香烟浸出物孵育的卵泡细胞(follicular cells)中鉴定出4种与苯并[α]芘和4-氨基联苯有关的DNA加合物。DNA加合物组学可以通过同时检测多个已知或未知的DNA加合物水平来预测遗传毒性风险,加深DNA加合物在肿瘤发展进程作用的理解,未来很可能成为比单一加合物更可靠的生物标志物[32]。
3 液质联用DNA加合物组的研究进展
液质联用法检测DNA加合物,首先需要将DNA从待测样本中提取出来,水解成单核苷,经过富集纯化后使用液质联用法对加合物进行检测,其中每个步骤都可能影响到分析结果,譬如不同的提取方法影响DNA的纯度和得率,在线富集可以减少离线纯化加合物的损失,不同溶剂富集加合物效果以及引入的基质效应各有不同,甚至不同品牌的玻璃内衬管也会影响样品的清洁度和提取回收率[6,40-41]。
3.1 DNA水解 目前直接分析DNA链和寡核苷酸上甲基以外的修饰物或其他DNA结构变化还较为困难[8],研究者可以通过核酸酶、酸或热等手段将DNA水解为易于分析的小分子,不过水解的同时也丢失了加合物在DNA序列中的位置信息。甲酸或盐酸配合70~90 ℃的高温是常用的DNA酸水解方法[42-44],Tang等[45]将L02细胞和293T细胞用致癌性烷基化试剂1-甲基-1-亚硝基脲(MNU)、甲磺酸甲酯(MMS)和4-甲基亚硝胺基-1-3-吡啶基-1-丁酮(NNK)孵育,然后从细胞中提取DNA加入0.1 nmol·L-1的盐酸,85 ℃酸水解1 h,测得的烷基化核苷加合物的浓度RSD小于15%。然而,高温和酸性条件有较大的降解风险,相较而言,酶解条件更加温和,因此更常用于DNA的处理(见表1)。
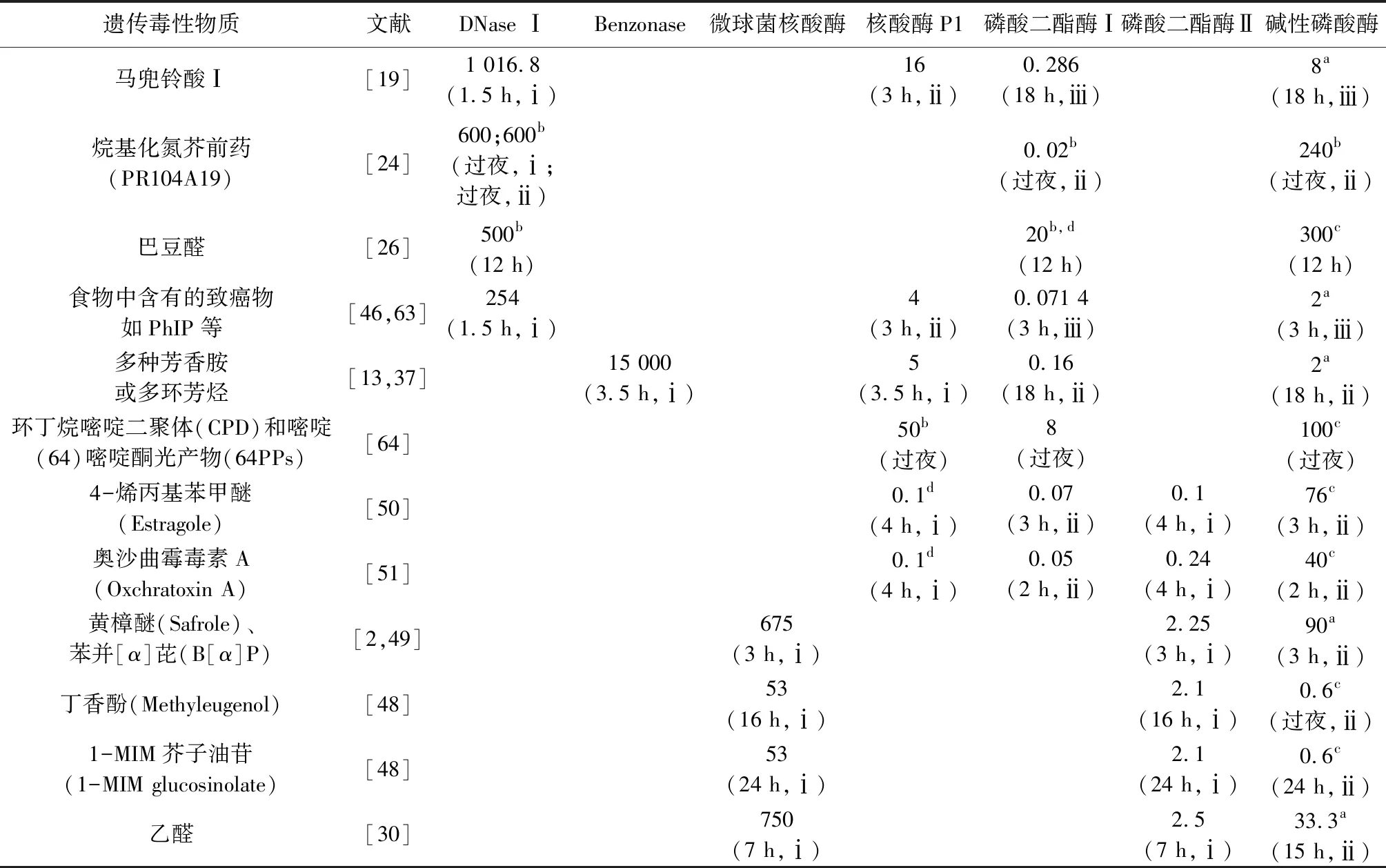
表1 液质联用DNA加合物检测常用的DNA水解酶种类、孵育浓度及时间
磷酸二酯酶可酶解核苷酸之间的磷酸二酯键,是DNA水解过程中常用的核酸外切酶。磷酸二酯酶Ⅰ(PDE Ⅰ)的酶解方向为3′到5′,将5′-核苷酸游离出来。磷酸二酯酶Ⅱ(PDE Ⅱ)酶解方向则相反,酶解产物为3′-核苷酸。PDE Ⅰ常与脱氧核糖核酸酶Ⅰ(DNase Ⅰ)和核酸酶P1(NP1)配合使用,其中DNase I的作用是将长链DNA酶解成寡核苷酸,NP1则是酶解寡核苷酸和单链DNA[19,24,46],有些序列的DNA具有磷酸二酯酶抗性,PDE Ⅰ无法完全水解寡核苷酸,加入NP1有助于寡核苷酸完全水解[47];PDE Ⅱ则常搭配非特异性核酸酶微球菌核酸酶(MN)[2,48-49];两种磷酸二酯酶有时也会同时使用[50-51]。为了便于质谱分析,生成的核苷酸还要经过碱性磷酸酶(AP)水解为核苷。
动物来源的DNase Ⅰ较为复杂,研究发现DNase Ⅰ是加合物检测中引起背景干扰和基质效应的重要因素之一。Guo等[37,41]将PDE Ⅰ 酶解方案中的DNase Ⅰ用量降低或者换成纯度更高的重组内切酶Benzonase,发现上述问题得到了很大改善。此外,来自不同品牌的核酸酶也可能影响DNA加合物的检测,来自Sigma-Aldrich和Merck两个品牌的PDE Ⅱ 具有不同的脱氧腺苷脱氨酶活性和3′-磷酸酶活性,可能对碱基上含有裸露环外氨基的加合物有不同影响[48]。不论是酸水解还是酶解,应考虑处理过程中DNA加合物的稳定性。为更好保证结果的可靠性,最好有同位素标记的加合物内标进行校正。
3.2 液相色谱条件 十八烷基硅烷键合硅胶为填充剂的色谱柱在DNA加合物及DNA加合物组学的分析中最为常用[1,4,37,52-53]。此外,Tang等[45]使用酰胺柱分离了14种烷基化修饰核苷和未修饰核苷。Murakami等[30]则使用氨基甲酰基键合的亲水相互作用色谱(HILIC)柱,将有机相比例提高到90%,从而提高电喷雾离子源(ESI)的离子化效率。
Zhang等[26,36]以巴豆醛或丙烯醛的DNA加合物为对象,比较了液质色谱法中常用的流动相添加剂对DNA加合物质谱响应的影响,发现与甲酸铵、乙酸铵和甲酸相比,流动相中加入碳酸氢铵后的检测灵敏度最高,推测碳酸氢铵抑制了质谱响应较差的金属阳离子-DNA加合物的形成,且HCO3-在离子源中降解形成CO2和水,有利于加合物的质子化。Murakami等[30]发现高比例有机溶剂(90%乙腈)的流动相中加入碳酸氢铵,也可以提高乙基加合物和巴豆醛加合物的质谱响应。有研究报道乙腈作为流动相质谱响应高于甲醇[45,54],但甲醇洗脱能力弱于乙腈,达到相同的保留时间所需的有机相比例更高,有机相的选择还需针对具体情况进行优化。
ESI电离效率随着流速降低而提高,将色谱柱内径减小至毛细管尺寸,流动相流速降低至以nL·min-1为单位(nanoflow),与特制的微米级甚至纳米级离子源(nano-ESI)配合,产生更小的初始液滴,可以提高电离过程中的去溶剂作用,而且更小的液滴包含更少的待测物,减少了待测物电荷之间的聚集和竞争,可以极大提升检测灵敏度[55]。Xiao等[46]使用Nano-LC-Orbitrap MSn分析了前列腺癌症患者切除的前列腺中的DNA加合物,采用2.5 μg DNA,定量限为1.3~2.2个加合物/109个核苷。Ma等[56]换用NanoESI离子源,将分析灵敏度在原有方法的基础上提高了7倍。
3.3 质谱扫描模式 除了靶向检测待测DNA加合物或利用中性丢失扫描模式(CNL)筛选未知DNA加合物外,还有许多基于中性丢失原理优化和发展而来的质谱扫描模式(图1)。Kanaly等[57]使用电喷雾串联质谱的多反应监测模式(MRM),在m/z228.8 ~ 602.8的范围内检测了374个[M+H]+>[M+H-116]+离子对,该模式也称伪中性丢失模式(Pseudo-CNL),符合条件的离子结合人工筛选、稳定同位素稀释以及与对照品比较,确认了吸烟者肺组织中多个氧化加合物的存在。Pseudo-CNL模式需要多次进样,但其灵敏度优于CNL模式[37]。譬如,在CT-DNA消化前掺入相同量的加合物对照品,采用扫描300个离子对的Pseudo-CNL模式,加合物dG-C8-4-ABP的检测灵敏度是CNL模式的2.8倍,而加合物dG-C8-PhIP在CNL模式下甚至无法检出。单个离子扫描时间越多,色谱峰越平滑,背景信号越低,因此需要平衡检测的离子对数与进样次数。需要注意的是,仅依靠-116 Da中性丢失的特征不足以确定色谱峰对应成分就是DNA加合物,通过CNL模式和Pseudo-CNL模式发现的DNA加合物仍需进一步进行鉴定。Bessette等[58]率先使用线性离子肼质谱(LIT-MS)对产生116 Da中性丢失的产物离子进行三级扫描(CNL-MS3),发现此法可以提供更多的结构信息。Balbo等[59]改用Obitrap高分辨质谱,为DNA加合物鉴定提供了更有利的支持。受限于现有仪器扫描速度不足,CNL-MS3模式无法扫描所有离子,数据采集更倾向于丰度较大的离子,导致低丰度加合物的信息丢失。与此相比,数据非依赖型采集模式(DIA)不依赖离子丰度,可以无偏向的收集目标m/z范围内的所有母离子(Precursor ions)及其MS2光谱。蛋白质组学中的SWATH(Sequential window acquisition of all theoretical mass spectra)扫描模式将MS2扫描分割成更小的窗口,简化了复杂的MS2数据处理,同时提高MS2的质量[60]。Guo等[37]借鉴并优化了SWATH扫描模式,将MS扫描分为宽度为30m/z扫描窗口(wide-SIM/MS2),成功用于DNA加合物组学的检测,提高了母离子和碎片离子的检测灵敏度。该扫描方式不仅可以检测以糖基中性丢失为特征的DNA加合物,还可以在不重新进行数据采集的情况下挖掘丢失碱基或其他质谱碎裂模式的DNA加合物相关信息。
3.4 数据处理 Murray等[52]开发了一种新的检测算法DFBuilder,结合碎片过滤的开源软件MZmine,建立了一个筛选和推定DNA加合物的自动化数据分析流程,减少了数据分析的处理时间和难度(见图2)。Turesky和Villalta实验室[61]为促进DNA加合物鉴定和数据挖掘,联合多个合作者建立一个DNA加合物开源数据库,其中DNA加合物对照品的高分辨质谱图均来自Q-TOF和Orbitrap这两个最常用的高分辨质谱平台,为DNA加合物的检测和鉴定提供了方便。高分辨质谱仪对于DNA加合物的鉴定具有重要作用,但检测的高成本限制了它的广泛使用。Chang等[62]使用组学分析方法中常用到的多变量分析方法-偏最小二乘判别分析法(PLS-DA),有效排除了QqQ-MS的假阳性结果,更广泛使用的低分辨质谱结合数据处理,或许能提供与高分辨质谱相当的功能。
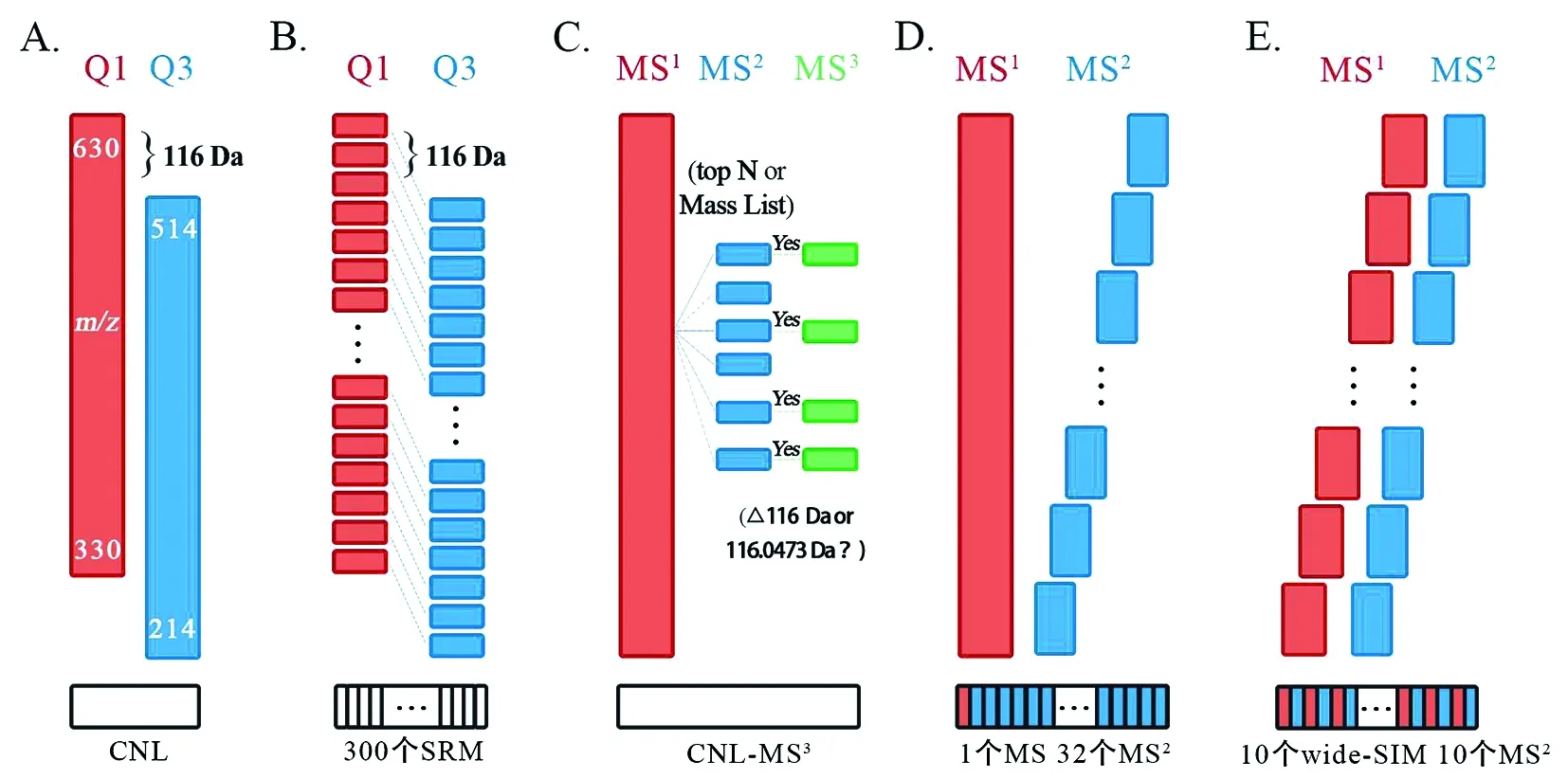
A.中性丢失扫描模式(CNL)[39];B.伪中性丢失扫描模式(Pseudo-CNL)[57];C.中性丢失触发三级质谱的扫描方式(CNL-MS3)[58-59];D.SWATH(Sequential window acquisition of all theoretical mass spectra)扫描模式[60];E.广泛选择离子监测串联质谱(wide-SIM/MS2)[37]图2 DNA加合物检测中常用的质谱扫描模式[10]
4 总结与展望
近年来新的样品处理方式、液质联用仪器和扫描方法、数据处理方式不断发展,DNA加合物组学技术也在逐渐成为多种DNA加合物同时检测以及未知加合物筛查的有力工具。DNA加合物的样品前处理较为烦琐,水解时间长,修饰核苷需要富集和分离。DNA加合物组数据,特别是从复杂基质中采用数据非依赖模式采集的数据,需要先依据中性丢失等特征进行筛选,再结合碎片离子信息和暴露源等情况,才能判断该离子是否是DNA加合物以及是否有未知的遗传毒性物质存在。更加简便易行的样品处理标准流程、数据处理工具和通用数据库还需要进一步开发,遗传毒性物质与癌症等疾病之间更深层次的关联以及DNA损伤修复等问题也需要更深入的研究。

