电针“委中”穴调节PGC-1α及相关影响因子对腰多裂肌损伤大鼠线粒体功能的影响
李霞 吕巧巧 徐菁 陈莉 田圆 张莉 刘通
腰多裂肌是从腰背部一直跨越至骶部的肌肉,其在维持腰椎稳定中提供70%力量[1],也是腰椎术后疼痛综合征发病的重要原因之一[2-3]。因此,恢复腰多裂肌结构和功能至关重要。腰多裂肌属于骨骼肌,骨骼肌损伤修复的机制与线粒体功能的变化紧密相关。线粒体功能正常一方面可减少活性氧(reactive oxygen species,ROS)等氧化应激对骨骼肌的伤害[4];另一方面,促进肌卫星细胞成肌分化,帮助骨骼肌再生[5]。过氧化物酶体增殖物活化受体γ共刺激因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)主要调节线粒体生物合成和抗氧化活性,在线粒体有氧磷酸化过程中发挥重要作用[6]。大量研究发现,PGC-1α受Ca2+信号通路调控[7]。钙/钙调蛋白依赖性蛋白激酶(Ca2+/calmodulin dependent protein kinaseⅡ,CaMKⅡ)可被Ca2+和钙调蛋白激活,导致自身磷酸化,磷酸化CaMKⅡ可活化PGC-1α并促进其表达,提高线粒体生物发生水平[8]。不仅如此,激活的CaMKⅡ还可直接活化cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB),CREB磷酸化后可启动PGC-1α基因表达,上调PGC-1α蛋白水平[9]。因此,钙/钙调蛋白依赖性蛋白激酶、CREB与PGC-1α对线粒体功能的影响具有重要意义,其可能是促进损伤骨骼肌线粒体功能恢复的机制。
课题组既往研究通过注射布比卡因制备大鼠多裂肌损伤模型,以电针“委中”为干预手段,电镜观察发现肌浆网肿胀,线粒体大小不一、结构异常,而针刺能够改善这一现象并促进多裂肌的损伤修复[10]。本研究拟通过多时间点观察,电针“委中”是否通过调节PGC-1α及相关影响因子的表达,减少线粒体功能损害,促进骨骼肌的损伤修复,从而阐释电针修复骨骼肌损伤的部分机制。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠72只,体质量200~250 g,由北京斯贝福实验动物中心提供[许可证号:SYXK(京)2019~0010]。在北京中医药大学动物房(清洁级)喂养,自然照明,自由摄食、饮水。整个实验过程中对动物的各种处理均遵照中华人民共和国科技部2006年颁布的有关动物的使用及伦理学规定。
1.2 实验分组
将动物随机分为正常组、模型组、电针组,每组24只。每组再根据干预天数随机分为1天、2天、3天和7天,4个亚组。其中左侧组织置于多聚甲醛浸泡,用于苏木精—伊红染色(hematoxylin-eosin staining,HE),右侧组织迅速置于液氮中,进蛋白免疫印迹(Western blot,WB)、聚合酶链式反应(polymerase chain reaction,PCR)生化法检测。
1.3 主要仪器和试剂
HANS-100 A电针仪,南京济生医疗科技有限公司;倒置显微镜及成像系统,日本尼康;全自动化学发光图像分析系统,美国Bio-Rad;酶标仪,M2型,芬兰Labsystems Multiskan M2;布比卡因盐酸盐,美国Sigma;HE染色试剂盒(G1120,北京索莱宝生物技术有限公司);TOMM20抗体(11802-1-AP,proteintech);钙离子测试盒(C004-2-1,南京建成生物工程研究所);SOD测试盒(A001-3,南京建成生物工程研究所);超微量总ATP酶测试盒(A070-1-2,南京建成生物工程研究所);RNA提取试剂盒(R4115,Magen);逆转录试剂盒(K1622,Thermo);荧光染料(A25472,Thermo)。
1.4 大鼠腰多裂肌损伤模型的制备
大鼠称重后用20%乌拉坦(0.5 mL/100 g)腹腔注射麻醉。腰背部备皮,操作过程保持无菌。在双侧脊椎L4、L5水平的多裂肌注射布比卡因溶液(100 μL,0.5%),使用一次性4号针头注射器抽取布比卡因溶液,针头紧贴棘突旁进入肌肉,直到接触关节突和乳突所在的骨面回抽套管1 mm,无血,表明针头已到达多裂肌后开始注射,注射时间不得小于3秒,以利于药物的吸收。共有四个注射点(L4、L5水平旁边各两点),共计400 μL(100 μL×4)。单次注射造模完成。通过HE染色进行模型评价,以镜下见炎性细胞浸润,肌肉组织间隙增大,肌纤维断裂为造模成功。
1.5 电针治疗方法
将大鼠固定在特制的固定器上,暴露后肢。采用华佗牌0.30 mm×13 mm一次性针灸针,针刺后连接韩式电针仪HANS-100 A,2/15 Hz的疏密波,电流强度2 mA,持续30分钟,1次/天。“委中”穴定位参照《实验针灸学》常用动物针灸穴位及图谱,定位于膝关节正后方凹陷中。模型组同时也在固定器中固定,但不做针刺干预。
1.6 检测指标及方法
1.6.1 HE染色 左侧多裂肌4%多聚甲醛固定24小时,常规石蜡包埋,切片厚度5 μm,置于37℃烘箱一夜,将切片置于二甲苯脱蜡2次,各5分钟;梯度酒精(100%、95%、80%、70%)各2分钟,蒸馏水2分钟,苏木素10分钟,自来水冲洗1分钟,分化液10秒,自来水浸泡15分钟,伊红50秒,自来水冲洗1分钟,梯度脱水(95%、95%、100%、100%)各2秒,二甲苯透明2次各1分钟,中性树脂封片。在显微镜下进行观察拍照。
1.6.2 Western blot进行TOMM20检测 从-80℃冰箱取出冻存组织,称取适量的肌肉,按照1 mg组织加入6 μL RIPA裂解液,在研磨机上进行充分研磨,裂解完成后离心,收集上清,通过BCA试剂盒进行蛋白定量,剩余上清加入5× loading buffer,95℃沸水煮5分钟后,置于-20℃冰箱,用于后续上样。制备5%浓缩胶和10%分离胶,每孔上样5 μL,浓缩胶60V 15分钟,分离胶80V 90分钟。跑胶完成后以400 mA进行电转,转膜结束后用10%的牛奶封闭2小时,敷一抗,放置-4℃冰箱过夜。室温回温10分钟后,TBST洗膜3遍,二抗室温孵育2小时,TBST洗膜3遍,在全自动化学发光图像分析系统滴加超敏ECL曝光。最终通过Image-lab进行条带分析。
1.6.3 PCR运用PCR检测PGC-1α mRNA、CaMKⅡ mRNA和CREB mRNA,称取20 mg新鲜组织,按照制造商的说明用RNA提取试剂盒提取RNA,并通过核酸紫外光谱法测定RNA浓度。根据试剂盒制造商的说明,在20 μL系统中将RNA反向转录成cDNA。引物序列及长度见表1。

表1 引物序列及产物大小
1.6.4 生化法 称取组织,按重量(g):体积(mL)=1∶9的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,3500转/分,离心10分钟,取上清液进行待测。按照Ca2+、SOD、ATP酶试剂盒说明书进行检测。为了消除样品制备时由于蛋白量的差异而造成的误差,用BCA试剂盒进行蛋白浓度测定试剂盒测定样品种的蛋白浓度,然后把浓度换算成nmol/mg蛋白的形式。
1.7 统计学方法

2 结果
2.1 HE染色观察形态学变化
通过HE染色观察1天、2天、3天、7天,正常组、模型组和电针组的形态学变化。发现正常组肌纤维排列紧密整齐,细胞核均匀排布且靠近肌膜,未见炎性细胞浸润。干预1 天后,模型组肌纤维间隙增大,间隙中分布炎性细胞浸润,肌纤维开始坏死断裂;电针组较模型组肌间隙缩短,炎性细胞浸润较少。干预2天后,模型组肌纤维大片坏死、断裂,肌细胞间隙增宽,大量炎性细胞浸润;电针组肌间隙内炎性细胞浸润较模型组少。干预3天,模型组与电针委中组仍可见较多新生的中央核纤维生成,但模型组仍可见较多炎性细胞浸润,而电针委中组的炎性细胞较少。干预7天,模型组仍可见炎性细胞与大量新生肌纤维,肌纤维细胞核位于中央,肌间隙变小,而电针委中组较多的新生肌纤维的细胞核已经逐渐迁移至细胞边缘,肌间隙缩小,炎性细胞浸润少。见图1。
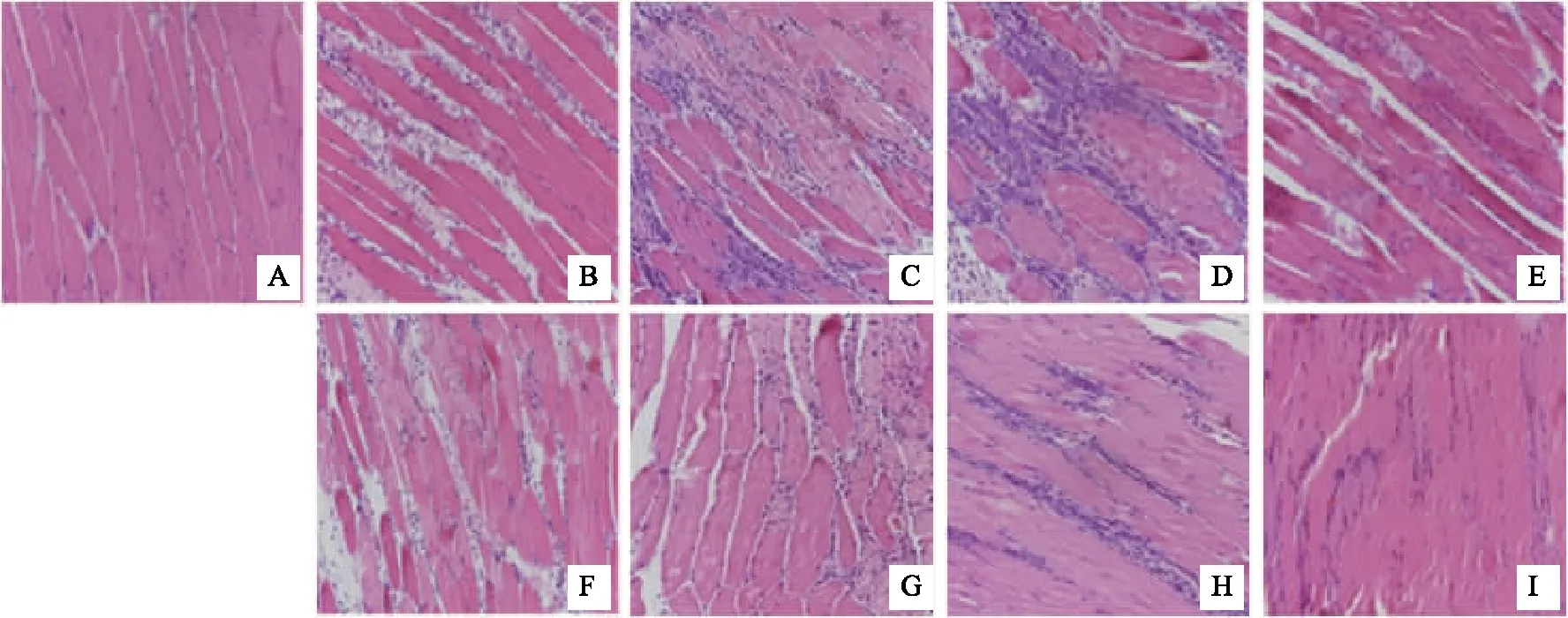
注:A 正常组;B-E 模型组亚组:1天、2天、3天、7天;F-I 电针组亚组:1天、2天、3天、7天。
2.2 多裂肌Ca2+、CaMKⅡ mRNA、CREB mRNA表达含量
为评价电针后多裂肌损伤后Ca2+的含量的变化,课题组进行了多时间点多裂肌Ca2+含量检测。与同一时间点正常组相比,模型组2天、3天亚组Ca2+含量升高(P均<0.05);与同一时间点模型组相比,电针组2天、3天亚组Ca2+含量降低(P<0.01,P<0.05);同一时间点,模型组和电针组1天、7天亚组均高于正常组(P<0.01,P<0.05)。与同一时间点模型组相比,电针组1天、7天亚组无显著差异。见表2。
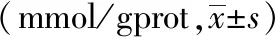
表2 不同时间点各组大鼠多裂肌Ca2+含量的变化比较
为评价电针对多裂肌损伤后CaMKⅡ mRNA表达的变化,课题组进行了各时间点多裂肌CaMKⅡ mRNA含量的检测。与同一时间点正常组比较,模型组和电针组2天、3天、7天亚组CaMKⅡ mRNA表达高于正常组(P<0.05);与同一时间点模型组比较,电针组2天、3天、7天亚组含量明显低于模型组(P<0.01)。1天时,三组无明显差异(P>0.05)。见表3。
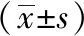
表3 不同时间点各组大鼠多裂肌CaMKⅡ mRNA表达含量的变化比较
为评价电针对多裂肌损伤后CREB mRNA表达的变化,同样进行了各时间点多裂肌CREB mRNA含量的检测。与同一时间点正常组比较,模型组和电针组1天、2天、3天、7天亚组均高于正常组(P<0.01);与同一时间点模型组比较,电针组2天、3天、7天亚组均高于模型组(P<0.01)。1天时则无统计学差异(P>0.05)。见表4。
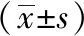
表4 不同时间点各组大鼠多裂肌CREB mRNA表达含量的变化比较
2.3 PGC-1αmRNA表达含量
为评价电针对多裂肌损伤后PGC-1α mRNA含量表达的变化,进行了各时间点PGC-1α mRNA含量的检测。与同一时间点正常组比较,模型组和电针组2天、3天、7天亚组均高于正常组(P<0.01);与同一时间点的模型组相比,电针组2天、3天亚组含量明显低于模型组(P<0.05),7天时,电针组和模型组比较无差异(P>0.05),1天时,三组含量表达无统计学差异(P>0.05)。见表5。
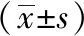
表5 不同时间点各组大鼠多裂肌PGC-1α mRNA表达含量变化比较
2.4 线粒体功能指标TOMM20、SOD与ATP酶表达情况
为检测多裂肌损伤后线粒体功能我们进行了TOMM20含量的检测。与同一时间点正常组比较,1天、2天、3天、7天时电针组与模型组均低于正常组(P<0.01);与同一时间点模型组比较,2天时电针组高于模型组(P<0.05);1天、3天、7天时电针组与模型组无统计学差异(P>0.05)。见图2、表6。
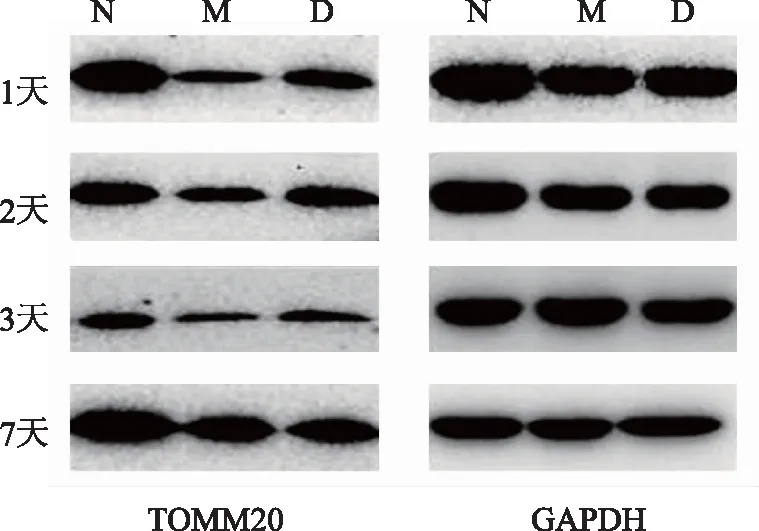
注:N 正常组;M模型组;D 电针组。
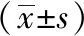
表6 不同时间点各组大鼠多裂肌TOMM20蛋白含量的变化比较
为检测多裂肌损伤后线粒体功能进行了SOD含量的检测。发现与正常组、模型组和电针组在1天、7天时SOD含量表达无统计学差异(P>0.05);2天时模型组含量明显低于正常组,但是电针组明显高于正常组(P<0.05);与同一时间点模型组相比,电针组含量明显高于模型组(P<0.01)。3天时模型组明显低于正常组(P<0.05),电针组与正常组无统计学差异(P>0.05)。与同一时间点模型组相比,电针组明显高于模型组(P<0.01)。见表7。

表7 不同时间点各组大鼠多裂肌内SOD含量表达的变化比较
为检测多裂肌损伤后线粒体功能进行了ATP酶含量的检测。与同一时间点正常组比较,1天、2天、3天时模型组低于正常组(P<0.01),但7天时无显著差异(P>0.05);2天、3天时电针组低于正常组(P<0.05,P<0.01),1天、7天时无显著差异(P>0.05)。与同一时间点模型组相比,1天、3天时电针组含量明显高于模型组(P<0.05),2天、7天时无统计学差异(P>0.05)。见表8。

表8 不同时间点各组大鼠多裂肌ATP酶含量的变化比较
3 讨论
“腰背委中求”针刺委中治疗腰背痛已广泛在临床应用[11]。Dar等[12]人研究发现针刺可显著改善腰多裂肌的功能,有课题组前期运用布比卡因注射进行多裂肌损伤大鼠模型,以电针“委中”为干预手段,通过1天、3天、7天多时间点进行多裂肌损伤大鼠的观察,发现多裂肌的损伤修复存在时间关联[13],并且发现针刺可以增加肌源性转录因子(paired box7,Pax-7)、成肌分化抗原(myogenic differentiation antigen,MyoD)和磷酸化蛋白激酶B(phosphorylated protein kinase B,P-AKT)蛋白表达的影响促进肌卫星细胞的增殖,且有促进成肌分化的趋势[14]。线粒体作为细胞的能量提供者,与肌肉能量代谢关系紧密,线粒体功能正常则促进卫星细胞成肌分化[5],而线粒体异常将抑制成肌分化。因此,促进线粒体功能的恢复,是促进成肌分化,帮助骨骼肌损伤修复的第一步。文献研究显示骨骼肌损伤2天时,线粒体功能影响最严重,这与先前的研究存在关联。因此,在本研究中,课题组通过布比卡因注射液诱导的大鼠多裂肌损伤模型,设置1天、2天、3天、7天的四个时间点进行观察,着力于研究对腰多裂肌损伤大鼠线粒体功能改变的相关机制,探讨电针的起效的具体机制。
HE染色结果发现,模型组肌纤维破坏,肌间隙增宽,炎性细胞浸润提示造模成功。干预后电针加速了新生肌纤维的融合,减少炎性细胞的浸润,帮助多裂肌的恢复。PGC-1α是调节线粒体生物合成的关键性信号分子,可以通过活化线粒体功能、提高骨骼肌氧化代谢能力[15]。当骨骼肌受到缺血、缺氧、低温、收缩及运动等刺激下, 可导致其表达增加, 进而启动线粒体DNA复制和转录而诱导线粒体生物合成[16]。因此,通过PCR进行PGC-1α mRNA表达变化的检测,发现造模后电针组与模型组损伤多裂肌内PGC-1α均较正常组增加,并且在模型组3天含量表达最多,而电针组则在2天含量表达最多,并且电针组的最高表达量明显低于模型组。张静等[17]发现PGC-1α mRNA的增加,可以显著提高SOD与ATP酶活性,以此帮助细胞改善线粒体能量代谢和减轻氧化应激。TOMM20已被证实是线粒体膜复合物易位酶的一个重要亚基,负责识别线粒体蛋白并将其从细胞溶质转移到线粒体中[17],降低提示线粒体丢失,可以反映线粒体的相对数量[18]。为进一步了解PGC-1α含量的增加对线粒体功能的影响,课题组通过检测TOMM20、ATP酶含量以及SOD的含量变化。结果显示,在造模后TOMM20、ATP酶、SOD的含量均减少,与同一时间点比较,电针能提高线粒体功能。值得注意的是模型组3天 PGC-1α含量表达最多,但线粒体功能反而受到抑制[19]。似乎PGC-1α含量的在一定范围内的增加会增加线粒体功能,但是PGC-1α的过表达会抑制线粒体功能。刘长华[20]研究认为,适当的PGC-1α表达增加可以改善心脏收缩功能、促进心肌能量代谢、改善心力衰竭预后,但是在PGC-1α超表达的转基因小鼠体内却发现该类动物心肌细胞过度肥大、线粒体过度增殖、三羧酸循环相关的酶系大量表达,从而引起心脏过度的肥厚及扩张。研究发现,成年小鼠PGC-1α过表达会造成线粒体生物合成过度激活,线粒体结构排列紊乱和心肌病的发生[20]。因此,应抑制PGC-1α表达的过度激活,而PGC-1α的适当增加会促进线粒体功能。本研究电针似乎通过减轻了PGC-1α的过度的激活,促进线粒体功能的恢复。
CaMKⅡ的磷酸化对PGC-1α的激活有至关重要的影响。当骨骼肌损伤,内质网应激释放大量的Ca2+,细胞内钙离子浓度突然升高,CaMKⅡ会发生快速磷酸化作用,此时CaMKⅡ被激活, 这种激活方式也会使CaMKⅡ产生最大活性[21]。激活的CaMKⅡ可直接活化CREB, CREB磷酸化后可与PGC-1α mRNA上游启动子区中的CRE序列结合,从而启动PGC-1α基因表达,上调PGC-1α蛋白水平[7]。CREB对PGC-1α调控障碍是导致线粒体损伤的重要病理事件。LIU等[22]发现布比卡因诱导的SH-SY5Y细胞氧化损伤中CREB磷酸化升高,用siCaMK2α或KN93抑制CaMKⅡα活性可降低CREB磷酸化。此外,Wrighet等[23]发现咖啡因激活CaMK后,PGC-1α mRNA表达显著升高,且CaMK抑制剂KN93抑制了这种增加,提示CaMK同样参与调控PGC-1α mRNA的表达。因此,CaMKⅡ直接或间接的影响PGC-1α的表达。课题组检测各时间点多裂肌内的Ca2+、CaMKⅡ mRNA和CREB mRNA,发现造模后模型组Ca2+、CaMKⅡ mRNA和CREB mRNA在3天达到表达高峰,而电针组Ca2+、CaMKⅡ mRNA的表达在2天已经达到高峰,CREB mRNA在3天达到表达高峰。值得注意的是电针组Ca2+、CaMKⅡ mRNA和CREB mRNA表达最高量明显低于模型组的最高表达量。这与PGC-1α变化趋势一致。因此,课题组大胆推测,由于造模后损伤多裂肌Ca2+、CaMKⅡ mRNA和CREB mRNA的过度表达,导致PGC-1α的过度激活,抑制了线粒体功能,电针通过抑制降低Ca2+、CaMKⅡ mRNA和CREB mRNA的表达,减轻对PGC-1α的过度激活,保护线粒体功能,进而促进骨骼肌的损伤修复。
综上,课题组通过复制腰多裂肌损伤模型,设置1天、2天、3天、7天四个时间点,检测PGC-1α以及PGC-1α相关因子,评估电针对损伤多裂肌线粒体功能的影响,发现电针可以减轻PGC-1α过度激活。较模型组而言,电针似乎加快了线粒体功能的恢复进程,促进骨骼肌快速修复。

