烷基锍类化合物与DNA复合物的性质研究
张 雷,张 莹,赖恩铭,陈文洋,周 林,李 婧
(黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319)
基因治疗是通过递送外源正常基因进入靶细胞,改变缺陷基因序列达到治疗目的的医用方法[1-2],其关键在于选择合适的递送载体。非病毒载体由于具有制备简单、低免疫原性、低毒性和可生物降解等优点,成为研究较为广泛的递送载体[3-4]。非病毒载体纳米级别的粒径有助于实现载体的靶向性和有效性。研究[5-6]发现,复合物颗粒的粒径达到一定尺寸时,能够通过内吞作用进入细胞,并且真核细胞中网格蛋白和小窝蛋白介导的内吞作用具有显著的颗粒尺寸依赖性。颗粒表面Zeta电位也是影响内吞作用的一个因素,Zeta电位为正的颗粒容易吸附在细胞膜表面,进而促进内吞作用。
目前,研究的非病毒载体主要包括阳离子多聚物、纳米颗粒及阳离子脂质体等[3,7]。其中,阳离子脂质体的正电荷头部能够与质粒DNA上的负电性磷酸根静电吸引,疏水脂肪链尾部能将质粒DNA缩聚为球状粒子,这些特点引起了许多研究者的兴趣[8-11]。作者所在课题组前期合成了一类烷基锍类化合物[12](图1a),由于该类化合物含有锍正离子和疏水脂肪链,从而具备了复合质粒DNA的能力。化合物Ⅰ和Ⅱ含有C12烷基链,在硫磷比(S/P)为40/1、50/1时显示出弱阻滞效果;化合物Ⅲ、Ⅳ含有C16烷基链,在S/P 为30/1时显示出弱阻滞效果,在S/P 为40/1、50/1时显示出较好的阻滞效果(图1b)。

图1 烷基锍类化合物的结构式(a)及烷基锍类化合物与gWiz-GFP质粒复合后的凝胶阻滞电泳图谱(b)Fig.1 Structural formula of alkyl-sulfonium compound(a) and electrophoretic mobility shift assay spectra(b) of alkyl-sulfonium compound and plasmid gWiz-GFP condensates
为深入研究烷基锍类化合物作为基因载体的性能,作者通过动态光散射实验测定化合物Ⅰ~Ⅳ与质粒DNA复合物的粒径和Zeta电位,通过MTT法研究化合物Ⅰ~Ⅳ的细胞毒性,通过荧光显微镜观察复合物的细胞摄取情况,为烷基锍类化合物基因载体的设计与转染能力提升提供基础。
1 实验
1.1 材料、试剂与仪器
人肝癌细胞株 Hep3B、HepG2、Huh7,购自美国模式培养物集存库(ATCC),本实验室长期冻存传代培养。
烷基锍类化合物Ⅰ~Ⅳ,自制。乙腈、二甲基亚砜(DMSO),分析纯,泉瑞试剂公司;蛋白胨、酵母粉、氯化钠,Oxoid 公司;卡那霉素,Biosharp公司;DH-5α,TIANGEN 公司;gWiz-GFP质粒,Aldevron 公司;EndoFree Plasmid Mega Kit,Qiagen公司;噻唑蓝(MTT)胰蛋白酶-EDTA消化液、青链霉素混合液(100×),Solarbio公司;DMEM/F12 高糖培养基,Thermo Fisher 公司;聚乙烯亚胺(PEI,25 kDa),Sigma公司;胎牛血清,四季青公司;Label IT Cy5标记试剂盒,Mirus Bio公司。
Nano-ZS ZEN型激光粒度仪,Malvern公司;Thermo Nanodrop 2000C 型分光光度计,Thermo Scientific公司;ELX800型全自动酶标仪,BioTek Instruments 公司;Leica DMI 4000B型显微镜。
1.2 溶液的配制
gWiz-GFP质粒DNA通过大肠杆菌进行扩增并提取[12]。
用乙腈将化合物Ⅰ~Ⅳ配制成30 nmol·μL-1的溶液,将gWiz-GFP质粒配制成25 ng·μL-1的溶液,用于复合物粒径、Zeta 电位的测定。
用DMSO将化合物Ⅲ、Ⅳ和PEI倍数稀释成31.25 μg·mL-1、6.25 μg·mL-1、1.25 μg·mL-1、0.25 μg·mL-1、0.01 μg·mL-1等5个浓度,用于MTT法细胞毒性检测。
用DMSO将化合物Ⅲ、Ⅳ配制成10 nmol·μL-1的溶液,将PEI配制成6 nmol·μL-1的溶液。将gWiz-GFP质粒配制成100 ng·μL-1的溶液后,使用试剂盒进行Cy5标记。用于复合物细胞摄取能力检测。
1.3 复合物粒径、Zeta 电位的测定
分别取化合物溶液(3.3 μL、4.1 μL )与双蒸水(28.7 μL、27.9 μL)混合成32 μL体系溶液;分别加入gWiz-GFP质粒32 μL(800 ng),漩涡振荡 10 s 后,室温静置20 min,形成S/P为40/1、50/1的化合物/质粒DNA复合物,将复合物用双蒸水稀释至1 mL,采用激光粒度仪测定其粒径、Zeta 电位。
1.4 细胞培养
细胞传代:人肝癌细胞株 Hep3B、HepG2、Huh7分别用含有10%胎牛血清、1%青链霉素混合液的DMEM/F12高糖培养基(10%FBS培养液)培养,待10 cm培养皿长满90%细胞后,吸弃培养液,用8 mL PBS缓冲液清洗细胞,吸弃PBS缓冲液,用1 mL胰蛋白酶消化细胞1 min,加入9 mL 10%FBS培养液阻断消化,用移液枪将贴壁细胞吹下,1 000 r·min-1离心3 min;吸弃上清,加入10 mL 10%FBS培养液,移液枪反复吹打细胞,按1∶3的比例传代。
细胞培养:取第三代对数生长期的细胞,用细胞计数法计数。取适量细胞,以每孔200 μL 10%FBS培养液接种于96孔板中;置于37 ℃、5%CO2培养箱中培养8 h以上直至细胞贴壁;随后将细胞培养液置换成200 μL 1%FBS血清培养液或无血清培养液培养至观测时间。
1.5 MTT法细胞毒性检测
于96孔板中,接种200 μL密度为每孔8 000个的细胞,培养8 h至贴壁;取配制好的不同浓度化合物Ⅲ、Ⅳ和PEI溶液加入到96孔板中,每孔加样量为1 μL(空白孔加入DMSO),最终上样浓度(μg·mL-1)分别为0、0.01、0.25、1.25、6.25、31.25;将处理好的96孔板置于37 ℃、5%CO2培养箱中分别培养24 h、48 h后,弃去培养液,每孔加入90 μL不含血清的细胞培养液,再加入10 μL 5 mg·mL-1的MTT溶液,继续在37 ℃、5%CO2培养箱中培养4 h;弃去培养液,每孔(包括空白孔)加入150 μL DMSO,水平摇床振荡10~20 min,用酶标仪测定490 nm处每孔的吸光度,计算细胞存活率。
1.6 复合物细胞摄取能力检测
将细胞爬片置于24孔板中,接种500 μL密度为每孔40 000个的细胞,培养8 h至贴壁。取化合物溶液9.8 μL与DMEM/F12高糖培养基40.2 μL混合成50 μL溶液。取参照PEI溶液4 μL与DMEM/F12高糖培养基46 μL混合成50 μL溶液。取Cy5标记的质粒DNA (8 μL,100 ng·μL-1)与DMEM/F12高糖培养基42 μL混合成50 μL溶液,以质粒DNA轻轻加入化合物的方式制备成100 μL的复合物溶液。避光静置30 min后,加入到24孔板中,置于37 ℃、5%CO2培养箱中培养4 h,弃去培养液,并用PBS缓冲液洗涤3次,每次8 min;加入4%多聚甲醛溶液静置30 min,进行细胞固定,用PBS缓冲液洗涤3次,每次10 min;加入1%曲拉通溶液静置20 min,进行细胞膜打孔,用PBS缓冲液洗涤3次,每次15 min;用含DAPI的封片剂将细胞爬片固定在载玻片上,进行细胞核染色,在荧光显微镜下观察荧光分布情况。
2 结果与讨论
2.1 复合物的粒径和Zeta电位(图2)

图2 复合物的粒径(a)和Zeta电位(b)Fig.2 Particle size(a) and Zeta potential(b) of condensates
烷基锍类化合物的正电荷头部与质粒DNA中电负性磷酸根静电吸引,疏水脂肪链尾部能将质粒DNA缩聚成纳米颗粒,适合尺寸的纳米颗粒会通过内吞作用进入细胞,Zeta电位为正的颗粒更容易吸附在带负电的细胞膜表面,加快内吞作用。由图2a可知,4个化合物与质粒DNA在S/P为40/1、50/1形成的复合物,粒径均在160~210 nm之间。由图2b可知,烷基链的长度明显影响复合物的Zeta电位,烷基链越长对质粒DNA的复合能力越强。化合物Ⅰ、Ⅱ与质粒DNA在S/P比为40/1和50/1形成的复合物,Zeta电位均为负值;化合物Ⅲ、Ⅳ与质粒DNA在S/P为40/1和50/1形成的复合物,Zeta电位均在+20 mV左右。另外,噻吩环和噻喃环对复合物的影响不显著。
2.2 细胞毒性
低细胞毒性是化合物作为理想非病毒基因载体的先决条件,采用MTT法检测化合物Ⅲ、Ⅳ分别对细胞Hep3B、HepG2、Huh7作用24 h和48 h后的细胞毒性,以黄金标准PEI作为对照,结果见图3。
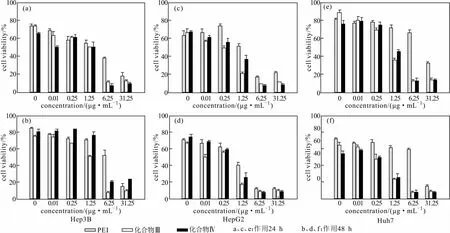
图3 化合物Ⅲ、Ⅳ、PEI对Hep3B、HepG2、Huh7的细胞毒性Fig.3 Cytotoxicity of compounds Ⅲ,Ⅳ,and PEI to cells Hep3B,HepG2,and Huh7
由图3可知,作用24 h后,化合物Ⅲ、Ⅳ与PEI相比,在较低浓度下细胞毒性无明显差异;在浓度大于6.25 μg·mL-1时,PEI处理组的细胞存活率整体偏高,而化合物Ⅲ、Ⅳ处理组的细胞存活率显著降低,说明化合物Ⅲ、Ⅳ存在较高的细胞毒性;同时发现,作用24 h后,化合物Ⅲ、Ⅳ对Hep3B、HepG2的细胞毒性大于Huh7细胞。作用48 h后,细胞存活情况与作用24 h的结果相似。
2.3 细胞摄取能力
细胞HepG2在用化合物Ⅲ、Ⅳ、PEI与gWiz-GFP-Cy5生成的复合物处理4 h后,细胞经过固定、打孔、细胞核染色,其中细胞核用DAPI蓝色染色(激发波长359 nm,发射波长461 nm),gWiz-GFP用 Cy5红色荧光标记(激发波长646 nm,发射波长664 nm)。在荧光显微镜下观察细胞对复合物的摄取情况,结果见图4。
由图4可知,PEI处理组在N/P为10/1时,细胞形态无明显变化,有明显的红色荧光分布在蓝色细胞核周围,证明实验条件下,PEI携带质粒DNA进入细胞内;化合物Ⅲ、Ⅳ处理组在S/P为40/1时,多数细胞形态皱缩,出现细胞脱落破损,细胞内无明显红色荧光。这是由于,在S/P为40/1时,烷基锍类化合物具有较高的细胞毒性,对细胞存在较强的杀伤能力,致使细胞无法有效摄取复合物。尝试使用复合物处理细胞2 h、1 h或降低DNA用量至100 ng·μL-1,观察细胞摄取情况,均未见明显改善。化合物中锍正离子对细胞的毒性限制了其转载DNA的效果,化合物结构仍需进一步优化。

(a) PEI/gWiz-GFP-Cy5,N/P=10/1 (b) Ⅲ/gWiz-GFP-Cy5,S/P=40/1 (c) Ⅳ/gWiz-GFP-Cy5,S/P=40/1图4 HepG2细胞摄取结果Fig.4 Uptake results of HepG2 cells
3 结论
研究了烷基锍类化合物作为基因载体的性能,结果表明,4个烷基锍类化合物与质粒DNA在硫磷比(S/P)为40/1、50/1时形成复合物的粒径均在160~210 nm之间;烷基链较短(C12)时,复合物的Zeta电位为负值,烷基链较长(C16)时,复合物的Zeta电位为正值,在+20 mV左右;细胞毒性检测结果显示,在较低浓度下,烷基锍类化合物与PEI相比,细胞毒性无明显差异,在浓度大于6.25 μg·mL-1时,烷基锍类化合物的细胞毒性强于PEI;细胞摄取能力检测结果显示,在S/P为40/1时,HepG2细胞存活状态较差,不能有效摄取复合物。烷基锍类化合物具有作为基因载体的潜力,后续仍需优化结构,进一步降低细胞毒性,完成基因传递作用。

