神经调节蛋白-1对脊髓损伤大鼠运动功能的影响及其机制
符禹玄,武 庚,侯广玉,朱 梅,石莉莉,赵富生
(牡丹江医学院1.第一临床医学院;2.基础医学院,黑龙江 牡丹江 157011)
脊髓损伤(spinal cord injury,SCI)是一种严重的中枢神经系统创伤,临床上患者表现为脊髓受损平面以下感觉、运动以及自主神经功能暂时或永久性丧失,甚至会危及生命[1]。SCI的治疗一直是世界性难题,目前仍缺乏有效的治疗方案。SCI发生后,在脊柱骨折或脱位等原发性损伤的基础上,继发局部组织出血、水肿、氧化应激、炎症反应等一系列病理变化,加重神经功能障碍[2]。小胶质细胞是中枢神经系统内固有免疫细胞,越来越多研究者认为,小胶质细胞是神经炎性反应的发动者和调控者[3]。研究表明,SCI后小胶质细胞活化、极化释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)等致炎因子和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),导致炎症反应、神经元凋亡和组织损伤[4]。因此,如何调控小胶质细胞极化,减轻炎症反应,促进运动功能的恢复,被认为是改善SCI的有效干预手段。神经调节蛋白-1(neureglin1,NRG-1)是一种含表皮生长因子(epidermal growth factor,EGF)结构域的跨膜信号蛋白,表达于心肌、神经元和神经胶质细胞等多种组织,在突触塑型、髓鞘形成以及心肌发育过程中发挥重要的作用[5]。研究表明,NRG-1含有α和β两种EGF样结构域,NRG-1β在神经系统和心肌细胞内表达较高,而NRG-1α主要表达于乳腺组织[5]。研究发现,NRG-1通过与其受体ErbB酪氨酸激酶结合发挥生物学作用,如NRG-1/ErbB结构或功能发生异常,可诱发阿尔茨海默症等多种神经退行性疾病[6]。在周围神经系统中,NRG-1能够促进施万细胞增殖、迁移和分化,参与神经损伤的再生和修复过程[7]。然而,NRG-1是否能够抑制小胶质细胞极化及炎症反应,改善SCI后运动功能,目前尚不清楚。本研究通过建立大鼠SCI半横切损伤模型,探讨NRG-1对SCI的修复作用及相关机制,以期为临床SCI治疗提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄健康雄性SD大鼠36只,由牡丹江医学院实验动物中心提供,许可证号SYXK(黑)2019-006。饲养环境温度20~24 ℃,湿度42%~46%,昼夜12 h交替光照,自由摄食饮水。实验过程符合国家及单位实验动物管理和使用规定。
1.1.2 主要试剂与仪器 ELISA试剂盒(上海西唐生物科技有限公司);兔抗鼠IBA1抗体(武汉三鹰生物技术有限公司);重组人神经调节蛋白-1β、ECL化学发光试剂盒、PVDF膜(上海碧云天生物技术有限公司);TNF-α、IL-1β和IL-6试剂盒(南京建成生物科技有限公司);酶标仪(Bio-Tek公司);激光共聚焦显微镜(Zeiss公司);凝胶成像系统(Bio-Rad公司);Image-Pro PLUS图像分析软件(MeyerInstruments公司)。
1.2 方法
1.2.1 脊髓半横切模型制备 参照文献[8],建立脊髓半横切模型。戊巴比妥钠麻醉大鼠,取俯卧位,背部正中纵行切口钝性分离筋膜及双侧椎旁肌,暴露T7-T9棘突、双侧椎板以及横突,剪除T8棘突及棘突下椎板暴露脊髓,虹膜刀避开血管垂直刺入右侧脊髓至椎管底部,刀锋向右划动至脊髓半横断。大鼠出现连续性鼠尾摆动,后肢痉挛性回弹,右后肢瘫软、肌张力消失、针刺无反应,提示造模成功。逐层缝合硬脊膜、肌肉、筋膜和皮肤,注青霉素(20万U/kg),2 次/d,连续3 d,将饲料和饮水置于动物可及范围,保持垫料干燥。
1.2.2 动物分组及处理 将SD大鼠随机分为假手术组(sham)、脊髓半横切模型组(SCI)和治疗组(NRG-1),每组12只。sham组:仅行椎板切除术,不损伤脊髓;NRG-1组:脊髓右侧半横切后,尾静脉注射100 μL NRG-1 β(10 μg/kg),1次/d,连续注射4周;SCI组:脊髓右侧半横切后,尾静脉注射等量PBS溶液。
1.2.3 BBB运动功能评分 术后第1、7、14、21、28天,各组随机选取6只大鼠进行BBB评分。BBB运动功能评分范围为0~21分,0分表示大鼠后肢瘫痪,21分为大鼠后肢运动功能正常。BBB评分采用双盲、双人独立完成评分,结果取平均值。
1.2.4 Nissl染色 术后第28天,取各组大鼠用戊巴比妥钠过量麻醉后,剖胸左心室灌注4%多聚甲醛,切取0.5 cm损伤节段脊髓,制备石蜡切片,经脱蜡和水化后,将切片置Nissl染液染色。光学显微镜观察脊髓组织神经元形态结构变化以及尼氏体密度。
1.2.5 免疫荧光染色 术后第28天,采用戊巴比妥钠过量麻醉处死大鼠,取损伤节段脊髓,制备冰冻切片,行免疫荧光染色。切片经固定、打孔、封闭后,加兔抗大鼠IBA1一抗(稀释度1∶200),湿盒内4 ℃孵育过夜,次日加Cy3标记的二抗,DAPI染核,采集图像并采用Image J软件分析荧光强度。
1.2.6 Western blot蛋白检测 取各组大鼠损伤节段脊髓提取总蛋白,采用BCA法测定蛋白含量。通过SDS-PAGE凝胶电泳分离蛋白、转模及封闭后,加iNOS(1∶1000)和β-actin(1∶2000)一抗,4 ℃孵育过夜,次日加二抗,37 ℃孵育2 h,滴加ECL发光试剂成像,应用ImageJ软件分析目的蛋白条带相对灰度值。
1.2.7 ELISA实验 按照试剂盒说明书操作,检测脊髓组织中TNF-α、IL-1β和IL-6含量。标准品孔中加入标准品稀释液,样品孔中加入待测样品及稀释液,37 ℃孵育,加显色剂和终止液,酶标仪在450 nm波长处测各孔光密度(OD)值。
1.3 统计学处理应用SPSS 17.0软件进行统计学分析。数据以“均数±标准差”表示。BBB实验数据采用多因素方差分析,组间不同时间点的多重比较采用LSD法;其余实验组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 NRG-1对SCI大鼠运动功能影响术前各组大鼠BBB评分均为21分。术后第7天和第14天,SCI组和NRG-1组BBB评分均逐渐增高,但两组间比较无统计学差异(P>0.05)。术后第21天和第28天,NRG-1组BBB评分显著高于SCI组(P<0.05),见图1。
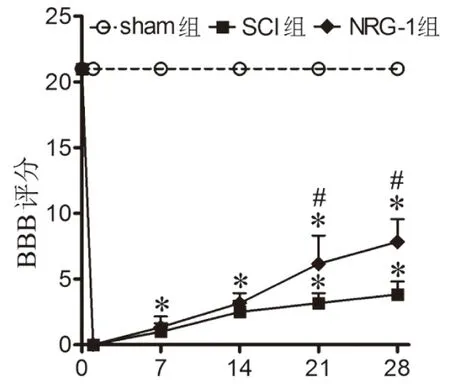
图1 ConA诱导肝损伤模型小鼠血清ALT和AST变化
2.2 NRG-1对神经元损伤的影响各组大鼠脊髓组织Nissl染色及尼氏体密度分析如图2所示。SCI组脊髓组织空洞较多,神经元破坏、溶解,尼氏体密度降低;经NRG-1治疗后,脊髓组织中空洞减少,神经元形态结构完整,尼氏体密度明显增加。
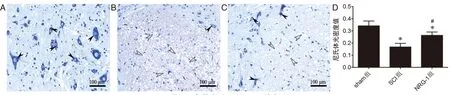
图2 大鼠脊髓组织Nissl染色
2.3 NRG-1对小胶质细胞活化的影响各组大鼠脊髓组织IBA1免疫荧光染色以及荧光强度分析如图3所示,与sham组相比,SCI组IBA1荧光强度值显著增高(P<0.05);与SCI组相比,NRG-1组荧光强度值显著降低(P<0.05),但仍高于sham组(P<0.05)。
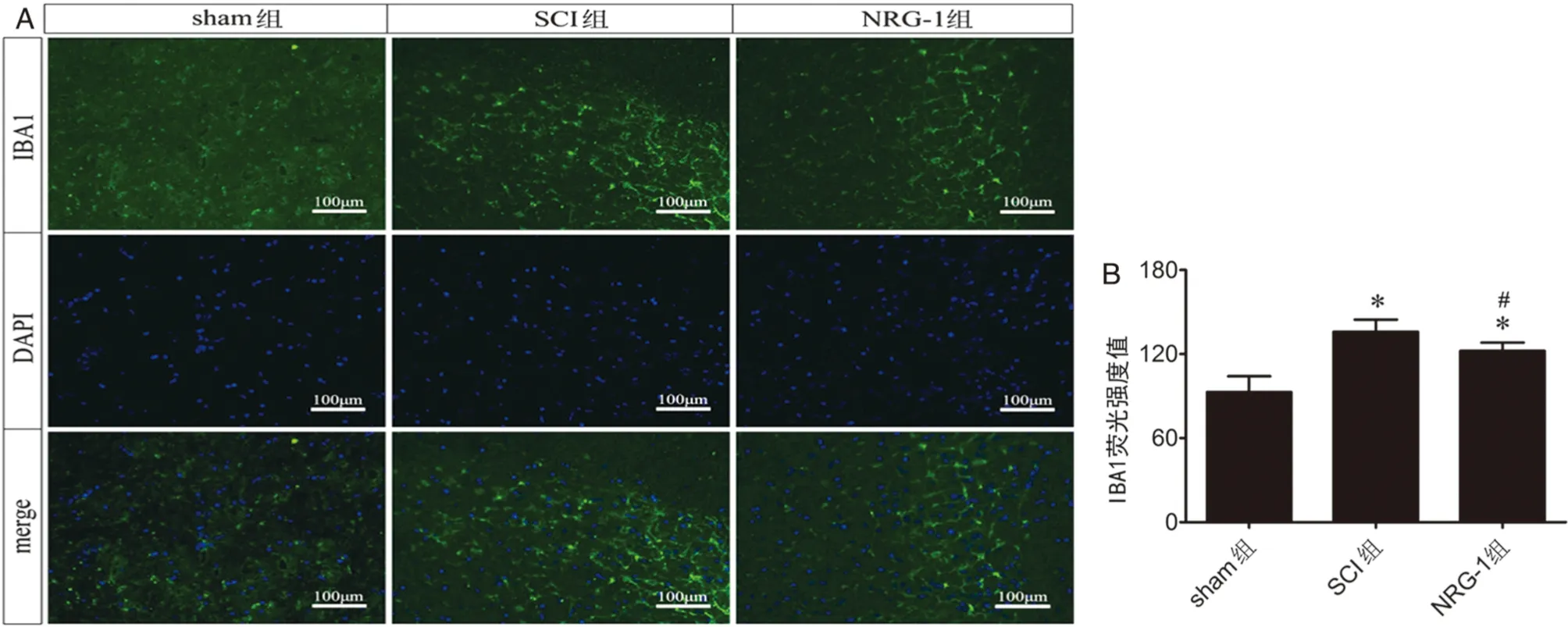
图3 NRG-1对小胶质细胞活化的影响
2.4 NRG-1对小胶质细胞M1型极化的影响各组大鼠脊髓组织M1型小胶质标志蛋白iNOS分析如图4示,与sham组相比,SCI组iNOS蛋白表达水平显著升高(P<0.05);与SCI组相比,NRG-1组iNOS蛋白表达水平降低(P<0.05),但仍高于sham组(P<0.05)。
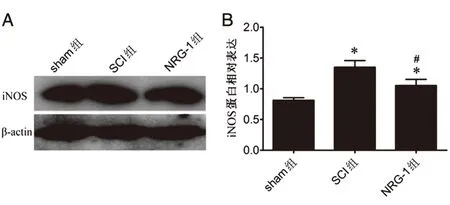
图4 各组大鼠脊髓组织iNOS蛋白表达比较
2.5 NRG-1对炎症因子表达的影响各组大鼠脊髓组织中IL-1β、IL-6和TNF-α含量如图5所示。与sham组相比,SCI组IL-1β、IL-6和TNF-α含量均显著增加(P<0.05);与SCI组相比,NRG-1组IL-1β、IL-6和TNF-α含量均显著降低(P<0.05),但仍高于sham组(P<0.05)。
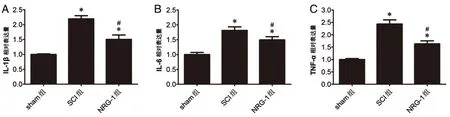
图5 NRG-1对大鼠脊髓组织炎症因子表达的影响
3 讨论
SCI是由交通事故、高空坠落、自然灾害等因素引起的一类致残率很高的中枢神经系统创伤性疾病。目前,SCI治疗多通过药物或手术等方式缓解症状,延缓并发症发生,难以从根本上恢复受损神经功能,给患者身心造成极大伤害,同时也给社会和家庭造成巨大的经济负担。据研究报道,我国每年遭受SCI困扰的患者约3~5万人,且呈现逐年增加趋势[9]。研究表明,NRG-1具有促进轴突再生以及髓鞘形成的作用,在神经系统疾病治疗中具有广阔的应用前景[10]。本研究发现,通过尾静脉注射NRG-1能够减轻SCI导致的运动功能障碍,促进大鼠后肢运动功能的恢复。有研究报道,鞘内注射NRG-1蛋白可以抑制损伤区脊髓组织胶质瘢痕形成,减轻局部炎症反应,改善SCI后大鼠肢体运动功能[11]。在本研究中,尼氏染色结果显示,NRG-1能够减轻大鼠损伤区脊髓组织神经元核固缩,恢复神经元尼氏体密度。我们推测,NRG-1可能通过调节小胶质细胞极化,抑制炎症反应发挥神经保护作用。
研究表明,小胶质细胞在神经炎症反应过程中发挥重要的作用。生理条件下,小胶质细胞处于静息态,发挥免疫监视作用。在病理情况下,小胶质细胞迅速活化转化成为具有递呈抗原和释放促炎症细胞因子的经典激活型(M1)小胶质细胞,吞噬异常蛋白、核酸和死亡细胞,增加中枢神经系统对病理性刺激的防御能力。然而,M1型小胶质细胞也具有诱导神经元死亡、加重神经炎性反应以及神经组织损伤等神经毒性作用。选择性激活型(M2)小胶质细胞具有释放营养因子和抗炎细胞因子,吞噬死亡细胞和异常蛋白,促进神经元存活和组织修复,支持和保护中枢神经系统结构和功能完整性的作用[12]。本研究结果表明,NRG-1能够抑制SCI诱导的小胶质细胞活化,并能够抑制小胶质细胞M1型极化标志蛋白iNOS的表达,提示NRG-1具有调控小胶质细胞极化的功能。研究发现,SCI可诱导细胞产生大量炎症细胞因子,如IL-1β、IL-6、TNF-α等,这些炎症细胞因子可刺激诱导其它炎症介质产生。同时,这些炎症细胞因子也可促进小胶质细胞活化,加重SCI后神经组织的炎症损伤[13]。本研究表明,损伤脊髓组织中IL-1β、IL-6、TNF-α含量均出现不同程度升高,经NRG-1处理后IL-1β、IL-6、TNF-α含量均显著降低。这些变化表明,SCI可导致促炎症细胞因子大量产生,加重脊髓损伤局部炎症反应,NRG-1能够抑制IL-1β、IL-6、TNF-α产生,从而减轻SCI引起的神经炎症反应,发挥脊髓保护作用。
综上所述,本研究证实NRG-1能够促进SCI大鼠运动功能恢复,其作用机制可能与抑制小胶质细胞M1型极化,减轻炎性反应和改善神经元损伤有关。本研究结果为SCI治疗提供了一定的实验依据。但NRG-1的神经保护分子机制需进一步深入研究。

