有氧糖酵解对巨噬细胞炎症反应的影响
陆灵光,黄 敏,江潜城,邵 丹,颜璐琦,段滇宁,2,陈洪博,2★
(1. 龙岩学院 生命科学学院,福建 龙岩 364012;2. 福建省家畜传染病防治与生物技术重点实验室,福建 龙岩 364012)
巨噬细胞作为重要的免疫细胞,负责清除入侵的病原体、凋亡细胞和碎片,同时执行重要的稳态任务,以确保组织的完整性和功能性。事实上,巨噬细胞几乎存在于身体的每个器官中,它们在组织中形成自我维持的群体,可在损伤后通过循环的单核细胞补充,或不断与浸润的单核细胞区分开来。虽然单核细胞来源的巨噬细胞通过最终造血起源于骨髓,但在原始和最终造血过程中,组织巨噬细胞祖细胞来源于卵黄囊。胚胎来源的巨噬细胞保留了自我更新的潜能,而单核细胞来源的细胞是终末分化的,尽管存在这些差异,但单核细胞来源的和组织驻留的巨噬细胞在维持组织内稳态和损伤后的组织再生中都发挥着关键作用。当炎症过程由组织内稳态的改变而触发时,血液循环循环中的骨髓源性单核细胞通过由常驻巨噬细胞、基质细胞和内皮细胞分泌的促炎症趋化因子的特定环境被吸引到炎症部位。在炎症部位,单核细胞分化为巨噬细胞,巨噬细胞与常驻细胞协同维持免疫或促进炎症的解决和组织再生。
研究表明巨噬细胞表型变化与细胞能量代谢状态密切相关,而且可能取决于所在环境中代谢物或营养物质的浓度。此外,疾病可以改变组织微环境,从而影响巨噬细胞的代谢和功能,反过来,巨噬细胞代谢可能是疾病解决或进展的关键。细胞能量代谢是一个复杂的网络,对细胞适应性至关重要,由分解代谢过程(营养物质的降解,主要用于线粒体中的代谢物或能量生成)和合成代谢过程(利用代谢物合成细胞结构)组成。简而言之,葡萄糖、脂类或氨基酸通过几种代谢反应(如糖酵解、脂肪代谢或谷氨酰胺代谢)转化为代谢物(如丙酮酸、三羧酸循环(TCA 循环)中间产物、脂肪酸或游离胆固醇)。这些细胞代谢物要么在线粒体中被完全氧化,用于生产细胞的原料(例如:氨基酸、核苷酸等),或防止从细胞中释放有害物质(例如:乳酸或过量胆固醇)。其中,能量代谢不仅与巨噬细胞介导的炎症反应密切相关,也与细胞自噬或吞噬功能相关。
1 巨噬细胞特点
巨噬细胞在组织内环境稳定中发挥重要作用,它们协调先天免疫和适应性免疫的启动和运行阶段,对保护性免疫和免疫介导的病理损伤产生重大影响。一般认为,巨噬细胞代表一系列活化表型,而不是稳定的亚群(见图1)。M1 型巨噬细胞由病原微生物的产物诱导,如脂多糖(LPS)和其他Toll 样受体(TLR)配体,或由Th1 淋巴细胞分泌的细胞因子诱导,如干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)。从功能角度来看,M1 巨噬细胞的特点是能够杀死病原体,并将其抗原呈递给T 淋巴细胞以启动适应性反应。因此,它们表达CD80、CD86、主要组织相容性复合物II 类受体(MHC-II)、环氧合酶2(COX-2)和诱导型一氧化氮合酶(iNOS),并产生高水平的促炎细胞因子,如TNF-α、IL-1β、IL-6、IL-12和IL-23 等,并促进Th1 反应。这些细胞因子的表达主要受转录因子NF-κB 以及STAT1、STAT3、IRF4、HIF-1α 和AP1 的激活和核转位控制。
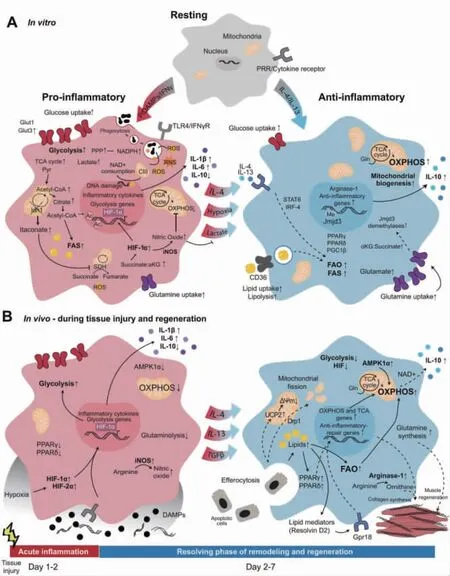
图1 在体外和体内巨噬细胞极化表型特征
M2 型巨噬细胞由先天性和适应性免疫细胞分泌的IL-4 或IL-13 诱导,如肥大细胞、嗜碱性粒细胞和Th2 淋巴细胞。M2 型巨噬细胞具有抗炎特性,可以解决炎症和组织修复。它们表达高水平的甘露糖受体(CD206)、IL-1R 和IL-1R 拮抗剂,并产生促纤维化因子,如转化生长因子β(TGF-β)和胰岛素样生长因子1(IGF-1),从而积极抑制炎症和促进修复。此外,与M2 极化相关的标记物和效应物包括STAT6、GATA3、SOCS1、PPARγ(过氧化物酶体增殖物激活受体γ)、CD163、CD36、FIZZ1、基质金属蛋白酶(MMPs)和精氨酸酶1(ARG1)。精氨酸酶活性的增加导致多胺和胶原蛋白的产生,有利于组织重塑和伤口愈合。最后,M2 巨噬细胞通过产生血管内皮生长因子A(VEGF-A)、内皮生长因子(EGF)、血小板衍生生长因子(PDGF)和IL-8 来诱导血管生成和淋巴管生成。
M1 和M2 型巨噬细胞的平衡以及巨噬细胞炎症反应的适当解决对宿主体内平衡至关重要。在小鼠模型中,先天性免疫反应在触发自身免疫疾病中的重要性已被认识。尽管众所周知,由周围微环境(包括细胞因子、生长因子和微生物相关分子模式)触发的转录反应塑造了巨噬细胞的表型和功能。因此,巨噬细胞的极化的精确调控对机体炎症反应十分重要。
2 有氧糖酵解
肿瘤细胞即使在氧气充足的环境下,也会选择糖酵解作为主要供能方式,肿瘤细胞这种特殊代谢方式被称为有氧糖酵解,这种现象又称“Warburg 效应”(见图2)。病毒感染可同肿瘤一样诱导宿主细胞产生“Warburg 效应”,且该效应所涉及的病毒种类及宿主细胞种类愈来愈多。病毒诱导细胞糖代谢改变具有病毒种类特异性,同种病毒对不同宿主细胞同一调控靶点也可能不同。目前对病毒调控糖宿主代谢酶相关研究主要集中在病毒对细胞糖代谢相关酶表达的调控。在有氧糖酵解过程中细胞通过上调葡萄糖转运蛋白提高细胞对葡糖糖的摄取,并促进糖酵解关键酶己糖激酶-2(HK-2),M2 型丙酮酸激酶(PKM2)、丙酮酸脱氢酶激酶-1(PDK-1),6-磷酸果糖激酶-2/果糖双磷酸酶3(PFKFB3)的表达,抑制丙酮酸脱氢酶,抑制丙酮酸转化为乙酰CoA,其中PFKFB3 是影响糖酵解的一种关键酶,在LPS 诱导巨噬细胞增强糖酵解作用中发挥了重要作用。
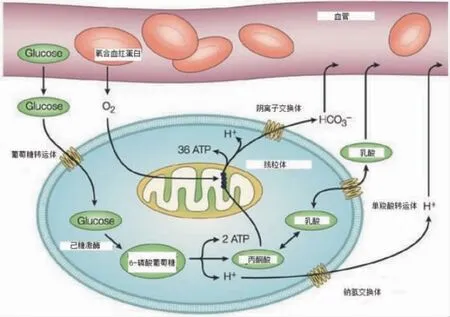
图2 有氧糖酵解过程
巨噬细胞极化涉及细胞能量代谢重编程,当巨噬细胞收到病原微生物刺激后,可以从基于氧化磷酸化的有氧状态切换到基于糖酵解的无氧状态,特点是葡萄糖摄取增加、糖酵解率高,然后是乳酸发酵以及氧化磷酸化水平降低,即使在氧气充足的情况下也是如此。M1 型巨噬细胞利用糖酵解和磷酸戊糖途径(PPP)来满足其ATP 需求,而TCA 循环在两个点被打破,OXPHOS 以及脂肪酸氧化(FAO)被下调。异柠檬酸脱氢酶-1(IDH-1)是一种将异柠檬酸转化为α- 酮戊二酸(α-KG)的酶,它被下调,促使柠檬酸盐的积累和衣康酸盐的合成。柠檬酸盐转化为乙酰辅酶A(CoA),首先用于从头组蛋白乙酰化和炎症基因转录,其次作为FAS 的底物,导致细胞膜扩张和蛋白质合成增加所需的脂肪酸积累。衣康酸是M1 巨噬细胞激活时最高度上调的代谢物之一。衣康酸抑制琥珀酸脱氢酶(SDH),抑制琥珀酸转化为延胡索酸,导致TCA 循环第二次中断和琥珀酸积累。琥珀酸积累稳定缺氧诱导因子-1α(HIF-1α),通过基因表达程序促进第二波持续代谢重编程。SDH 氧化琥珀酸可促进LPS 处理细胞的促炎症反应,并诱导线粒体ROS(mtROS)的产生,mtROS 被招募到吞噬体以增强细菌杀灭能力,但它们也会诱导氧化性DNA 损伤。M1 诱导的一氧化氮(NO)具有抗菌作用,NO 导致的线粒体功能障碍降低了细胞中三磷酸腺苷(ATP):二磷酸腺苷(ADP)的比例,这已被证明可以抑制炎症反应。然而,NO也可以阻止炎性巨噬细胞的M2 极化,可能会阻碍免疫反应过渡到解决阶段。
相比之下,在M2 型巨噬细胞中,TCA 循环是完整的,其代谢活动以FAO 和OXPHOS 增强为特征。M2 型巨噬细胞精氨酸酶表达增加导致鸟氨酸和多胺生物合成途径活性增加,促进OXPHOS 依赖性M2 分化所需的线粒体蛋白的表达。这些细胞的能量特征是与脂肪酸摄取、运输和氧化相关的基因表达增加,以及培养物中葡萄糖和脂肪酸摄取增加。虽然M1 巨噬细胞在很短的时间内增加糖酵解,但M2 巨噬细胞只在稍后的时间点增加糖酵解,不依赖糖酵解进行分化。相反,M2 巨噬细胞利用谷氨酰胺和FAO 来支持其对IL-4 感应的代谢需求。谷氨酰胺分解促进α-KG 的积累,导致含有Jumonji 结构域的蛋白质D3(JMJD3)脱甲基酶的激活,M2 特异性基因启动子上依赖JMJD3 的组蛋白去甲基化负责M2 极化。谷氨酰胺还支持尿苷二磷酸N- 乙酰葡萄糖胺(UDP-GlcNAc)的合成,以及病原体识别所需的凝集素和甘露糖受体的N- 糖基化。
3 糖酵解过程与炎症
糖酵解是M1 型巨噬细胞的一个关键代谢事件,其抑制作用影响其炎症表型的许多典型功能,包括吞噬、ROS 生成和促炎细胞因子的分泌。糖酵解代谢适应依赖于几种转录因子的激活,其中HIF-1α 在常氧条件下的糖酵解激活中也起着关键作用。在巨噬细胞中,两个主要的信号通路最终导致HIF-1α 转录的氧非依赖性调节:TLR/NF-κB和AKT/mTOR 通路。一些炎症信号,例如通过模式识别受体(PRR)或促炎细胞因子识别病原体,在NF-κB 激活中汇聚,NF-κB 激活是巨噬细胞功能的主要调节器,调节包括HIF-1α 在内的多个基因的表达。另一方面,AKT/mTOR 途径由生长因子(如GM-CSF)和病原体感应受体(TLR4)触发。有趣的是,mTORC1 还增加了线粒体生物发生和氧化代谢相关基因的表达,如PPAR-γ。在这一点上,Akt 激酶似乎以一种亚型特异性的方式调节巨噬细胞极化:虽然Akt1 缺失促进了M1 分布,但Akt2 的缺失具有相反的效果,导致M2 反应的放大。除了这些信号通路之外,M1 细胞中HIF-1α 的表达也可以通过TCA 循环中断处的琥珀酸来稳定。在巨噬细胞中,HIF-1α 作为细胞反应的代谢和功能调节器,调节编码糖酵解酶、葡萄糖转运蛋白GLUT1 以及炎症介质的基因的表达。GLUT1 的上调对M1 巨噬细胞的糖酵解活性很重要,因为它促进了葡萄糖的快速摄取。此外,HIF-1α 通过促进两种酶的表达来支持丙酮酸转化为乳酸:乳酸脱氢酶和丙酮酸脱氢酶激酶,前者从丙酮酸产生乳酸,后者使丙酮酸脱氢酶失活,从而限制丙酮酸进入TCA 循环。在限制OXPHOS 的M1 巨噬细胞中,丙酮酸转化为乳酸对于恢复NAD+和维持通过糖酵解途径的流量至关重要。
糖酵解调节的另外两个点发生在6- 磷酸果糖-2- 激酶B(PFKFB)和丙酮酸激酶M2(PKM2)水平。M1 型巨噬细胞主要表达PFKFB3 亚型,与其他亚型相比,PFKFB3 亚型催化果糖-2,6- 二磷酸转化为果糖-6- 磷酸的效率较低,从而增强糖酵解通量。此外,M1 细胞上调丙酮酸激酶(PKM2)的亚型2,该亚型在巨噬细胞代谢和极化中发挥多种作用。事实上,当高度表达时,PKM2 存在于酶不活性单体或二聚体与酶活性四聚体的平衡中。非活性酶转移到细胞核中,通过与HIF-1α 结合,触发HIF-1α调节基因的表达。
糖酵解在M2 型巨噬细胞功能中的作用更具争议。几项研究表明,糖酵解在M2 细胞中是活跃的,它被2- 脱氧葡萄糖(2-DG)阻断,2-DG 是一种成熟的糖酵解抑制剂,可能会抑制M2 极化和功能。另一方面,最近的数据表明,只要氧磷保持完整,M2分化不需要糖酵解。这表明M2 巨噬细胞显示出更灵活的代谢活性,因为即使在没有使用谷氨酰胺进行糖酵解的情况下,它们也能供应氧磷。M2 型巨噬细胞糖酵解的另一个控制点是糖酵解酶6- 磷酸果糖-2- 激酶B1(PFKFB1)的选择性表达,它能更有效地将糖酵解激活剂果糖-2,6- 二磷酸分解为果糖-6- 磷酸,降低糖酵解速率。
M1 和M2 细胞之间的代谢差异影响这些细胞产生ROS 的能力。在耦合和有效呼吸的情况下,电子传递链(ETC)产生的ROS 数量保持在控制和低水平。在OXPHOS 功能紊乱的情况下,会发生大量电子泄漏,在氧气存在的情况下,会产生ROS。这是促炎性巨噬细胞的情况,在这种情况下,极化会深刻地改变氧磷,导致活性氧的产生。虽然CI 和CIII被认为是线粒体ROS 产生的主要位点,但最近的研究表明,在OXPHOS 受损的情况下,ROS 是通过ETC 的CI 处的反向电子传递(RET)而不是CIII 产生的。Toll pathways(ECSIT)是泛素化和CI 相关蛋白的TRAF6 靶点,是巨噬细胞中ROS 产生和线粒体质量控制的主要调节因子。尤其是,在吞噬细菌后,ECSIT 触发线粒体向吞噬体的募集,产生活性氧,激活NADPH 氧化酶杀死细菌。除了作为代谢的有害副产品外,细胞内的活性氧还通过激活许多氧化还原敏感途径,成为细胞信号传导的主要调节者。在巨噬细胞中,已知活性氧可调节多种功能,包括吞噬、杀死细菌和分化为特定表型。已知线粒体ROS 通过调节IL-6、TNF-α 和IL-1β 细胞因子的分泌来维持炎症,其机制涉及线粒体ROS 依赖性MAPK 激活。
4 结 论
在过去的几年中,巨噬细胞的能量代谢反应已被深入研究,并已成为调节细胞炎症反应和免疫反应的关键因素。病原体或炎症信号通过快速调节关键基因的表达,推动巨噬细胞向获得新功能的方向分化。多个炎症相关疾病研究表明,机体病理性免疫反应可能是由异常的能量代谢构成的,几种代谢产物作为信号介质发挥着重要作用,不仅影响巨噬细胞,也影响邻近细胞,因此为治疗多种疾病指明方向。

