射血分数改善型心力衰竭的临床特点及预后研究
苏康康 ,王岩 ,王立立 ,陈淑霞 ,,*,谷剑 ,,
在各国指南中,左心室射血分数(left ventricular ejection fraction,LVEF)常被作为心力衰竭(heart failure,HF)分类的依据[1-3]。但 LVEF并非一成不变,随着治疗手段的进步,临床经常可以观察到LVEF发生改善,即某些患者可能从较低LVEF过渡到较高LVEF,由此产生了射血分数改善的HF(HF with improved EF,HFimpEF)这一概念。有研究发现,HFimpEF临床特点及预后与其他类型的HF不同,然而这一临床表型始终缺乏统一的定义[4-6]。最近多国心力衰竭学会联合发布了HF普遍定义专家共识,将HF分为四类,在原有基础上增加了HFimpEF,并定义为:基线LVEF≤40%,第二次测量时LVEF比基线增加≥10%,且LVEF>40%[7]。但迄今为止,相关的研究多集中于欧美国家,我国关于此类人群的报道较少,本研究依据上述专家共识中HFimpEF的定义,旨在对我国HFimpEF患者的临床特点和预后进行分析,以期为此类人群的防治提供循证医学依据。
1 资料与方法
1.1 研究设计与人群 选取2018年6月至2020年5月在河北省人民医院心内科住院治疗的慢性心力衰竭(chronic heart failure,CHF)患者。从电子病历中获取患者的人口学特征和基线临床信息:人口学数据包括年龄、性别等;基线临床信息包括体格检查〔体质指数(body mass index,BMI)、血压、心率、纽约心脏病协会(NYHA)Ⅲ/Ⅳ级等〕、吸烟史、合并疾病(扩张型心肌病、肥厚型心肌病、心房颤动、高血压、冠心病、心脏瓣膜病、糖尿病、慢性肾脏病、高尿酸血症、低蛋白血症、血脂异常、贫血等)、超声心动图指标〔LVEF、左心室收缩末内径(left ventricular end systolic diameter,LVESD)、左心室舒张末内径(left ventricular end diastolic diameter,LVEDD)等〕、实验室指标〔血红蛋白、红细胞计数、血小板计数、血清K+、肌酐、氨基末端脑利钠肽前体(NT-proBNP)、估算肾小球滤过率(eGFR)、肌酸激酶同工酶(CK-MB)〕、治疗情况〔血管紧张素转换酶抑制剂/血管紧张素受体Ⅱ拮抗剂(ACEI/ARB)、血管紧张素受体脑啡肽酶抑制剂(ARNI)、钙通道阻滞剂(CCB)、β-受体阻滞剂、醛固酮受体拮抗剂、利尿剂、抗血小板药物、口服抗凝药等、他汀类药物、经皮冠状动脉介入术(percutaneous coronary intervention,PCI)、冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、起搏器等〕。
纳入标准:(1)HF的诊断应符合《中国心力衰竭诊断和治疗指南2018》[3]的诊断标准:射血分数保留的心力衰竭(HFpEF)具有HF的症状和体征、LVEF≥50%、利钠肽升高,并符合以下至少1条:①左心室肥厚和/或左心房扩大;②心脏舒张功能异常。射血分数中间值心力衰竭(HFmrEF)具有HF的症状和体征、LVEF 40%~49%、利钠肽升高,并符合以下至少1条:①左心室肥厚和/或左心房扩大;②心脏舒张功能异常。射血分数降低的心力衰竭(HFrEF)具有HF的症状和体征、LVEF<40%。(2)年龄≥18岁,性别不限。(3)至少有2次超声心动图结果,2次超声心动图时间间隔大于3个月,并在2年之内。排除标准:(1)未进行或仅有1次超声心动图检查;(2)患有威胁生命的合并疾病;(3)特定的HF亚组(单纯的右心衰竭、心肌淀粉样变、先天性心脏病等)。
本研究通过河北省人民医院伦理委员会审查(伦理审查编号:202196),并被批准免除知情同意。
1.2 超声心动图及分组 通过超声心动图获得LVEF,根据基线及复查时的LVEF进行分组。仅一次复查者,以基线及复查时的LVEF作为分组依据;多次复查者以此前LVEF最低(LVEF<40%时更可能接受指南推荐的治疗方案)及最后复查结果作为分组依据。患者两次LVEF均≥50%定义为HFpEF组;两次LVEF均在40%~49%为HFmrEF组;基线LVEF<40%、复查仍<40%为HFrEF组;基线LVEF<40%而第2次≥40%,且改善绝对值≥10%为HFimpEF组。
1.3 随访及终点事件 自最后一次复查超声心动图开始通过电子病历、门诊及电话进行随访,终点事件为全因死亡及全因再住院,随访时间截至2021-06-01。
1.4 统计学方法 采用SPSS 26.0统计软件进行分析,满足正态分布及近似正态分布的计量资料以(±s)表示,满足方差齐性时两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,当方差齐时多组间两两比较采用LSD-t检验,方差不齐时两两比较采用Dunnett's T3检验;高度偏态分布的计量资料以M(Q1,Q3)表示,以基于秩次的假设检验方法检验其差异,多组间比较采用Kruscal-Wallis检验,两两比较采用Mann-Whitney U检验,使用Bonferroni法校正P值。计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法,组间相互比较以Bonferroni法校正P值;采用Logistic回归分析确定变量与“射血分数改善”的关系;采用Kaplan-Meier法绘制全因死亡率、全因再入院率的生存曲线,比较采用Log-rank检验;采用Cox比例风险回归模型评估危险因素与全因死亡率的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 人口学特征 被诊断为CHF患者1 397例,根据纳入、排除标准,最终530例患者纳入研究,其中HFpEF组245例,HFmrEF组55例,HFrEF组133例,HFimpEF组97例。
四组年龄、性别、收缩压、心率、NYHAⅢ/Ⅳ级比例、扩张型心肌病比例、心房颤动比例、高血压比例、冠心病比例、高尿酸血症比例、贫血比例、LVESD、LVEDD、血红蛋白、红细胞计数、肌酐、NT-proBNP、CK-MB、ARNI使用率、CCB使用率、β-受体阻滞剂使用率、醛固酮受体拮抗剂使用率、利尿剂使用率、抗血小板药物使用率、口服抗凝药等药物使用率和PCI接受率比较,差异有统计学意义(P<0.05)。其中,HFimpEF组年龄、性别、收缩压、心率、扩张型心肌病、心房颤动、基线时血红蛋白、红细胞计数、CK-MB、ARNI使用率、β-受体阻滞剂使用率、醛固酮受体拮抗剂使用率、利尿剂使用率、抗血小板药物使用率和PCI接受率与HFpEF组比较,差异有统计学意义(P计量资料<0.05,P计数资料<0.008)。HFimpEF组心率、冠心病、LVESD、ARNI使用率、β-受体阻滞剂使用率和醛固酮受体拮抗剂使用率与HFmrEF组比较,差异有统计学意义(P计量资料<0.05,P计数资料<0.008)。HFimpEF组收缩压、NYHAⅢ/Ⅳ级、基线时LVESD、LVEDD、血红蛋白、β-受体阻滞剂使用率和醛固酮受体拮抗剂使用率与HFrEF组比较,差异有统计学意义(P计量资料<0.05,P计数资料<0.008)。HFrEF组高尿酸血症、贫血比例高于HFpEF组,ARNI使用率低于HFpEF和HFmrEF组,口服抗凝药使用率低于HFpEF组,差异有统计学意义(P<0.008)。四组BMI、舒张压、吸烟史比例、肥厚性心肌病比例、糖尿病比例、慢性肾脏病比例、低蛋白血症比例、血脂异常比例、血小板、血清K+、eGFR、ACEI/ARB比例、他汀类药物使用率、CABG使用率、起搏器比例比较,差异无统计学意义(P>0.05),见表1。
2.2 LVEF改善影响因素的多因素Logistic回归分析以LVEF改善与否(赋值:改善=0,未改善=1)为因变量,以表1中HFimpEF与HFrEF组之间存在差异的指标收缩压(赋值:实测值)、NYHAⅢ/Ⅳ级(赋值:有=1,无=0)、LVESD(赋值:≤37 mm=1,>37 mm=0)、LVEDD( 赋 值: ≤ 55 mm=1,>55 mm=0)、ACEI/ARB(赋值:有=1,无=0)、β-受体阻滞剂(赋值:有=1,无=0)、醛固酮受体拮抗剂(赋值:有=1,无=0)为自变量行单因素Logistic回归分析,结果提示:收缩压、NYHAⅢ/Ⅳ级、LVESD、LVEDD、ACEI/ARB、β-受体阻滞剂、醛固酮受体拮抗剂是LVEF改善的预测因素(P<0.05)。将年龄、性别及上述自变量纳入Logistic回归方程,完全调整后的多因素Logistic回归分析发现收缩压较高、LVESD≤37 mm、应用β-受体阻滞剂和醛固酮拮抗剂是LVEF改善的影响因素(P<0.05),见表2。
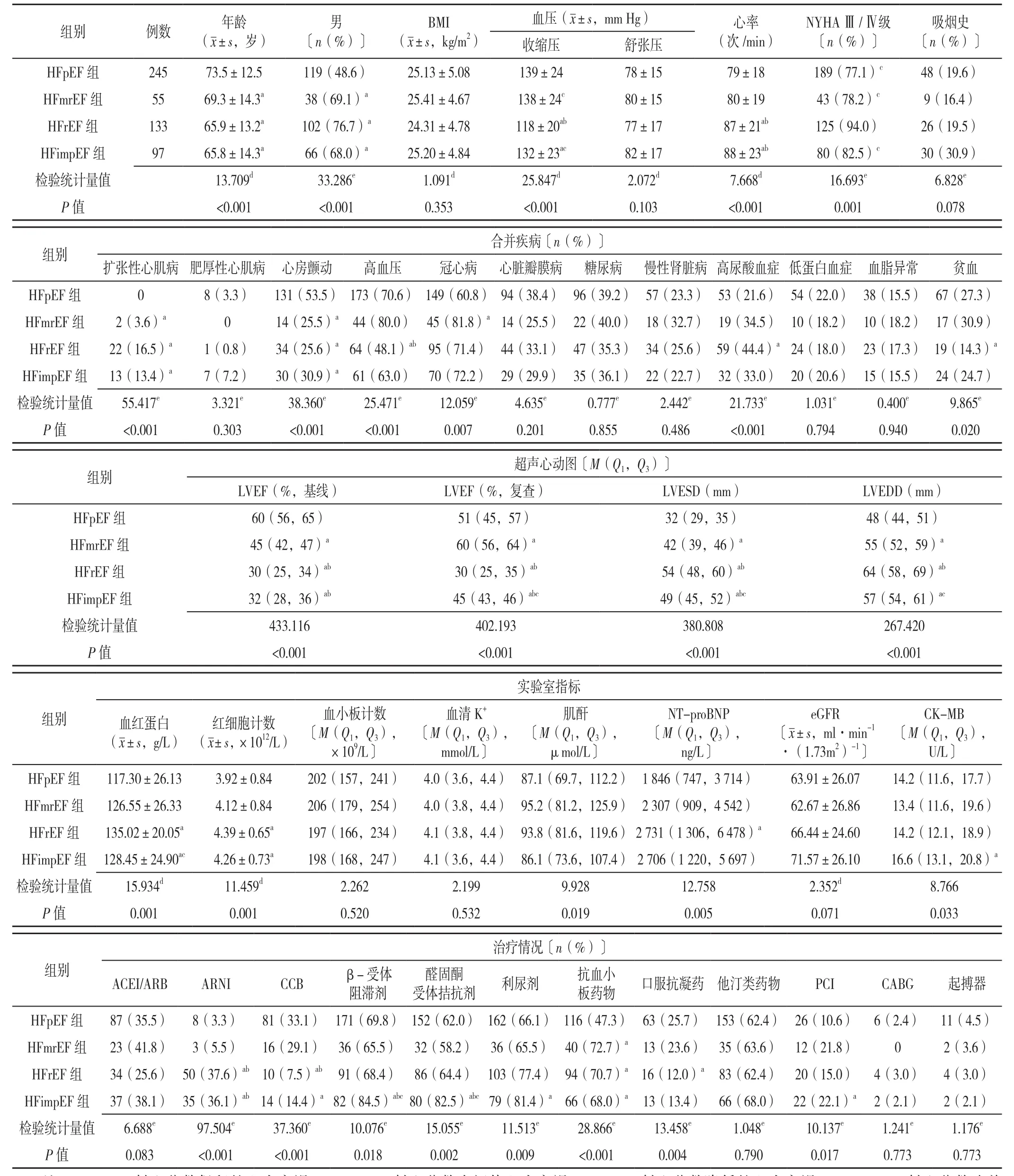
表1 四组基线临床特征比较Table 1 Baseline clinical characteristics based on clinical phenotype of heart failure in heart failure patients

表2 LVEF改善影响因素的Logistic回归分析Table 2 Logistic regression analysis of factors associated with improved left ventricular ejection fraction in heart failure patients
2.3 终点事件及Kaplan-Meier曲线 在447.0(300.3,612.5)d的随访中,共116例(21.9%)患者死亡,其中HFimpEF组9例(9.3%)、HFpEF组52例(21.2%)、HFmrEF组9例(16.4%)、HFrEF组46例(34.6%)。四组死亡率比较,差异有统计学意义(χ2=24.542,P<0.001),见图1;调整年龄和性别后四组死亡率比较,差异有统计学意义(Waldχ2=31.810,P<0.001)。其中HFimpEF组与HFpEF组、HFrEF组死亡率比较,差异有统计学意义(HFimpEF组vs HFpEF组,χ2=6.020,P=0.014;HFimpEF组 vs HFrEF组,χ2=19.665,P<0.001);HFimpEF组与HFmrEF组死亡率比较,差异无统计学意义(χ2=1.329,P=0.249)。四组全因再入院率比较,差异有统计学意义(χ2=12.727,P<0.001);HFimpEF组 再 入 院 率 低 于 HFpEF组(χ2=6.435,P=0.011) 和 HFmrEF组(χ2=11.733,P=0.001);HFimpEF组再入院率与HFrEF组比较,差异无统计学意义(χ2=1.404,P=0.236),见图2。
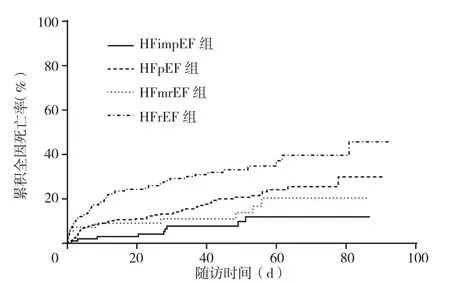
图1 四组心力衰竭患者累积全因死亡率的Kaplan-Meier曲线Figure 1 Kaplan-Meier curves for the cumulative incidence of allcause death in four groups of heart failure patients with different clinical phenotypes of heart failure

图2 四组心力衰竭患者累积全因再住院率的Kaplan-Meier曲线Figure 2 Kaplan-Meier curves for the cumulative incidence of all-cause readmissions in four groups of heart failure patients with different clinical phenotypes of heart failure
2.4 终点事件风险因素分析 全部CHF患者全因死亡和全因再入院的累积发生率如图1、图2所示,分别以是否死亡(赋值:是=1,否=0)和是否再住院(赋值:是=1,否=0)为因变量,以年龄(赋值:实测值)、性别(赋值:男=1,女=0)、BMI(赋值:实测值)、血压(赋值:实测值)、心率(赋值:实测值)、NYHAⅢ/Ⅳ级(赋值:有=1,无=0)、吸烟史(赋值:有=1,无=0)、扩张型心肌病(赋值:有=1,无=0)、肥厚型心肌病(赋值:有=1,无=0)、心房颤动(赋值:有=1,无=0)、高血压(赋值:有=1,无=0)、冠心病(赋值:有=1,无=0)、合并心脏瓣膜病(赋值:有=1,无=0)、糖尿病(赋值:有=1,无=0)、慢性肾脏病(赋值:有=1,无=0)、高尿酸血症(赋值:有=1,无=0)、低蛋白血症(赋值:有=1,无=0)、血脂异常(赋值:有=1,无=0)、贫血(赋值:有=1,无=0)、LVEF(赋值:实测值)、LVESD(赋值:≤37 mm=1,>37 mm=0)、LVEDD(赋值:≤55 mm=1,>55 mm=0)、血红蛋白(赋值:实测值)、红细胞计数(赋值:实测值)、血小板计数(赋值:实测值)、血清K+(赋值:实测值)、肌酐(赋值:实测值)、NT-proBNP(赋值:实测值)、eGFR〔赋值:≤ 60 ml·min-1·(1.73 m2)-1=1,>60 ml·min-1·(1.73 m2)-1=0〕、CK-MB(赋值:实测值)、ACEI/ARB(赋值:有=1,无=0)、ARNI(赋值:有=1,无=0)、CCB(赋值:有=1,无=0)、β-受体阻滞剂(赋值:有=1,无=0)、醛固酮受体拮抗剂(赋值:有=1,无=0)、利尿剂(赋值:有=1,无=0)、抗血小板药物(赋值:有=1,无=0)、口服抗凝药(赋值:有=1,无=0)、他汀类(赋值:有=1,无=0)、PCI(赋值:有=1,无=0)、CABG(赋值:有=1,无=0)、起搏器(赋值:有=1,无=0)为自变量进行单因素Cox比例风险回归分析,结果提示年龄较大、心脏瓣膜病、慢性肾脏病、低蛋白血症、贫血,未接受ACEI/ARB、β-受体阻滞剂、醛固酮受体拮抗剂、口服抗凝药治疗,以及未接受PCI等因素是患者全因死亡的危险因素(P<0.05)。考虑到部分自变量与终点事件可能存在相关性,以P<0.1筛选自变量,完全调整后HFrEF、年龄较大、合并心脏瓣膜病、慢性肾脏病、贫血、未应用β-受体阻滞剂及口服抗凝药是患者全因死亡的独立风险因素(P<0.05),见表3。HFpEF、HFmrEF、慢性肾脏病是患者全因再入院的独立风险因素(P<0.05),见表4。
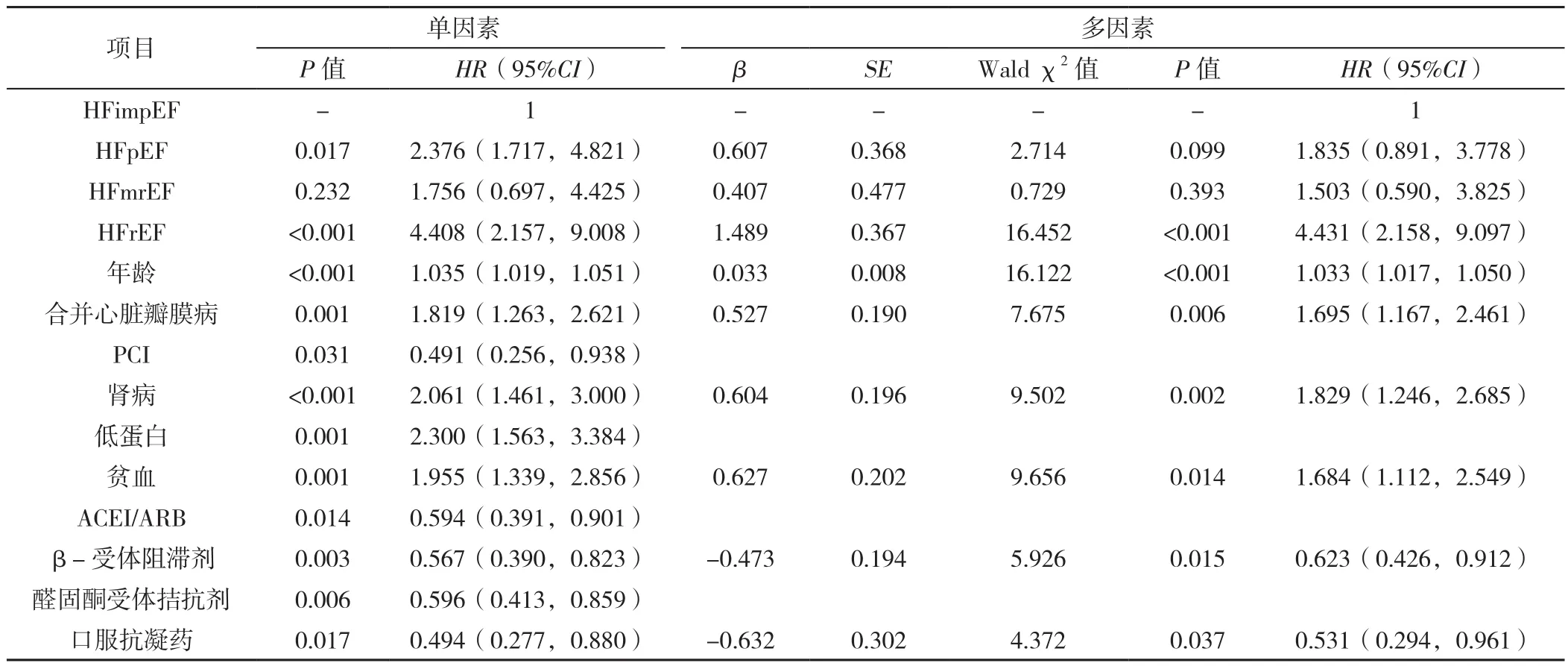
表3 CHF患者全因死亡的单因素和多因素Cox比例风险回归分析Table 3 Univariate and multivariate Cox regression analyses of all-cause death in chronic heart failure patients
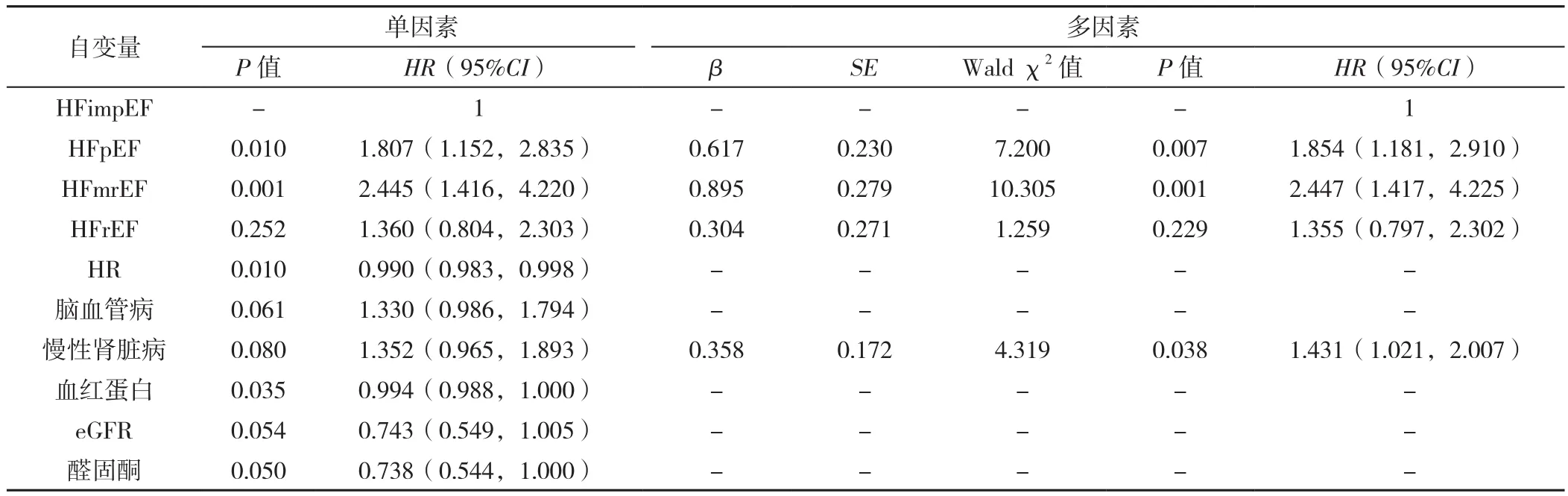
表4 HF患者全因再住院的单因素和多因素Cox比例风险回归分析Table 4 Univariate and multivariate Cox regression analyses of all-cause readmissions in chronic heart failure patients
进一步分析HFimpEF患者全因死亡的风险因素,赋值方式同上,单因素分析提示年龄较大、合并心脏瓣膜病、肌酐、血清K+、贫血是HFimpEF患者全因死亡的风险因素。将上述变量进行多重共线性检验,各变量之间不存在多重共线性(VIF均<1.1),然后将上述变量纳入Cox比例风险回归模型进行多因素分析,纳入方法选择逐步向前法。Cox比例风险回归模型整体有统计学意义(χ2=22.314,P<0.001),合并心脏瓣膜病、贫血是HFimpEF患者死亡的独立风险因素(P<0.05),见表5。
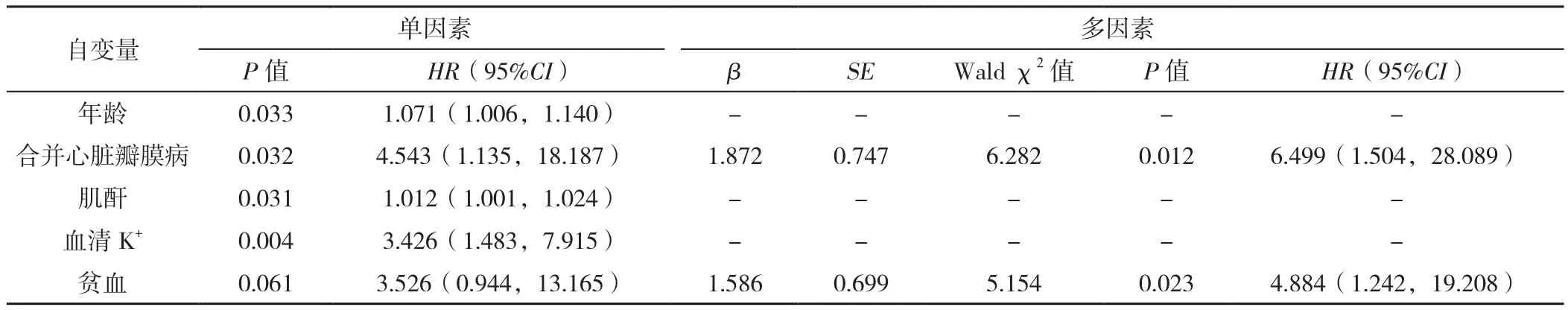
表5 HFimpEF患者全因死亡的单因素和多因素Cox比例风险回归分析Table 5 Univariate and multivariate Cox regression analyses of all-cause death in HFiEF patients
3 讨论
HFimpEF的概念始于PUNNOOSE等[4]在2011年的一项研究,他们将LVEF由基线<40%恢复至≥40%且变化绝对值≥5%定义为射血分数恢复的心力衰竭(HF with recovered EF,HF-REF),并发现HF-REF患者更年轻,更少患有冠心病、糖尿病、心房颤动、高血压等疾病。此外,在HF患者中,HF-REF患者的症状最轻,因HF再次入院的次数最少。随着药物、器械、手术等治疗手段的进步,LVEF改善的现象逐渐引起重视。但由于研究的异质性,以及对HFimpEF定义不一致,HFimpEF的流行病学、临床特点和预后均有所差异[8-10]。
既往研究中CHF患者LVEF恢复的比例10%~60%[11-12]。本研究结果显示,基线LVEF<40%的HF患者约42%(97/230)发生了射血分数恢复,恢复比例略高于LUO等[13]的报道,原因可能与纳入人群的病因构成比不同有关,非缺血性病因的患者更可能发生LVEF的恢复[14-16]。另一个可能的原因是本研究中出现HFrEF失代偿急性期的患者多于其他研究纳入的患者。本研究结果显示,与HFpEF相比,HFimpEF患者更年轻,男性较多,较少合并心房颤动,更可能接受指南推荐的治疗(ARNI、β-受体阻滞剂、醛固酮受体拮抗剂等),与既往研究一致[17-18]。HFrEF组与HFimpEF组年龄、性别并无差别。但基线时HFimpEF患者收缩压更高,LVESD和LVEDD更小,心功能NYHAⅢ/Ⅳ级占比更少,提示HFimpEF的心室重构程度低于HFrEF,与FLOREA等[6]的报道一致。
本研究结果显示,收缩压较高、LVESD较小(≤37 mm)、应用β-受体阻滞剂及醛固酮受体拮抗剂治疗是LVEF恢复的独立预测因子,与前期研究一致[19-20]。神经体液的过度激活和心室重构是HF发生发展的重要病理生理机制,而HF患者LVEF恢复的关键是心室逆重构,表现为衰竭的心室结构和功能向正常改善,使左心室舒张末期压力与容积关系左移[21]。虽然心室逆重构可使LVEF得到改善,但患者仍有可能因HF再次住院,这个状态被称为心肌缓解。在这个过程中,HF的症状和体征可能持续存在,HFimpEF的神经体液因素可能更有利于心室逆重构[16],原因可能与对药物反应性不同和最佳治疗方案有关。β-受体阻滞剂和醛固酮受体拮抗剂通过抑制交感神经和肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的过度激活发挥其抗重构作用,并使HF患者预后得到改善;但HFimpEF神经体液的优势并非持续存在,也依然依赖于后续的治疗。TRED-HF研究观察了停止药物治疗后HFimpEF患者的终点事件发生率,发现在先停药组中11例(44%)患者达到了主要终点,而继续治疗组没有观察到终点事件发生;随后研究者停止了继续治疗组的神经体液阻滞剂,结果有9例(36%)患者达到主要终点[22]。虽然该研究存在诸如单中心、小样本、仅纳入了扩张性心肌病等缺陷,但仍然显示出HFimpEF患者继续治疗的重要性。
随访截止时,HFimpEF组全因死亡率低于HFpEF组、HFrEF组,与既往研究一致[10],但本研究发现HFimpEF组与HFmrEF组全因死亡率并无差异。石芳娥等[23]认为,HFmrEF是HFrEF和HFpEF的中间状态和过渡类型。本研究结果显示,HFimpEF的临床特征及死亡率与HFmrEF更类似,而与HFpEF及HFrEF有较明显的差别,提示HFimpEF更倾向于不稳定的临床表型。然而,HFmrEF仍是目前HF中的“灰色地带”,既往的研究也未将HFimpEF与HFmrEF进行比较,未来需要更多针对HFmrEF与HFimpEF的研究。本研究发现,HFimpEF组全因再住院率低于HFpEF组和HFmrEF组,但与HFrEF无差异,原因可能与HFimpEF患者的左心室重构持续存在有关,与HFpEF和HFmrEF相比,即便部分HFimpEF患者LVEF改善至40%甚至50%以上,但他们的LVEDD和LVESD仍然更大,因此这种HFimpEF与HFrEF形态学上的相似性可能导致了二者再住院率类似;随访时间较短也可能是原因之一,在延长了随访时间后,HFimpEF患者可能会由于症状逐渐改善而减少住院。事实上,已有研究指出HFimpEF患者HF再入院率较低[4]。而上述全因死亡和全因再住院率之间的差异除了死亡和再住院原因的差异外,还可能与竞争风险有关,未来的研究可以对患者的死亡和再入院的原因进行细化分析,并利用竞争风险模型对生存曲线进行校正。
本研究结果显示,合并心脏瓣膜病是HFimpEF死亡的独立风险因素,与ABE等[24]研究结果不同,原因可能与纳入人群不同有关。事实上无论是原发性的心脏瓣膜病导致HF,还是HF时心室重构和功能障碍继发的心脏瓣膜病,均会加重心脏负荷,使HF复杂化,并导致症状和预后恶化[25-27],未来需要进一步的前瞻性研究确定心脏瓣膜病与HFimpEF之间的相关性。此外,贫血仍是HFimpEF全因死亡的独立风险因素,与既往研究结果一致[10]。HF时各种原因导致的造血原料缺乏、促红细胞生成素(erythropoietin,EPO)生成减少或各种炎性因子导致EPO抵抗致患者贫血发生率较高[28],而重度贫血时交感神经和RAAS过度激活,氧解离曲线右移加重患者心脏负担[29]。最近欧洲心脏病学会(European Society of Cardiology,ESC)发布的2021年急慢性心力衰竭诊治指南建议HF患者定期进行贫血和铁缺乏筛查,以早期发现贫血并积极纠正,降低再住院率[30]。
综上所述,本研究的结果支持HFimpEF是一个独立的临床表型,其临床症状较轻,死亡率与HFmrEF类似,优于HFpEF和HFrEF,积极治疗心脏瓣膜疾病及贫血或能改善患者的近期预后,降低死亡率。此外,LVEF的改善对HFrEF的病情评估和治疗有重要意义。基础血压偏高、LVESD≤37 mm、接受β-受体阻滞剂和醛固酮受体拮抗剂治疗的患者更可能发生LVEF恢复。然而,HFimpEF患者神经体液因子、心室重构的变化等病理生理学机制以及在症状稳定后药物能否减量仍需未来大规模的前瞻性研究进一步确定。
本研究不足:
(1)本研究为回顾性研究,虽然制订了相应的纳入、排除标准,但仍可能存在偏倚;(2)本研究为单中心研究,样本量相对较少,且本研究随访时间相对较短,可能未能观察到部分患者终点事件的发生;(3)未对患者出院后的治疗进行动态监测,未来的研究需要动态评估患者的用药,并对神经体液因子进行监测,给出相应的病理生理学解释。
作者贡献:苏康康进行研究设计与实施、资料收集、数据分析、撰写论文、修订文章并对文章负责;王岩、王立立进行研究实施、资料收集、数据分析;陈淑霞、谷剑负责研究评估、质量控制及审校。
本文无利益冲突。

