核壳型磁性纳米复合材料Fe3O4@SiO2@mTiO2@Pt的制备及催化性能*
郑锦丽,葛红光,马书婷,李宗林,郭少波,史 娟,欧 婷
(陕西理工大学 化学与环境科学学院,陕西 汉中 723000)
0 引 言
贵金属包括金(Au)、银(Ag)及铂(Pt)等8种金属元素[1],因具有较强的自由度,易配位成键而具有催化加氢活性[2]。其中,贵金属Pt是一种典型的室温催化材料,原子d轨道有9个电子,有强的配位吸附性和脱附性[3-4]而具备优越的催化性能。Pt的催化活性与粒径有关,通常粒径越小,表面能越大,活性位点越多其催化性能越强,但表面能越大Pt颗粒越易团聚从而降低其催化活性,且回收困难、成本高昂等缺点使其应用受到限制[5-7]。
目前,大多数研究者为克服以上缺点,将Pt纳米颗粒负载在基体材料或载体上制备核壳型结构提高其催化活性。钟珊等[8]采用硼氢化钠还原法制备了光催化材料Pt/TiO2,以甲基橙为目标降解物,在可见光下,20 min时降解率达50.00%左右,100 min时约为96.00%;康莉等[9]制备了Pt/TiO2-Al2O3催化剂,在室温下,对甲醛去除率达98.30%以上,连续反应150 h后催化剂仍具有良好的催化活性;刘敬华等[10]合成K-Pt/TiO2催化剂,当Pt颗粒尺寸约为2.4 nm,且K负载量(质量分数)为0.30%时催化剂表现出最佳的催化性能;李曙光等[11]制备了Pt掺杂TiO2/粉煤灰漂珠复合材料,以亚甲基蓝为目标污染物研究催化活性,结果表明,180 min对浓度20 mg/L亚甲基蓝溶液的降解率达94.10%。以上复合材料中均表明Pt粒径越小催化性能越强,但目前制备小于2 nm的Pt颗粒未见报道。
铁、钴、镍及化合物[12]是磁性材料的来源,其中Fe3O4俗称氧化铁黑,因固有的超顺磁性[13]常常作为磁性材料的载体。戴郑宵等[14]制备了Fe3O4/TiO2复合材料催化剂,在紫外光和可见光下降解罗丹明B(Rh B),紫外光照射下,60 min内对Rh B降解率约98.00%;可见光下,120 min内对Rh B降解率约98.00%左右,但Fe3O4与TiO2直接作用会发生电子空穴对复合和光溶解现象[15]。SiO2由于其化学和热稳定性而作为绝缘层来阻断Fe3O4与TiO2间的电子空穴对复合,阻止电荷从TiO2壳层向Fe3O4转移以及防止Fe3O4被氧化[16-18]。Geonmin等[19]制备Fe3O4@SiO2-Pt/Ni@TiO2催化剂,对硼氢化钠催化水解产生氢气的转化率达99.00%;Cui等[20]合成具核壳结构的多相催化剂Fe3O4@SiO2@Pt-TiO2,紫外可见光照射30 min后,2 g/L的催化剂对acid orange脱色达93.00%。以上复合材料在外加磁场作用下可以克服回收困难、成本高等[21-22]难题,但吸附亲核和亲电介质较少,且贵金属Pt粒径较大,催化效率一般。基于以上磁性纳米复合材料特性,我们将进一步对TiO2进行表面修饰,制成多孔体系,为有机染料和还原剂提供更多的吸附位点,其次制备约1 nm Pt纳米粒子均匀负载在其表面增强催化活性。
本文采用逐层沉积法制备核壳型磁性纳米复合材料Fe3O4@SiO2@mTiO2@Pt催化剂,以Fe3O4为核,在其表面依次包覆SiO2、TiO2,通过水热法将其介孔化,在氨基作用下吸附Pt4+。采用乙二醇的多羟基还原性,将贵金属Pt原位还原负载在Fe3O4@SiO2@mTiO2表面,通过TEM、XRD、UV-Vis、VSM、XPS等进行表征,以4-Np和罗丹明6G为目标污染物研究其催化活性。该催化剂为降解有机污染物提供一定的参考价值,同时为制备贵金属负载磁性功能化材料催化剂提供一定的新思路。
1 实 验
1.1 试剂与仪器
1.1.1 实验试剂
聚(4-苯乙烯磺酸-共聚-马来酸)钠盐(C12H10NaO3,上海源叶生物科技有限公司);正硅酸乙酯(C8H20O4Si,AR,天津市大茂化学试剂厂);乙二醇(C2H6O2,AR,天津市天力化学试剂有限公司);无水乙醇(C2H6O,AR,天津市天力化学试剂有限公司);氨水(NH3·H2O,AR,西陇科学股份有限公司);3-氨丙基三甲氧基硅烷(C6H17NSi,AR,天津市百世化工有限公司);异丙醇(C3H8O,AR,天津市天力化学试剂有限公司);柠檬酸钠(C6H5O7Na3·2H2O,AR,天津市天力化学试剂有限公司);氯铂酸(H2PtCl6·6H2O,纯度≥99.90%,江苏金沃新材料有限公司);对硝基苯酚(C6H5NO3,AR,天津市光复精细化工研究所);罗丹明6G(C28H31ClN2O3,纯度≥98.50%,山东西亚化学股份有限公司);去离子水(H2O,实验室自制)
1.1.2 实验仪器
透射电子显微镜(TEM),JEM-2100F 型,日本日立公司;X射线粉末衍射仪(XRD),D8 ADVANCE 型,德国布鲁克;紫外可见分光光度计(UV-Vis),UV-6100S 型,上海元析仪器有限公司;振动样品磁强计(VSM),HG-500 型,美国 KJS 公司;X射线光电子能谱分析仪(XPS),PHI 5000 C型,Perkin Elmer 公司;三频数控超声波清洗器,KQ-700VDE 型,昆山市超声仪器有限公司;磁力搅拌器,MYP11-2 型,上海梅颖浦仪器仪表制造有限公司。
1.2 催化剂的制备
1.2.1 Fe3O4的制备
采用溶剂热法制备磁性Fe3O4粒子。准确称取2 g马来酸溶于80 mL乙二醇中超声均匀后,加入2.16 g FeCl3·6H2O、6 g NaAc超声分散1 h,将其移入反应釜中,200 ℃下反应10 h自然冷却至室温。用去离子水、乙醇依次清洗获得的红棕色粉体,随后放入烘箱60 ℃烘干备用。
1.2.2 Fe3O4@SiO2的制备
通过Stöber法制备Fe3O4@SiO2。准确称取150 mg Fe3O4加入到由15 mL H2O、45 mL乙醇及0.6 mL氨水(质量分数为20%~28%)混合的溶液中超声分散30 min,滴加0.45 mL正硅酸乙酯(TEOS)到以上的混合溶液中,室温下磁力搅拌反应2 h,将获得的粉体用去离子水、乙醇依次清洗放入烘箱60 ℃烘干备用。
1.2.3 Fe3O4@SiO2@mTiO2的制备
通过钛酸四丁酯水解在Fe3O4@SiO2表面包覆一层TiO2获得Fe3O4@SiO2@TiO2。准确称取其140 mg于锥形瓶中,加入20 mL H2O、40 mL乙醇、0.5 mL氨水超声分散均匀,将其混合液移入反应釜,160 ℃下反应10 h后自然冷却至室温下分离,随后移入烘箱烘干,获得Fe3O4@SiO2@mTiO2。称取上述产物120 mg溶于90 mL异丙醇中超声均匀,加入1.2 mL H2O、1.2 mL氨水超声5 min,再滴加0.3 mL 3-氨丙基三甲氧基硅烷超声均匀,在82 ℃、1 000 r/min下回流反应12 h,用去离子水、乙醇依次清洗后放入烘箱中60 ℃下烘干,得到氨基功能化的Fe3O4@SiO2@mTiO2。
1.2.4 Fe3O4@SiO2@mTiO2@Pt的制备
准确称取110 mg氨基功能化的Fe3O4@SiO2@mTiO2于70 mL乙二醇中超声分散,加入2.75 mL 0.02 mol/mL氯铂酸超声10 min后,160 ℃、1 000 r/min下回流反应30 min,用去离子水、乙醇依次清洗后移入烧杯,放入烘箱烘干,即可获得Fe3O4@SiO2@mTiO2@Pt,制备过程如图1所示。
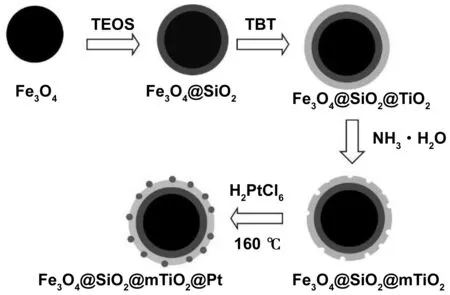
图1 Fe3O4@SiO2@mTiO2@Pt的制备过程
1.3 催化剂的表征
透射电子显微镜(TEM)对样品进行形貌观察与分析;X射线粉末衍射仪(XRD)对样品的晶型结构进行检测;紫外可见分光光度计(UV-Vis)测试样品紫外可见吸收峰;振动样品磁强计(VSM)对样品进行磁性测试;X射线光电子能谱分析仪(XPS)分析样品表面存在的元素和价态。
1.4 催化性能测试
分别配制5.00×10-4g/mL Fe3O4@SiO2@mTiO2和Fe3O4@SiO2@mTiO2@Pt,0.25 mmol/L 4-NP、1.00 mmol/L罗丹明6G、0.01 mol/L硼氢化钠(NaBH4)。以NaBH4为还原剂,通过紫外可见分光光度计分别测定4-NP和罗丹明6G的吸光度,研究催化剂催化活性。依据催化反应完成后4-NP和罗丹明6G在最大吸收波长处(4-NP:404 nm;罗丹明6G:523 nm)的吸光度来计算产物的催化效率。计算公式如下:
式中,R为催化剂的降解率,%;C0为催化反应前溶液中4-NP和罗丹明6G的浓度,mol/L;C为催化反应后溶液中4-NP和罗丹明6G的浓度,mol/L;A0为催化反应前所测得的4-NP和罗丹明6G在最大吸收波长处的吸收值,Absorbance Unit(a. u.);A为催化反应后所测得的4-NP和罗丹明6G在最大吸收波长处的吸收值(a. u.)。
2 结果与讨论
2.1 Fe3O4@SiO2@mTiO2@Pt复合材料的表征
2.1.1 TEM分析
利用TEM对所制备的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@mTiO2以及Fe3O4@SiO2@mTiO2@Pt进行微观形貌结构表征,结果如图2所示。由图2(a-e)可知,所有获得的样品微观形貌近似为球形。图2(a)可知Fe3O4粒子表面粗糙,粒径较为均匀,大约在150 nm左右;图2(b)可知为单分散的Fe3O4@SiO2,具有明显的双层核壳结构,颗粒表面较为光滑,粒径大约为160 nm,SiO2包覆层厚度为5 nm;图2(c)中Fe3O4@SiO2@TiO2表面光滑,粒径大约为228 nm,TiO2包覆层厚度为34 nm;图2(d)中Fe3O4@SiO2@mTiO2表面粗糙,粒径约为200 nm,TiO2包覆层厚度减小14 nm;图2(e)中明显观察到大量较小的黑色颗粒,这是负载在Fe3O4@SiO2@mTiO2表面和内部的Pt纳米粒子,粒径大约在1 nm左右。通过溶剂热法制备单分散的磁性Fe3O4粒子,以磁性Fe3O4粒子为核,采用Stöber法将SiO2包覆在Fe3O4颗粒表面形成Fe3O4@SiO2核壳结构,因SiO2层具亲水性且分散性良好,可采用TBT水解法与SiO2层表面的-OH结合进而包覆TiO2层使颗粒更加稳定且易于修饰,采用水热法将其介孔化后通过APTES在其表面修饰,因具有氨基而对贵金属有强的吸附性,可将Pt4+吸附在周围,采用乙二醇的多羟基还原性,将贵金属Pt4+原位还原成Pt纳米粒子负载在Fe3O4@SiO2@mTiO2表面使Pt纳米粒子能够均匀稳定存在。

图2 不同样品的TEM照片
2.1.2 XRD分析
利用XRD对Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@mTiO2及Fe3O4@SiO2@mTiO2@Pt进行晶型分析,结果如图3所示。由图3可知,衍射峰出现在2θ=30.1°、35.4°、53.6°、56.9°和62.8°分别对应立方尖晶石Fe3O4的特征(112)、(121)、(004)、(231)和(400)晶格面(JCPDF NO.75-1609)[23],没有其它杂峰,表明制得的样品为纯相Fe3O4。与Fe3O4相比,Fe3O4@SiO2和Fe3O4@SiO2@mTiO2的各衍射峰与其大体一致,峰强度稍微有所增加,其归因于TiO2层掺杂引起Fe3O4位面的择优生长所致[24]。另外,Fe3O4@SiO2@mTiO2@Pt的各衍射峰中,除了可观察到Fe3O4的衍射峰外,在2θ=39.8°处出现微弱衍射峰,其对应面心立方Pt(111)晶面,未出现其他Pt位面,其可能源于所制备的Pt纳米粒子粒径太小,超出其检测范围[25-26],同时结合TEM分析,证实复合材料中存在面心立方型Pt纳米粒子。
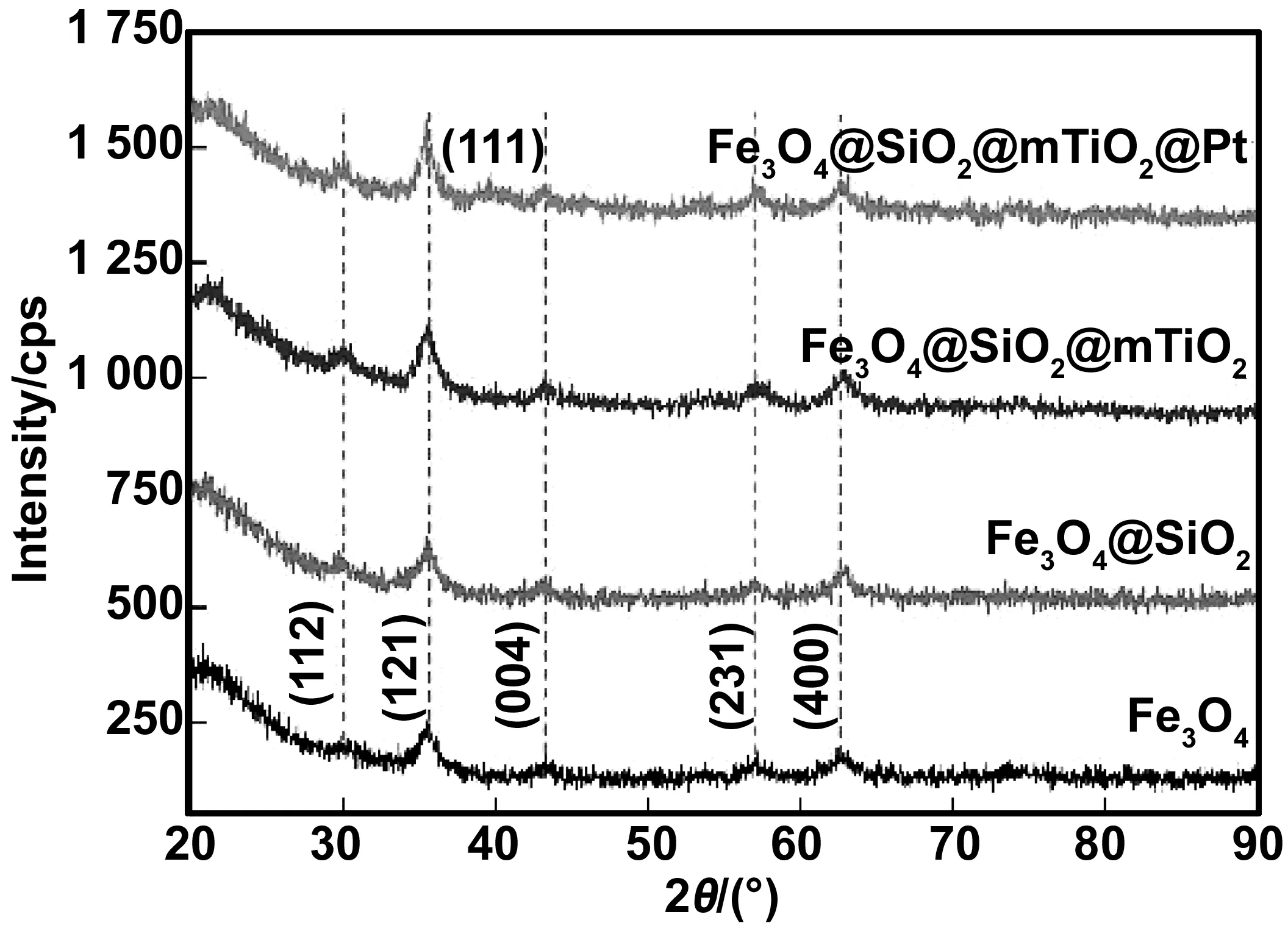
图3 不同样品的XRD图谱
2.1.3 UV-Vis分析
利用UV-Vis对Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@mTiO2及Fe3O4@SiO2@mTiO2@Pt的紫外可见吸收峰进行测试,结果如图4所示。从图4中观察到Fe3O4在可见光区域没有出现吸收峰,同样Fe3O4@SiO2、Fe3O4@SiO2@mTiO2在可见光区域都未出现吸收峰,而Fe3O4@SiO2@mTiO2@Pt在400~500 nm处出现较宽的吸收峰,其由于表面的Pt发生等离子体共振,电子转移而出现红移,在可见光区域出现峰型展宽现象[27],与TEM和XRD分析结果一致,进一步说明单质Pt纳米粒子成功负载在Fe3O4@SiO2@mTiO2表面。

图4 不同样品的紫外吸收图谱
2.1.4 VSM分析
利用VSM对Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@mTiO2及Fe3O4@SiO2@mTiO2@Pt在常温下进行饱和磁强度分析,结果如图5所示。从图5中我们可以得到:Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@mTiO2和Fe3O4@SiO2@mTiO2@Pt的MS值分别约为64.8、57.6、46.2、51.5和44.8 A·m2/kg。相较于Fe3O4,Fe3O4@SiO2、Fe3O4@SiO2@TiO2磁饱和强度均有所降低,其原因为SiO2、TiO2没有磁性,其依次包覆在Fe3O4表面而稀释了Fe3O4的磁性,导致复合材料的MS和矫顽力值降低。应注意的是,与Fe3O4@SiO2@TiO2相比,Fe3O4@SiO2@mTiO2的MS值相对有所增加,其归因于水热法使Fe3O4@SiO2@TiO2表面介孔化,赋予TiO2层更多的孔,使其厚度部分有所减小导致,这与TEM图中观察到其表面粗糙且粒径厚度降低相一致;Fe3O4@SiO2@mTiO2@Pt的MS值为44.8 A·m2/kg,同样有所下降,但M-H曲线可以看出纳米复合材料仍然具有很高的磁饱和强度。另外,在磁化曲线中几乎没有观察到磁滞回线,这说明核壳型Fe3O4@SiO2@mTiO2@Pt复合材料具有高磁化强度。
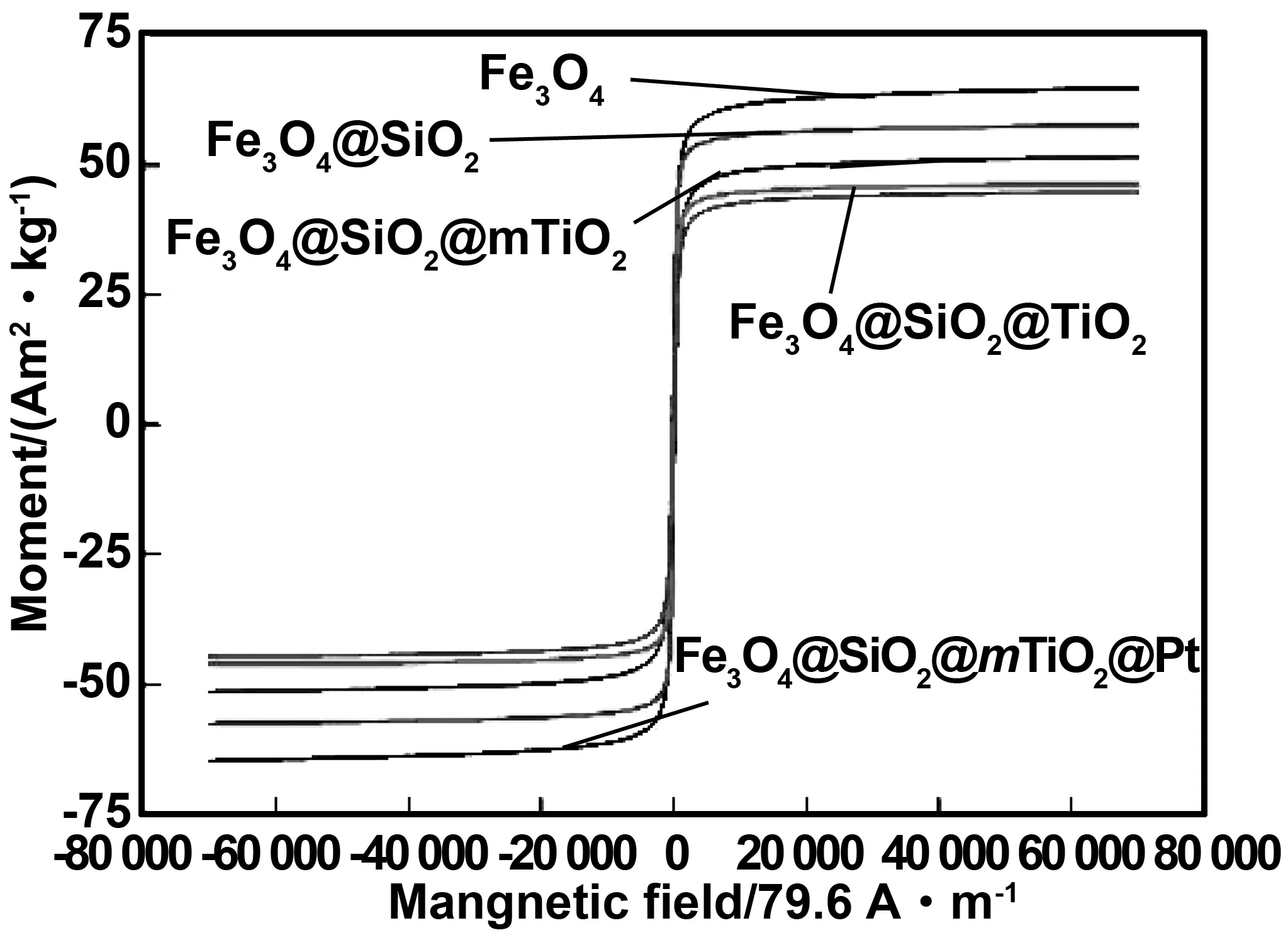
图5 不同样品的磁化曲线
2.1.5 XPS分析
为了进一步研究Fe3O4@SiO2@mTiO2@Pt的表面元素组成及价态,采用XPS对其进行表面化学分析,结果如图6所示。从图6(B)数据可知,表面元素组成为O(31.03%)、C(50.36%)、Ti(5.58%)、Si(7.81%)、N(4.37%)、Pt(0.85%),说明催化剂表面存在O、C、Ti、Si、N和Pt元素。由图6可知,Fe3O4@SiO2@mTiO2@Pt中铁、氧、氮、碳、硅和铂元素的峰值,Fe 2p的峰为723.13和709.13 eV,O 1s 和N 1s结合能分别为530.43、399.79 eV,Si 2p的结合能为100.92 eV,C 1s的结合能为284.12 eV,Pt 4f的峰分别为71.99和75.05 eV。为了分析催化剂的价态,图6(a)中Fe 2p峰结合能分别为723.13和709.13 eV,分别对应Fe(2p 1/2)和Fe(2p 3/2),证实了Fe2+、Fe3+的存在。图6(b)中O 1s的结合能为530.43 eV,对应于TiO2晶格中的Ti-O基团[28]。N1s核能级分别集中在398.3 eV(—N)、399.2 eV(—NH—)和400.3 eV(—N+—)上[4],图6(c)中N1s结合能为399.79 eV,源于3-氨丙基三甲氧基硅烷的表面修饰。图6(d)中C 1s的结合能为284.12 eV,源于样品表面吸附碳链所致。图6(e)中Si 2p的结合能为100.92 eV,进一步证实SiO2的存在。图6(f)中Pt 4f光谱证实了Pt(0)的存在,Pt 4f结合能分别为71.99和75.05 eV,其归属于Pt04f7/2和Pt04f5/2,说明复合材料中Pt以单质形式存在[29]。经以上分析,复合材料Fe3O4@SiO2@mTiO2@Pt中Fe为Fe2+、Fe3+,Si为Si4+,Pt为Pt0。

图6 样品的XPS图谱
2.2 Fe3O4@SiO2@mTiO2@Pt催化性能测试
为研究样品Fe3O4@SiO2@mTiO2@Pt的催化活性,以有机染料4-NP和罗丹明6G为目标污染物研究其催化活性,结果如图7所示。图7(a)、(d)分别为不添加催化剂时4-NP和罗丹明6G的降解;图7(b)、(e)为Fe3O4@SiO2@mTiO2对4-NP和罗丹明6G的降解;图7(c)、(f)为Fe3O4@SiO2@mTiO2@Pt催化剂对4-NP和罗丹明6G的降解。从图7(a)、(d)和(b)、(e)可以看出:随着时间的推移,其在60 min内基本不发生降解,排除了4-NP和罗丹明6G在以硼氢化钠为介质的加氢还原催化降解和Fe3O4@SiO2@mTiO2对4-NP和罗丹明4-NP 6G的催化降解。相同条件下,加入Fe3O4@SiO2@mTiO2@Pt后,如图7(c)(f)Fe3O4@SiO2@mTiO2@Pt对4-NP和罗丹明6G的降解,具体用量如表1。图7(c)明显观察到加入Fe3O4@SiO2@mTiO2@Pt催化剂后,4-NP在20 min内基本降平,催化效率达99.50%,而图7(f)中观察到加入Fe3O4@SiO2@mTiO2@Pt催化剂后,罗丹明6G在30 min内几乎降解完全,降解率达99.00%左右,其均符合郎伯比尔定律,A=lg(1/T)=Kbc,其中A为吸光度,T为透射比(投射光强度/入射光强度),c为吸光物质的浓度,b为吸收层厚度。以有机染料4-NP和罗丹明6G研究Fe3O4@SiO2@mTiO2@Pt催化剂的催化机制,其可能为[30]:Pt在还原介质中的电子转移率决定催化剂的催化性能,而电子转移率是由Pt粒子表面对亲核试剂硼氢化钠和染料吸附的浓度所致,浓度越大催化效果越好。通常,催化剂粒径越小,比表面积越大活性位点就越多,吸附性能越强,电子转移率越高,其催化活性就越高。但催化剂粒径太小易于团聚,表面活性位点减少从而降低催化效率,而Fe3O4@SiO2@mTiO2@Pt催化剂,Pt纳米粒子负载在Fe3O4@SiO2@mTiO2表面增加其稳定性,其中mTiO2提供丰富的吸附位点,使Pt纳米颗粒均匀而分散的负载在Fe3O4@SiO2@mTiO2表面,正如TEM图2(e)中所观察的,Pt纳米颗粒较小,粒径约为1 nm的单分散球型结构,比其他粒径较大的Pt粒子具有更大的比表面积,利于输送电子,介孔状的TiO2易于吸附亲核试剂和亲电试剂,Pt纳米粒子周围环境具备高浓度试剂易于Pt与BH4-中H-结合形成过渡态Pt-H,过渡态Pt-H分别与4-NP中N=O键和罗丹明6G中C=N键发生加氢还原释放出单质Pt,因此Pt作为电子转移基体从BH4-转移到4-NP中N=O键和罗丹明6G中C=N键而具备加氢催化活性。此结果说明Fe3O4@SiO2@mTiO2@Pt对有机染料4-NP和罗丹明6G有强的吸附性和加氢还原性,把Pt粒子负载在Fe3O4@SiO2@mTiO2表面既解决了Pt纳米颗粒团聚的问题,又可以增加Pt催化降解的活性位点而提高催化活性,同时克服其难以回收利用的问题。
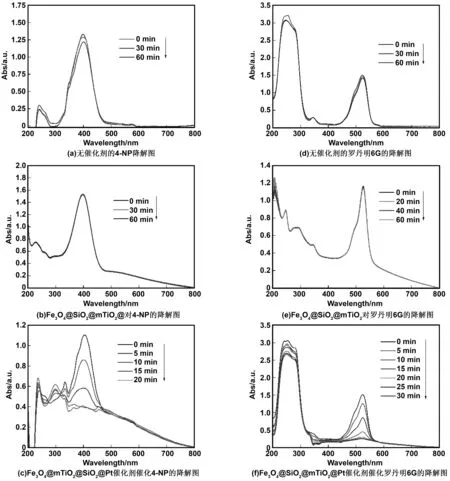
图7 样品对4-NP和罗丹明6G的催化活性研究
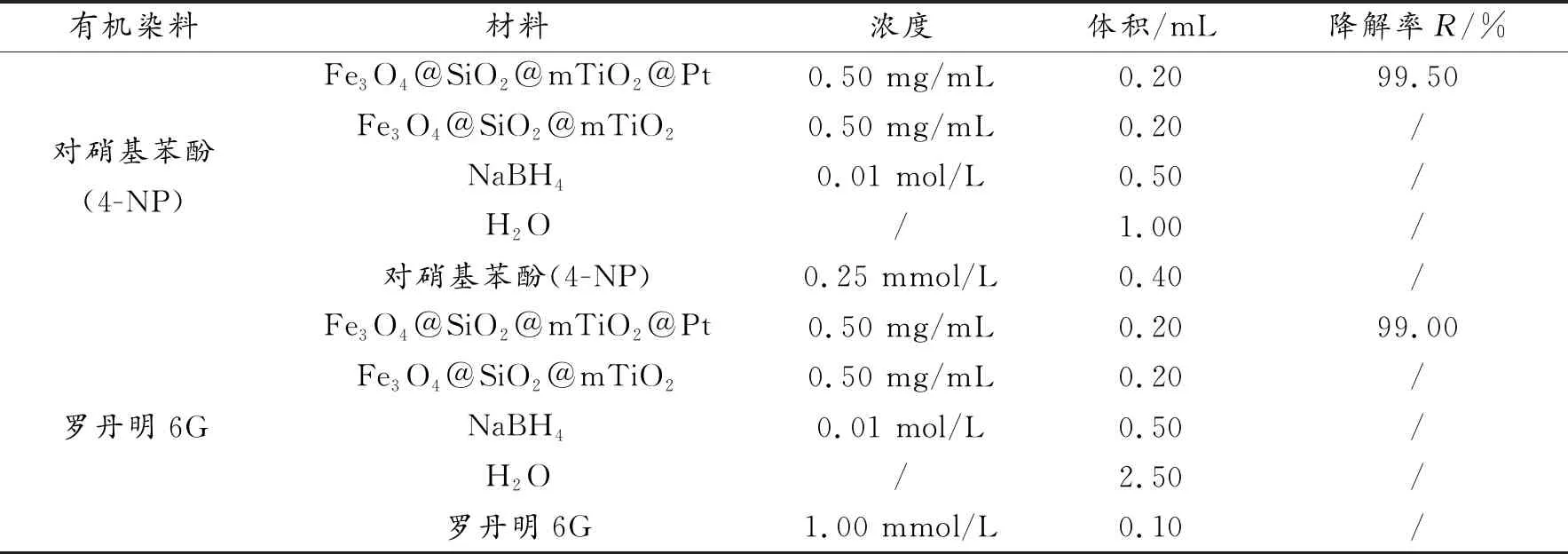
表1 实验所用材料、剂量及对不同染料的催化效率
3 结 论
(1)采用逐层沉积法,以Fe3O4为核在其表面包覆SiO2、TiO2,采用水热法将其表面修饰成介孔化,吸附大量Pt粒子且不易脱落,制备绿色安全,催化活性优越的催化剂。
(2)通过TEM、XRD、UV-Vis、VSM、XPS等表征催化剂,证实已成功合成Fe3O4@SiO2@mTiO2@Pt催化剂,其粒径越小,活性位点越多,催化性能越强。
(3)以有机染料4-NP和罗丹明6G为目标污染物,采用UV-Vis对其进行催化活性研究,结果表明,20 min内,4-NP的降解率达99.50%,30 min内,罗丹明6G的降解率达99.00%,且能克服回收困难,为降解有机染料提供参考价值,同时为制备贵金属负载型催化剂提供一定的理论基础。

