基于COSMO-RS的离子液体吸收CO的溶剂筛选及H2/CO分离实验
霍猛,彭晓婉,赵金,马秋伟,邓春,刘蓓,陈光进
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
引 言
氢能源被视为21 世纪最具发展潜力的清洁能源之一,目前,氢气广泛应用在加氢裂化[1]、柴油加氢[2]、汽油加氢[3]、航煤加氢[4]、苯加氢[5]等工艺中。此外,高纯度氢气作为燃料电池[6]的重要原料,具有广阔的应用前景。目前,天然气蒸汽重整[7]及水汽变换[8](water-gas shift,WGS)反应是工业上大规模制备氢气的主要方法。通过WGS 反应制得的氢气在经过变换处理后会残余约1%(mol)的一氧化碳,需要进一步分离纯化才能进行下游的应用。CO 作为碳一化工的重要原料,吸收CO 既可以除去对环境有危害的气体,也可以增加经济效益。因此,发展更经济的、环境友好的方法,在温和条件下吸收CO 以制备高纯度H2是氢能源发展的迫切需求。
目前CO 的分离方式主要有以下几种:深冷分离法[9]、变压吸附法[10]、络合溶液吸收法[11]、膜分离法[12]、离子液体吸收法[13]等。其中,深冷分离法成本较大,只适用于大规模生产,并且由于在低温下操作,需要对原料气进行预处理以防止管道堵塞;变压吸附法操作复杂,产品回收率低;络合溶液吸收法会产生氯化氢、甲苯等对环境有危害的气体,腐蚀设备,有安全隐患。
离子液体是由有机阳离子和无机阴离子组成的盐,在室温下通常为液体。离子液体由于具有极低的蒸气压、稳定性良好、不易燃、结构可设计和较宽的液体温度范围等优点,使得离子液体作为吸收溶剂时,不但能避免以往使用有机溶剂时对环境造成污染,还能循环使用,因此离子液体是一种用于吸收CO十分有潜力的溶剂。
Ohlin 等[14]发现,随着离子液体阴阳离子尺寸的增加,CO 的物理溶解度也会随之增大。Peters 等[15]发现CO 在离子液体中的溶解度随CO 分压的升高而增加,升高温度会降低CO 的物理溶解度。此外,Lei 等[16]通过向1-丁基-3-甲基咪唑四氟硼酸盐([Bmim][BF4])中添加沸石咪唑酯骨架结构材料以提高CO 的溶解度,CO 溶解度可提高7 倍左右。Tao等[17]设计了具有碳负阴离子的功能化离子液体用于吸收CO,其吸收容量相比于常规离子液体1-丁基-3-甲基咪唑双亚胺盐([Bmim][Tf2N])可提高约37倍。质子型离子液体中含有自由质子并且存在氢键作用力[18],氢键可以增强离子液体阴阳离子与气体的相互作用从而提高吸收效果[19]。Bernardino等[20]通过傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)发现离子液体的阴阳离子存在相互作用力。Li 等[21]使用FTIR 分析六元氮杂环类质子型离子液体吸收氨的机理,证明质子型离子液体与NH3形成了氢键作用,又通过对比核磁氢谱位移变化,证明了质子氢与羟基可以与NH3形成氢键,从而增强吸收效果。由于CO 与亚铜离子(Cu+)存在可逆络合反应[22-23],并且离子液体具有较强的溶解Cu+的能力,因此Tao 等[24]将醋酸亚铜与1-乙基咪唑醋酸盐([EimH][OAc])混合制备了铜基复合离子液体,该溶剂对CO/N2的选择性可达到967。刘玉梅[25]研究了1-乙基咪唑亚铜氯盐([EimH][CuCl2])离子液体,其吸收容量相比于[Bmim][Tf2N]提高了约60 倍。通过FTIR 分析和密度泛函理论计算发现,[EimH][CuCl2]能够形成氢键网络强化CO 与Cu+的相互作用,进而提高CO 的吸收性能。Cui 等[26]将2-二乙氨基乙醇亚铜氯盐([HDEEA][CuCl2])与乙二醇混合制成混合溶剂用于吸收CO,结果表明羟基基团可以提高Cu+的活性,进而提升CO吸收效果。
然而,离子液体由于阴阳离子种类繁多且可以随意组合,这就导致设计者需要从数量繁多的离子液体种类库中进行筛选以得到符合要求的离子液体,使用实验方法筛选会消耗大量的人力物力和时间,因此使用可靠的热力学模型筛选离子液体是一种高效且经济的方法[27]。真实溶剂的类导体筛选模型 (conductor-like screening model for realistic solvents,COSMO-RS)具有不依赖实验数据、不受化合物类型和种类限制,快速预测任意条件下的物质热力学性质的优势。因此,本研究将使用COSMORS以离子液体对CO 的选择性和离子液体黏度为筛选指标对离子液体进行筛选,分析离子液体阴阳离子结构对CO 选择性的影响。随后,在实验室制备离子液体,测定离子液体的黏度,分析离子液体的官能团组成,测定CO、H2在离子液体中的溶解度曲线,考察操作条件对CO/H2混合气体的分离能力的影响,最后对溶剂进行循环性测试。
1 材料与方法
1.1 溶剂筛选方法
1.1.1 COSMO-RS 计算方法与步骤 COSMO 模型最早由Klamt 等[28]提出,在此模型基础上,将导体边界视为无限,使该模型适用于真实溶剂体系,由此得到COSMO-RS 模型,COSMO-RS[29]通过量子力学方法来表征分子间的相互作用,使用统计热力学方法对分子间作用力进行计算来描述多元体系的相平衡,进而能够预测活度系数、黏度、密度等热力学性质。COSMO-RS 的溶剂筛选步骤如图1所示。在计算过程中,COSMO-RS 将分子表面分解成若干个表面积相等的片段,计算时使用具有漫反射基函数的TZVPD 基组和一种新型的分子表面空腔结构,该结构COSMO表面上的片段比标准COSMO空腔表面更规整、分布更均匀。COSMOthermX19软件的参数集还结合了HB2012 氢键项和基于Grimme 等[30]的D3方法的新型范德华色散项,该计算方法弥补了以往COSMO-RS 由于氢键项不准确导致的热力学性质预测误差的缺陷。屏蔽电荷密度σ在片段上的分布函数被称为σ-profile,这些信息被储存在COSMO文件中。通过σ-profile 可以得到物质x的化学势,从而可以计算多元体系中的各种热力学性质,例如xi在溶剂中的活度系数γxi
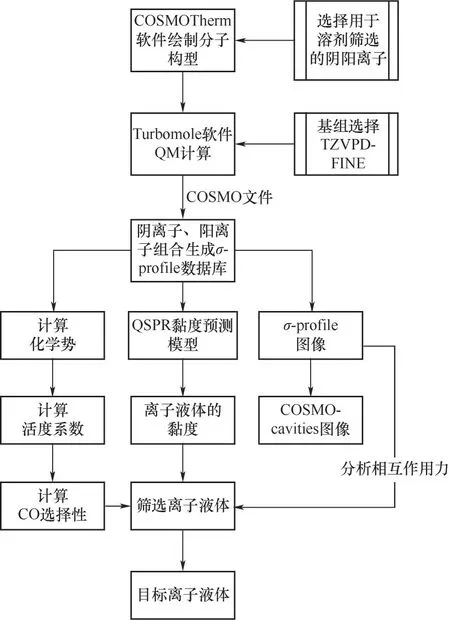
图1 COSMO-RS溶剂筛选步骤Fig.1 Solvent screening steps of COSMO-RS
s,如式(1)所示:

1.1.2 准确性验证 为了验证COSMO-RS 模型预测CO/H2体系的准确性,选取已有的文献数据在相同温度、压力条件下与预测值进行对比,图2 为313.2 K 下CO 与H2在1-辛基-3-甲基咪唑双亚胺盐([Omim][Tf2N])中的实验[31]和模拟溶解度对比结果,气体在溶剂中的溶解度以摩尔分数x表示。其中,CO 溶解度最大相对误差为13.13%,最小相对误差为1.74%,平均相对误差为6.11%;H2溶解度最大相对误差为10.83%,最小相对误差为0.35%,平均相对误差为3.24%。由于COSMO-RS作为定性和半定量工具从离子液体库中进行溶剂筛选,其结果仅用于排序,此相对误差在允许范围内,故该模型预测CO/H2体系进行离子液体溶剂筛选是可行的。
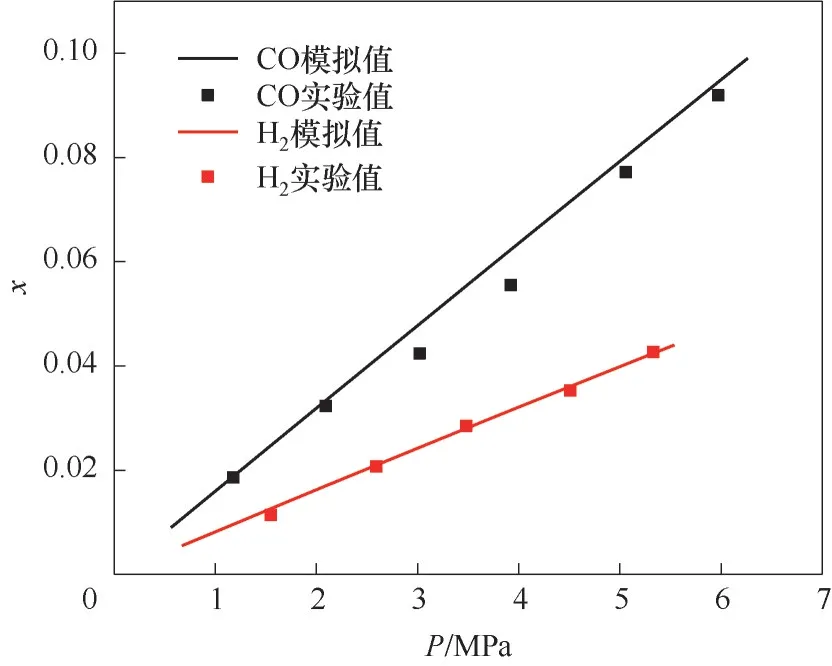
图2 313.2 K下CO与H2在[Omim][Tf2N]中的实验和模拟溶解度对比结果Fig.2 Comparison of experimental and simulated solubility of CO and H2 in [Omim][Tf2N] at 313.2 K
1.2 实验材料与方法
1.2.1 材料与仪器 实验所用材料如表1所示。实验通过BRUKER TENSOR Ⅱ傅里叶转换红外光谱仪表征离子液体的结构,全部原料气、平衡气组成均通过安捷伦 HP 7890 型气相色谱仪进行组成分析,离子液体黏度由NDJ-8S 液显旋转黏度计测定,离子液体含水量使用ZKF-1 型全自动卡尔费休水分测定仪测定。 用于COSMO-RS 计算的COSMOthermX19 软件购买自北京泰科博思科技有限公司。
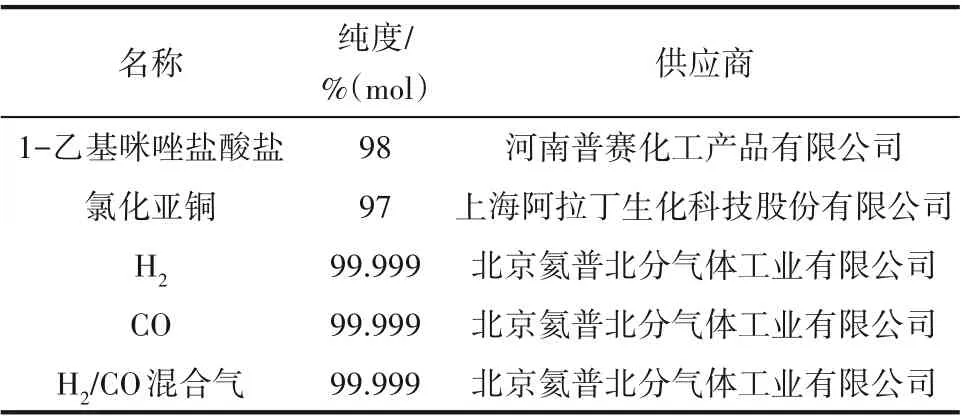
表1 材料名称、纯度和供应商Table 1 Material name, purity and supplier
1.2.2 离子液体的制备 质子型离子液体[EimH][CuCl2]合成方法简便,只需将等摩尔的Brønsted 酸和Brønsted 碱通过简单的机械搅拌即可制备。首先称取13.53g 的1-乙基咪唑盐酸盐([EimH]Cl)和10.2g的氯化亚铜(CuCl),使用磁力搅拌装置在室温下搅拌2 h,再放置到真空干燥箱内,在333.15 K 条件下真空干燥24 h 以上,其目的是为了除去离子液体在合成过程中从空气中吸收的水分,最后使用卡尔费休水分测定仪测定离子液体中的水含量。实验所用离子液体水含量均在1%(mol)以下。
1.2.3 相平衡实验 CO/H2相平衡实验在本课题组搭建的高压蓝宝石釜装置中进行,实验装置介绍以及操作步骤详见文献[32]。其中一些关键评价参数计算公式如下。
溶解度系数Sc和表观溶解度Sv,二者是溶剂对气体分离选择性能的重要参数,计算公式如下:


式中,VL是平衡后宝石釜液相体积;PE为宝石釜中平衡压力;ni表示物质i在溶剂中的物质的量;yi表示物质i在气相中的摩尔分数。
分离因子β是衡量吸收过程离子液体对CO 的选择性的参数,其定义为:
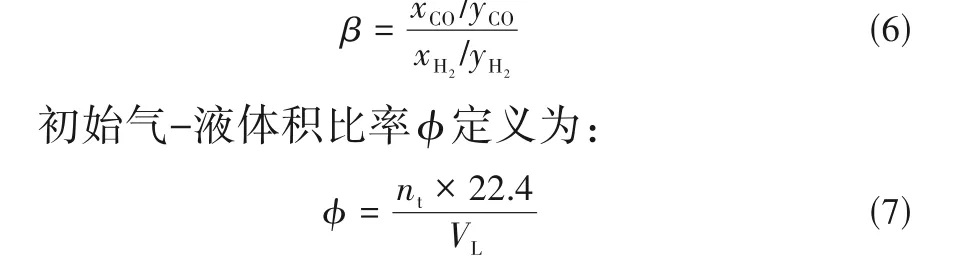
式中,nt为从盲釜中进到蓝宝石釜中的混合气总物质的量。
2 结果与讨论
2.1 离子液体溶剂筛选
2.1.1 COSMO-RS 预测CO/H2在离子液体中的选择性 以293.15 K、无限稀释状态下离子液体对CO 的选择性为筛选指标,从25 种阳离子、14 种阴离子两两组合而成的350 种离子液体种类库中进行筛选。为了更直观表示离子液体种类和选择性的关系,将结果绘制为热点图,如图3所示,图中横坐标为阴离子,纵坐标为阳离子,每个格子代表由横纵坐标所组成的离子液体种类,格子颜色代表该离子液体对CO的选择性大小,选择性越大,颜色越接近深红色;选择性越小,颜色越接近深蓝色。
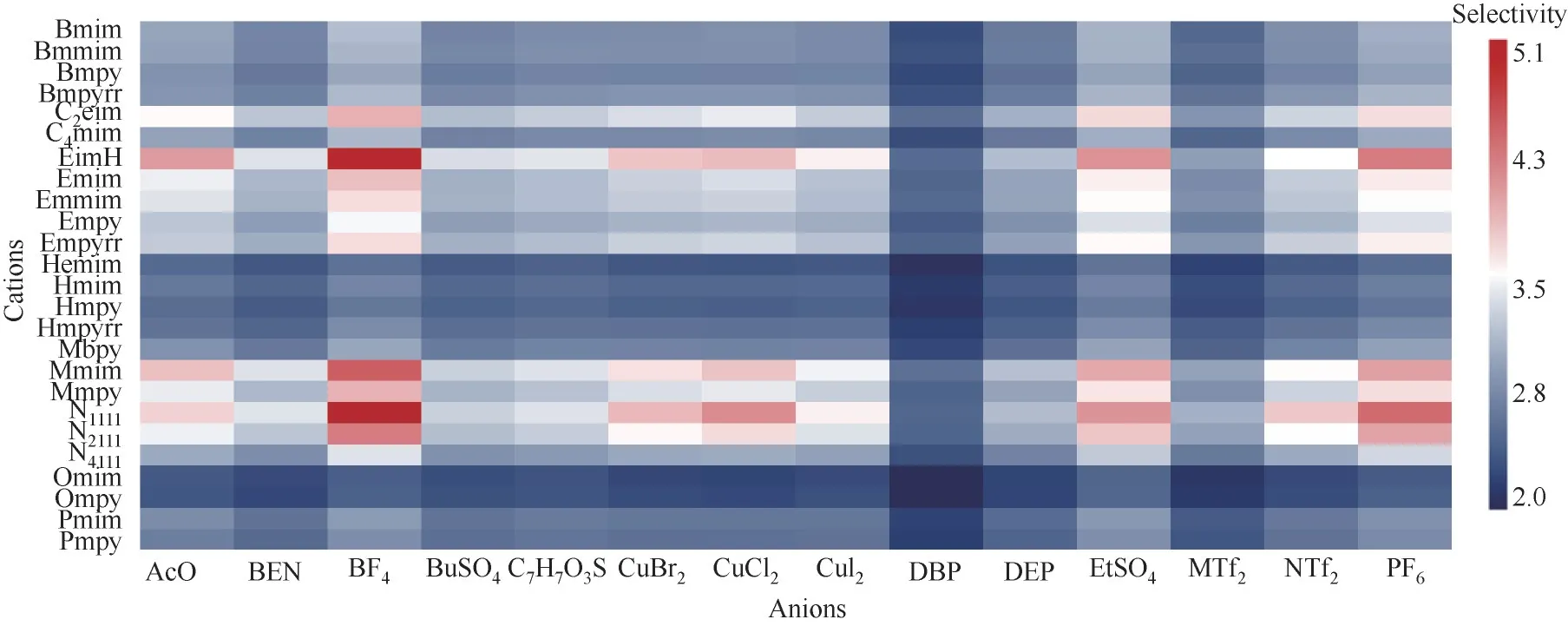
图3 293.15 K下CO/H2在离子液体中选择性的预测结果Fig.3 COSMO-RS predicted results of CO/H2 selectivity in ILs at 293.15 K
从图3 中可以看到,阳离子中[EimH]、[Mmim]、[N1111]、[N2111]的选择性较强;阴离子中[AcO]、[BF4]、[CuCl2]、[EtSO4]、[PF6]的选择性较强。为了研究阴阳离子结构对选择性的影响,通过对COSMO-RS 计算得到的σ-profile 图像进行分析来研究阴阳离子结构对CO 选择性的影响。图4中,如虚线划分区域所示,根据σ=-0.0082 e/Å2和σ=0.0082 e/ Å2(1 Å =0.1 nm)可将图像分为3 个区域,分别是:氢键供体区、非极性区和氢键受体区,图中的峰处在对应区域的峰面积越大,距离分割线越远,代表该物质的氢键作用力越强,若物质处在非极性区,表明该物质不具有极性。
为了研究阳离子分子结构对CO 选择性的影响,选取了咪唑类[EimH]、[Mmim]、[Bmim]三者的σ-profile 进行对比,如图4所示。由图3可知,在固定阴离子组成为[CuCl2]的情况下,三种阳离子的选择性大小顺序为:[EimH]>[Mmim]>[Bmim]。从图4 中可发现,三者均有部分峰处在氢键供体区,但是[EimH]在σ=-0.02e/ Å2部分还额外多出一个小峰,这使得[EimH]的氢键提供能力比[Mmim]和[Bmim]都强,质子型离子液体中氢键产生的相互作用力可以提高CO/H2的分离效果,此结论与刘玉梅[25]的研究结果一致。因此,阳离子的氢键提供能力越强,越有利于CO/H2的分离。
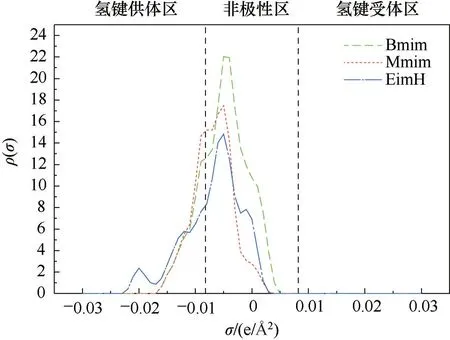
图4 [EimH]、[Mmim]和[Bmim]的σ-profilesFig.4 σ-profiles of [EimH], [Mmim], and [Bmim]
对于阴离子,选取了[BF4]、[PF6]和[CuCl2]进行对比,如图5 所示。由图3 可知,在固定阳离子组成为[N1111]的情况下,三种阴离子的选择性大小顺序为:[PF6]>[BF4]>[CuCl2]。三者均大部分处在氢键受体区,并且对比图5中三者的峰高度可发现,表面电荷密度越大,氢键接受能力越强,对CO 的选择性越强。

图5 [BF4]、[PF6]和[CuCl2]的σ-profilesFig.5 σ-profiles of [BF4], [PF6], and [CuCl2]
2.1.2 COSMO-RS 预测离子液体黏度 基于选择性筛选结果,初步挑选出对CO 选择性较强的阴阳离子,用于黏度筛选。将这些阴阳离子两两组合,使用COSMO-RS 计算离子液体在293.15 K 条件下的黏度。将计算结果绘制成热点图,如图6所示。
从图6 中可以看到,以[CuCl2]为阴离子的离子液体黏度明显比其他离子液体小,尽管由[BF4]阴离子组成的离子液体对CO 选择性更强,然而[BF4]成本比[CuCl2]高得多,并且[BF4]合成路线复杂,而[CuCl2]离子液体的合成只需将CuCl 与中间体进行简单的机械搅拌即可制备,因此从经济成本和制备难度以及黏度尽可能小的角度考虑,目标离子液体的阴离子选择[CuCl2]。结合之前CO 在离子液体中选择性的筛选结果,阳离子中[N1111]、[Mmim]、[EimH]选择性较强。考虑到离子液体的黏度普遍较大,高黏度不但会增加搅拌难度,而且会降低吸收效率。阳离子应该在[Mmim]、[EimH]中选择,氢键提供能力较强的[EimH]对CO选择性更强,目标离子液体的阳离子选择[EimH]。因此,使用COSMO-RS 对用于CO 吸收的离子液体溶剂筛选结果为质子型离子液体[EimH][CuCl2]。

图6 293.15 K下离子液体黏度的COSMO-RS预测结果Fig.6 COSMO-RS prediction results of ILs viscosity at 293.15 K
2.2 离子液体的红外光谱表征
在实验室合成离子液体后,使用FTIR对其进行表征,[EimH][CuCl2]的FTIR 表征结果如图7所示,其中,3100 cm-1左右的吸收峰主要源自于咪唑环上的N—H 伸缩振动和不饱和碳上的C—H 伸缩振动影响;在波数为2800~3000 cm-1范围内,该吸收峰由[EimH]咪唑环上的甲基和亚甲基官能团伸缩振动引起;在1600 cm-1处,该吸收峰由咪唑环骨架振动产生;在1450 cm-1左右,该吸收峰源于甲基上的C—H变形振动;在1100 cm-1处,主要源自于咪唑环的伸缩振动;500~900 cm-1范围内,产生的吸收峰由C—H面内弯曲振动引起。值得注意的是,在波数为3400~3600 cm-1范围内,产生了一个由多分子缔合所生成的分子间氢键的吸收峰,这证明了[EimH][CuCl2]中含有多分子间产生的氢键作用力。
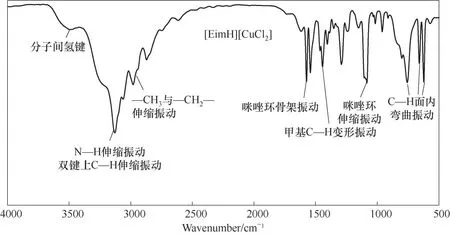
图7 [EimH][CuCl2]的FTIR图Fig.7 FTIR spectrum of [EimH][CuCl2]
2.3 离子液体的黏度测定
在常压下利用旋转黏度仪测定不同温度下离子液体的黏度。图8为常压下离子液体黏度随温度变化的黏度-温度曲线。离子液体的黏度随着温度的升高而下降,这是因为温度升高,会增加离子液体阴阳离子之间的距离,促进了分子间的热运动,从而使溶剂的黏度降低。相反,当温度降低时,黏度会急剧上升,使得液膜传质阻力增大,不利于气体的吸收。温度升高会降低离子液体对CO 吸收的效果,综合考虑两种影响因素,相平衡实验温度选择为293.15 K。
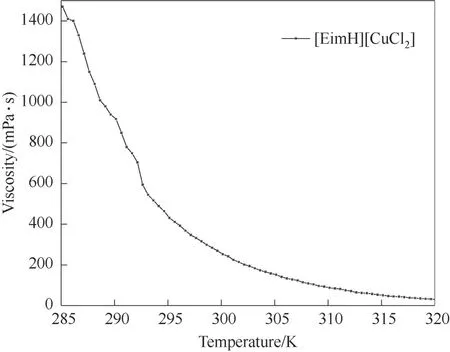
图8 常压下离子液体[EimH][CuCl2]黏度随温度变化的黏度-温度曲线Fig.8 The viscosity-temperature curve of ionic liquid [EimH][CuCl2] at atmospheric pressure as a function of temperature
2.4 CO/H2相平衡实验
2.4.1 CO/H2溶解度曲线测定 使用高压蓝宝石釜相平衡装置测定了单组分气体CO 和H2在[EimH][CuCl2]中的溶解度曲线,如图9 所示,图中横坐标为平衡压力,纵坐标为该气体在离子液体中的溶解度。由图9 可知,温度为293.15 K 时,随着平衡压力的增大,H2在离子液体中的溶解度呈线性缓慢增加。对于CO,随着平衡压力的增大,其溶解度增加速度逐渐变缓,考虑到Cu+能够与CO 发生络合反应,这可能是由于溶剂中存在对CO 的物理吸收和化学吸收的双重作用。对比图中H2和CO 的溶解度可知,CO 的溶解度远高于H2的溶解度,这使得离子
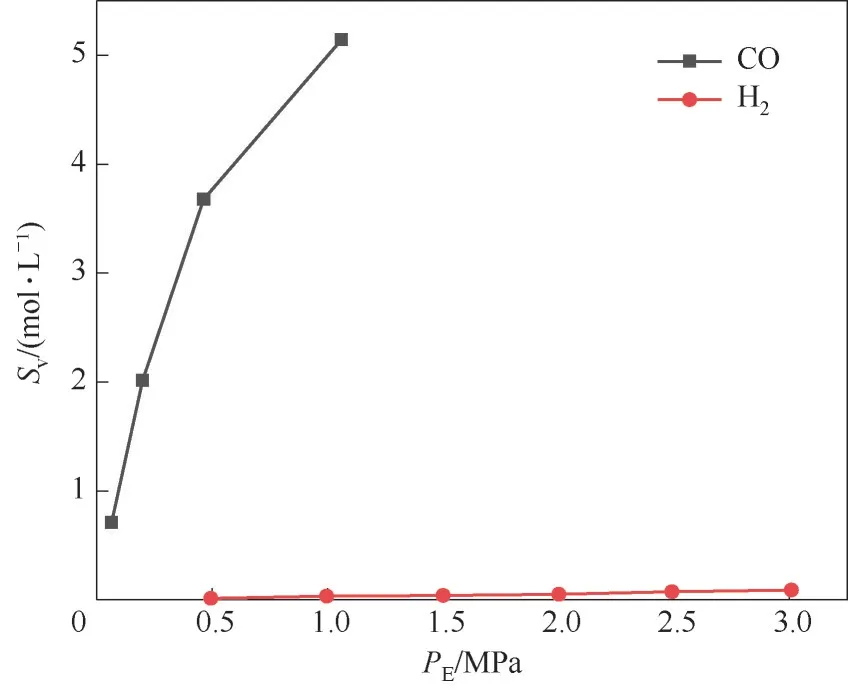
图9 单组分气体在293.15 K下在[EimH][CuCl2]中的溶解度曲线Fig.9 Solubility curves of single-component gases in[EimH][CuCl2] at 293.15 K
液体更倾向于吸收混合气中的CO,未被吸收的气体中会富集更多的H2。
2.4.2 CO/H2混合气分离实验 使用相平衡装置进行了原料气中CO 含量为1%(mol)的CO/H2混合气分离实验,其结果如表2 所示。观察表2 可发现,在平衡压为2.1 MPa、温度为293.15 K 条件下,气液比增大,CO 的表观溶解度几乎不变,H2的表观溶解度明显降低,而二者的溶解度系数均降低。对比不同气液比下CO的分离因子可发现,气液比增大,分离因子减小,这是由于气液比增大时,平衡压力不变的情况下,溶剂质量减少,单位质量溶剂需要处理更多的气体,降低了CO/H2分离效果,导致分离因子减小。
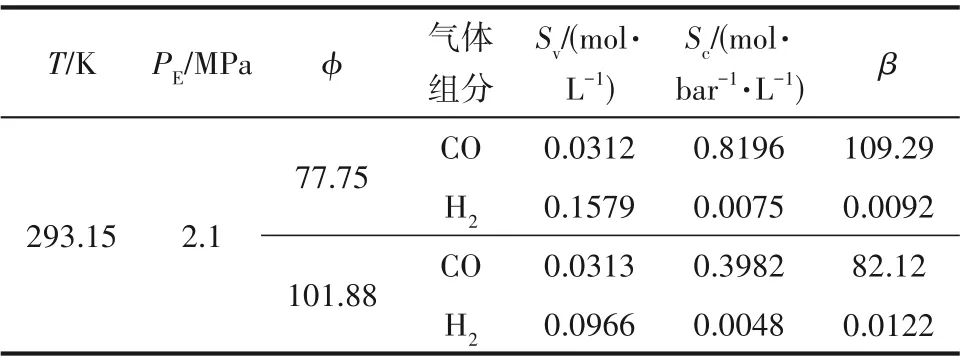
表2 CO含量为1%(mol)的CO/H2混合气分离实验结果Table 2 Experimental results of CO/H2 gas mixture separation with 1%(mol) CO
2.5 循环性测试
在工业应用中,溶剂的稳定性和重复使用性是一个非常重要的指标。因此对离子液体的稳定性和再生性做出了探究。离子液体吸收CO 和H2达到热力学平衡后,通过在323.15 K 条件下,真空解吸2 h以上即可实现再生。经过5次吸收-解吸循环操作后,将离子液体从宝石釜中取出,将回收获得的离子液体和新鲜制备的离子液体通过FTIR 进行表征分析。图10 为新鲜的离子液体和回收的离子液体的FTIR 图对比。由图10 可知,在经过解吸再生后,离子液体没有出现明显的杂峰,并且峰的强度也没有明显改变。这表明离子液体循环使用后的效果依旧很好,不易失活。然而,[EimH][CuCl2]在解吸过程中会发生起泡现象,对比图11(a)、(b)可发现在解吸时产生了大量泡沫,液面明显上升,如果泡沫过多可能会使溶剂进入到真空泵及气体管线内,产生溶剂损失和过量液沫夹带而降低效率,因此在解吸过程中必须手动控制解吸压力以维持液面高度不超过宝石釜高度,这使得实验操作难度增加。
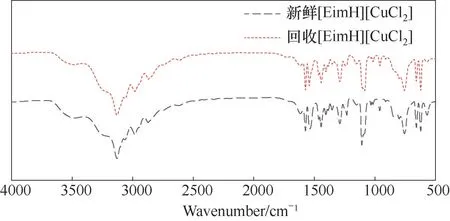
图10 回收前后[EimH][CuCl2]的FTIR图对比Fig.10 FTIR comparison of the fresh and recycled[EimH][CuCl2]

图11 [EimH][CuCl2]在宝石釜中解吸的照片Fig.11 Photographs of [EimH][CuCl2] desorption in the sapphire kettle
3 结 论
使用Turbomole 软件计算了离子液体阴阳离子的分子构型,生成了用于离子液体溶剂筛选的COSMO 种类库,以293.15 K 下CO 在离子液体中的选择性和离子液体黏度为筛选指标,使用COSMORS 对离子液体进行了筛选。使用σ-profile 分析了阴阳离子结构和表面电荷密度对CO/H2分离效果的影响,最终筛选出适合吸收CO的离子液体为[EimH][CuCl2]。随后,通过相平衡实验,测定了CO 和H2在[EimH][CuCl2]中的溶解度曲线,测定了不同气液比下[EimH][CuCl2]对CO/H2的分离因子,在温度为293.15 K、平衡压2.1 MPa、气液比77.75 条件下,分离因子可达到109.29。经过FTIR 表征后发现,[EimH][CuCl2]在经过循环使用后,其吸收峰无明显变化,这表明[EimH][CuCl2]具有良好的循环使用性。然而[EimH][CuCl2]解吸时会产生泡沫,存在安全隐患,因此未来设计溶剂时应考虑解决起泡问题。
符 号 说 明


