介质阻挡等离子体降解阿月浑子坚果仁中AFB1的效果研究
苏迎利, 马挺军
(北京农学院食品科学与工程学院,北京 102206)
阿月浑子(PistaciaveraL.)为漆树科黄连木属的落叶小乔木,是我国珍贵的木本油料植物,其坚果商品名为开心果,为世界五大坚果之一[1]。阿月浑子坚果仁营养丰富,尤其富含油脂,每100 g阿月浑子坚果仁脂肪可达到53 g,占到阿月浑子坚果仁质量的一半以上,故其易感染黄曲霉产生AFB1[2],国标规定坚果及籽类中除花生之外其他的熟制坚果及籽类的限量标准为5.0 μg/kg[3],并有即将实施的国标规定阿月浑子中黄曲霉毒素污染控制规范[4],使阿月浑子被AFB1感染的几率降低。
黄曲霉毒素B1(Aflatoxin B1,AFB1)是由黄曲霉和寄生曲霉所产生的一种次生代谢物,具有急慢性毒性、致畸、致癌和致突变性[5]。黄曲霉毒素可存在于各种富含油脂的食品中,如坚果、谷物和香料中[6]。目前降解AFB1的方法主要分为化学法[7]、生物法[8,9]和物理法[10]。物理法有吸附脱毒[11]、高温降解[12]、辐射降解[13]、超声降解[14]等方法,是目前应用较多降解AFB1的一类方法,但大多存在着处理时间长,对产品风味、营养成分造成不良影响,稳定性差、产物不定向、成本高、安全隐患等问题。其中等离子体法因为降解时间短、无残留在降解AFB1的研究中受到广泛关注[15]。
等离子体(Plasma)是一种正离子和电子密度大致相等的电离气体,由离子、电子以及未电离的中性粒子集合组成,整体呈现中性的物质状态,被称为是除固态、液态、气态之外的第四状态[16]。介质阻挡(Dielectric barrier discharge,DBD)等离子体是低温等离子体的种类之一,也称无声放电,是一种有绝缘介质(例如石英)插入放电空间的一种气体放电[17],具有操作温度低、无需外源化学试剂、节约成本等优势,选择的原因是适用范围广、可选择多种载气、气体消耗量小、有效面积大且均匀[18]。具有影响酶的活性[19]、修饰食品基质功能特性[20]、降解毒素[21]和农药[22]、对农产品原材料[23]进行灭菌等作用。现有研究报道等离子体可降解金黄色葡萄球菌肠毒素B(Staphylococcal Enterotoxin B,SEB)[24]、AFB1[24,30]、赭曲霉毒素[31]、玉米赤霉烯酮[32]、呕吐毒素(脱氧雪腐镰刀菌烯醇)[33]、T-2毒素[34]等真菌毒素,降解效果显著。
目前使用DBD等离子体法降解AFB1的研究较少,利用DBD等离子体法降解阿月浑子坚果仁中的AFB1更是少见。本研究通过DBD等离子体法对阿月浑子坚果仁中的AFB1进行降解,采用响应面法优化降解工艺条件,为AFB1的降解和等离子体法的开发应用提供依据。
1 材料与方法
1.1 材料与试剂
阿月浑子坚果粉原料、甲醇(色谱纯)、乙腈(色谱纯)、正己烷、氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾、Tween-20、三氟乙酸、AFB1总量免疫亲和柱、0.22 μm滤膜、1.5 mL eppendorf(EP)管、50 mL玻璃注射器。
1.2 仪器与设备
DBD等离子体(配有TDGC-0.5kVA接触调压器),BF2000-30A氮吹仪,一次性无菌注射器(2 mL),DGU-20A型高效液相色谱仪(配有RF-10A型荧光检测器),Model 3000型均质器,KW-1000DC型恒温箱,XW-80A型涡旋仪,VP-15L真空泵。
1.3 实验装置
实验装置图如图1所示。

图1 DBD等离子体装置图
1.4 实验方法
1.4.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm);柱温:40 ℃;流动相:V(甲醇):V(水)=50∶50,流速:0.8 mL/min,进样量:50 μL,荧光检测器:激发波长:360 nm,发射波长:440 nm。
1.4.2 标准曲线的绘制
准确配制浓度为1、5、20、50、100、200 ng/mL的AFB1标准溶液各8 mL于10 mL离心管后在50 ℃下用氮气缓缓吹至近干,分别加入200 μL正己烷和100 μL三氟乙酸,涡旋30 s,在(40±1)℃的恒温箱中衍生15 min,衍生结束后,在50 ℃下用氮气缓缓地将衍生液吹至近干,用初始流动相定容至1 mL,涡旋30 s溶解残留物,过0.22 μm滤膜,收集滤液于进样瓶中以备进样。实验重复3次,计算平均值,以色谱图中峰面积为纵坐标y,以待测样品质量浓度为横坐标x绘制标准曲线。回归方程y=57 773.964x+166 368.663(R2=0.999 5),数据显示曲线拟合性良好。
1.4.3 单因素实验
1.4.3.1 DBD等离子体放电时间的实验
准确称取5.0 g阿月浑子坚果粉,置于等离子体介质之间的盖玻片上压平至均匀分布。设定放电功率为160 W,放电间距为0.3 cm,放电时间设定为20、30、40、50、60 s。处理后加入20.0 mL乙腈水[v(乙腈):v(去离子水)=84∶16],以均质器高速搅拌提取3 min。经槽纹滤纸过滤,准确移取4.0 mL滤液并加入46.0 mL 1%Tween-20 PBS溶液稀释。
1.4.3.2 DBD等离子体放电功率的实验
准确称取5.0 g阿月浑子坚果粉,置于等离子体介质之间的盖玻片上压平至均匀分布。设定放电功率为120、140、160、180、200 W,放电间距为0.3 cm,放电时间40 s。处理后加入20.0 mL乙腈水[v(乙腈)∶v(去离子水)=84∶16],以均质器高速搅拌提取3 min。经槽纹滤纸过滤,准确移取4.0 mL滤液并加入46.0 mL 1%Tween-20 PBS溶液稀释。
1.4.3.3 DBD等离子体放电间距的实验
准确称取5.0 g阿月浑子坚果粉,置于等离子体介质之间的盖玻片上压平至均匀分布。设定放电功率为160 W,放电间距为0.3、0.4、0.5、0.6、0.7 cm,放电时间40 s。处理后加入20.0 mL乙腈水[V(乙腈)∶V(去离子水)= 84∶16],以均质器高速搅拌提取3 min。经槽纹滤纸过滤,准确移取4.0 mL滤液并加入46.0 mL 1%Tween-20 PBS溶液稀释。
1.4.4 样品的净化
将免疫亲和柱连接于50.0 mL玻璃注射器下。准确将处理好的样品滤液注入玻璃注射器中,调节下滴速度,控制样液以1~3 mL/min的速度稳定下滴。待样液滴完后,往注射器筒内加入2×10 mL水,以2~4 mL/min稳定流速淋洗免疫亲和柱。待水滴完后,用真空泵抽干亲和柱。准确加入1.0 mL色谱级甲醇洗脱,流速为1~2 mL/min(1滴/s),收集全部洗脱液于1.5 mL EP管中。将1.0 mL洗脱液在50 ℃氮气下吹干,用1 mL流动相定容后,混匀,注入HPLC检测。
1.5 AFB1降解率的计算
1.5.1 AFB1降解后残留量的计算
式中:X为阿月浑子中AFB1的含量/μg/kg;ρ为进样溶液中AFB1按照外标法在标准曲线中对应的浓度/ng/mL;V1为试样提取液体积/mL;V3为净化液的最终定容体积/mL;1 000为换算系数;V2为净化柱净化后的取样液体积/mL;m为试样的称样量/g。
1.5.2 AFB1降解率的计算

式中:A0为等离子体处理前阿月浑子坚果仁中AFB1初始浓度/μg/kg;A1为等离子体处理后阿月浑子坚果仁中AFB1的浓度/μg/kg。
1.6 Box-Behnken实验设计
选取放电时间、放电功率和放电间距为主要因子,以AFB1的降解率为响应值,采用3因素3水平的响应面分析法进行实验设计,以获得最优实验参数。实验设计的因素和水平见表1。

表1 响应面实验设计因子和水平
2 结果与分析
2.1 单因素实验对AFB1降解率的影响
2.1.1 DBD等离子体放电时间对AFB1降解率的影响
由图2可知,AFB1在功率160 W,间距0.4 cm,放电时间60 s的等离子体条件下,AFB1的降解率达到93.10%。在放电时间20~60 s范围内,随着时间的增加,AFB1的降解率不断增大,但增大幅度有所下降。对固体表面反应有直接作用的是自由基和振动激发态物质,离子和电子等激发态物质在到达表面前就已经失活。原因可能是时间越长,DBD等离子体产生自由基和激发态物质的速度减慢[16]。综合考虑,选取放电时间20、30、40 s作为响应面实验设计的因素。

注:a-c表示差异显著(P<0.05)。余同。
2.1.2 DBD等离子体放电功率对AFB1降解率的影响
由图3可知,在等离子体放电功率为120~200 W范围内,随着功率升高,AFB1的降解率呈不断增大的趋势。原因是DBD等离子体放电功率增大,产生较大的折合场强,从而导致微放电中的平均电子能量升高,活性粒子运动速度会加快,所以电子积累的速度更快,能量密度越强,使得AFB1降解率增加[17]。综合考虑,选取160、180、200 W作为响应面实验设计的因素水平。

图3 DBD等离子体放电功率对AFB1降解率的影响
2.1.3 DBD等离子体放电间距对AFB1降解率的影响
由图4可知,在放电间距0.3~0.7 cm时,AFB1降解率不断降低。AFB1的降解率随着放电间距的增大而减少。原因可能是间隙活性粒子的浓度降低导致降解效果减弱,同样的能量在越来越大的间距之间传递导致能量密度变小,产生的活性气体较少,故使降解率降低[17]。综合考虑,选取放电间距0.4、0.5、0.6 cm作为响应面实验设计的因素水平。
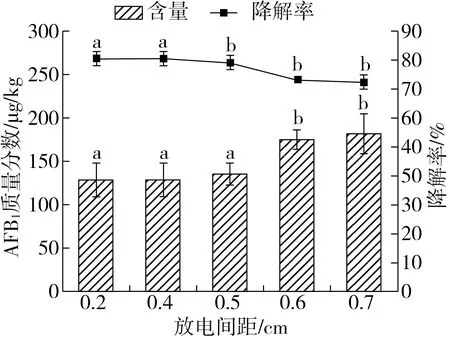
图4 DBD等离子体放电间距对AFB1降解率的影响
2.2 响应面实验
以DBD等离子体放电功率、放电时间、放电间距为自变量,根据Box-Behnken模型所设计的试验方案进行响应面分析实验,实验设计与结果如表2所示。
应用Design-Expert 8.0.6软件对表2数据进行响应面回归分析,建立AFB1降解率(Y)的回归模型,拟合二次多项式方程如下:

表2 响应面实验设计及结果
Y=80.36-1.10A+6.81B+2.16C-0.15AB+0.87AC-2.46BC+0.45A2-3.77B2+12.25C2。
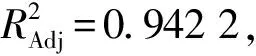
各个因素的F值反映了此因素对试验指标的重要程度,通过表3能够得出,AFB1降解率受3个因素的影响依次为B>C>A,即放电功率>放电间距>放电时间。模拟一次项B、二次项B2、C2均对响应值AFB1降解率影响极显著(P<0.01);一次项C、二次项BC交互作用显著(P<0.05);其余项对AFB1降解率不显著。

表3 响应面方差分析结果
在放电间距为0.4 cm时,放电时间和放电功率对AFB1降解率的交互作用。放电功率一定时,随着放电间距的增大,AFB1的降解率减少。当放电间距一定时,随着放电功率增大,AFB1的降解率不断增大。因此,在放电功率和放电间距两个因素相互影响下,放电功率对响应值得影响更大。
在处理电压为160 W时,放电时间和放电间距对AFB1降解率的交互作用。可知,放电时间一定时,随着放电间距的增大,AFB1的降解率呈先减小后增加的趋势。当放电间距一定,放电时间增大,AFB1的降解率增大,但是变化幅度不大。因此,在放电时间和放电间距两个因素相互影响下,放电间距对响应值的影响大。
在放电时间40 s时,放电间距和放电功率对AFB1降解率的交互作用。放电间距一定时,随着放电时间的增加,AFB1的降解率增大,但变化幅度不大;放电功率一定时,随着放电间距增大,AFB1的降解率先降低后增加,总体趋势降低。因此,在放电时间和放电间距两个因素相互影响下,放电功率对响应值的影响更大。
2.3 最佳实验条件的预测和验证
通过回归模型的预测,得到DBD等离子体降解阿月浑子坚果仁中AFB1的最佳实验条件:放电时间20 s,放电功率200 W,放电间距0.4 cm,此时AFB1的理论降解率的最大值为98.516 2%。在此最佳实验条件下进行实验操作,阿月浑子坚果仁中AFB1含量从656.29 μg/kg降解至7.49 μg/kg,降解率为93.428 7%。
3 结论
DBD等离子体对阿月浑子坚果仁中的AFB1具有很好的降解作用。AFB1的降解率与放电时间和放电功率呈正相关,与放电间距呈负相关关系。
DBD等离子体降解阿月浑子坚果仁中AFB1的最佳工艺条件为放电时间20 s,放电功率200 W,放电间距0.4 cm。AFB1降解率与预测的值基本一致,说明该模型可用于DBD等离子体对阿月浑子坚果仁中AFB1降解效果的预测。

