椰毒假单胞菌酵米面亚种及毒素的污染调查与湿米粉生产风险控制
朱文娟,黄永德,黄秀丽,赵智锋,陈文财,游泽文,张丰芸,陈榕德,林铁豪,陈嘉聪
(惠州市食品药品检验所1,惠州 516000)(广东省药品检验所2,广州 510663)
唐菖蒲伯克霍尔德菌广泛存在于自然环境(土壤、水源等),研究人员在水稻穗腐病[1-3],在医院环境[4-6]和食品(木耳、银耳、米粉等)[7-9]中多次分离到该菌。椰毒假单胞菌酵米面亚种属于唐菖蒲伯克霍尔德菌(以下简称酵米面亚种),主要存在于发酵的玉米、糯玉米、黄米、高梁米、大米、变质银耳中, 是一种导致食物中毒、致死率极高的病原微生物,该菌引起的食物中毒在国内外早有报道。酵米面亚种主要产生2种毒素:米酵菌酸(BA)和毒黄素(TF)[10]。
米酵菌酸为一种脂溶性酸性化合物, 分子式C28H38O7,分子质量486.61 ku, 化学名为3-羧甲基-17-甲氧基-6,8,21-三甲基二十二碳-2,4,8,12,14,18,20-七烯二酸,结构式见图1。米酵菌酸毒性主要作用于线粒体内膜,与腺苷酸移位体形成复合物,阻止了ADP/ATP的转运,它能作用于含巯基的酶使其部分失去活性[11-13]。毒黄素即椰毒假单胞菌酵米面亚种的水溶性黄色素,分子式为C7H7N5O2,摩尔质量为193.17 g/mol,结构式如图2所示。毒黄素作用于生物氧化的起端,从还原性辅酶Ⅰ接受氢,在O2的作用下经过酶反应形成H2O2而表现毒性[14]。国内外学者对毒黄素的研究发现,该毒素对动物的血管平滑肌[15]、肾脏[16]、心脏[17]等,会造成病理性损害,可引起胃腹部不适、肝肾损伤乃至中毒性休克等症状,主要对人体呼吸系统和循环系统造成损害[18,19]。

图1 米酵菌酸结构

图2 毒黄素结构
酵米面亚种导致的食物中毒事件在我国时有发生,先后有16个省份陆续发现了由当地特色食品(如吊浆粑、酵米面等)[20]引起的酵米面亚种食物中毒545起,中毒人数3 352人,死亡1 401人,平均病死率高达41.80%,且无特效救治药物。
湿米粉、湿粉条等米面和淀粉制品,是广东居民日常喜爱的主食之一,而广东夏秋季节高温潮湿,米面和淀粉制品较易受到唐菖蒲伯克霍尔德菌的污染,若保存不等,超限期食用,则可能引发严重的中毒继而死亡事件。2018年底东莞、河源两地接连发生因食用酵米面亚种引起的变质河粉中毒事件,造成了3人死亡。苏嘉妮等[21]对广东地区1570批次的米面制品进行抽样检验,有5批次样品检出唐菖蒲伯克霍尔德菌,其中1份检出酵米面亚种,检出率为0.06%。陈荣桥等[22]在曾发生过米酵菌酸中毒事件的南方省份采集了129份大米、碎米和淀粉样品,在4份进口碎米和1份国产碎米中分离鉴定出6株唐菖蒲伯克霍尔德菌,4株菌株为酵米面亚种,产米酵菌酸毒素,来自进口碎米。由此可见,湿米粉的酵米面亚种污染涉及生产原料和终产品,而由其毒素引起的中毒事件应当给予高度的重视。
在唐菖蒲伯克霍尔德菌的鉴定上,常用的检测方法有生理生化检测法、MALDI-TOF-MS法和recA序列分析法。赵梦馨等[23]的研究发现,MALDI-TOF-MS法和recA序列分析法对该菌的鉴定结果一致且准确,而VITEK 2 COMPACT生化检测法存在缺陷。相比传统生理生化鉴定方法,MALDI-TOF-MS法在唐菖蒲伯克霍尔德氏菌鉴定中更为快速、准确。
本研究从市场流通环节采集了易被唐菖蒲伯克霍尔德菌污染的食品样品,如木耳、银耳、玉米面、小麦淀粉、大米、碎米、米面制品等144份,以及湿米粉生产企业各环节的原料样品25份、环境样品96份和终产品11份,共276份样品,开展酵米面亚种及其毒素米酵菌酸和毒黄素的污染摸查和风险分析研究。从而找到湿米粉在生产环节和流通环节的关键风险点,为提高产品安全质量,开展相关产品的风险监测,预防该菌及其毒素的污染,做好食品安全应急及临床诊治方面提供技术支持和数据参考。
1 材料与方法
1.1 原料
从本地湿米面制品生产企业和作坊、超市、农贸市场以及小餐馆中,采集米、食用淀粉、干木耳、新鲜木耳、各类米面制品等样品共175 份,生产企业环境样本共101份。采样时,为了避免二次污染,对于小包装规格的产品则整包购买,对于大包装规格的产品则从新开封的产品中取出适量样品装入无菌取样袋并密闭包装,散装产品则采用无菌镊子将样品装入无菌取样袋并密封保存,新鲜采样量样品不少于500 g,干样不少于250 g。新鲜木耳、米面制品和环境样本在运输中均放置在冷藏保温柜,并于12 h内进行实验。
1.2 仪器和试剂
LIFE Q6全自动病原微生物检测系统,VITEK 2 Compact 自动微生物快速检测系统,生物安全柜,高压灭菌锅,BSP-400生化培养箱,LCMS-8040三重四级杆液相色谱质谱联用仪(UPLC-MS/MS),GT-2227QTS智能超声波清洗仪;Fotector Plus高通量全自动固相萃取仪,Autof MS 1000 全自动微生物质谱检测系统。
GVC 增菌液、胰酪大豆胨肉汤培养基(TSB)、马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖半固体琼脂培养基、卵黄琼脂培养基和改良马铃薯葡萄糖琼脂(MPDA),唐菖蒲伯克霍尔德菌核酸检测试剂盒(PCR-荧光探针法),VITEK 2 Compact GN 鉴定卡,玻璃纸,质谱样本预处理试剂,米酵菌酸(纯度≥95%);毒黄素(纯度≥98%),甲酸、甲醇、乙腈为色谱纯;增强型脂质去除净化管(QuEChERS dSPE EMR-Lipid);其余试剂为分析纯;实验用水为超纯水。
1.3 方法
1.3.1 样品处理和增菌
鲜木耳或银耳:用剪刀剪成约0.5 cm小块或小段;干木耳、银耳:先用生理盐水泡涨后,吸干表面水分,再用剪刀剪成约0.5 cm小块或小段;米面制品:直接取样,均质仪拍打15 s;环境样品:灭菌棉拭子蘸取灭菌生理盐水后,于仪器设备或物件表面反复擦拭(擦拭面积约25 cm2),用无菌剪刀将棉拭子带棉花部分剪入15 mL TSB中25 ℃预培养2 h。参照GB 4789.29—2020[24]的方法进行检验。鲜木耳取1 g至20 mL GVC增液,其他样品取25~225 mL GVC增菌液(36±1)℃培养20~24 h。
1.3.2 荧光PCR扩增
利用唐菖蒲伯克霍尔德菌核酸检测试剂盒(PCR-荧光探针法)对GVC增菌液进行筛查。具体操作见其使用说明书。
核酸提取:取1 mL增菌液到1.5 mL无菌离心管中,6 000 r/min离心5 min,完全去除上清液;加入30 μL裂解液充分悬浮管底沉淀,99 ℃金属浴加热10 min;12 000 r/min离心15 min,上清液即为待测样品DNA。
PCR反应体系:20 μL预混液加入5 μL模板,短暂离心后立即进行PCR扩增反应。
PCR扩增:95 ℃,30 s;{95 ℃,5 s;60 ℃,40 s} 45个循环。
1.3.3 分离、生化鉴定
对于PCR反应阳性或弱阳性的样品,参照GB 4789.29—2020中的 5.3-5.6进行分离、纯化和培养,采用VITEK 2 Compact 自动微生物快速检测系统进行生化鉴定。
1.3.4 产毒实验
将新鲜培养的菌落用生理盐水制成1.0麦氏浊度的菌悬液,取0.5 ml菌液加至铺有亲水玻璃纸的PDA半固体平板上(使用直径为14 cm的平皿,每皿加入100 ml培养基),用L棒涂布均匀,置(26±1)℃培养5 d,取出玻璃纸,收集PDA半固体琼脂至三角瓶,100 ℃灭菌30 min,置-20 ℃冰箱冷冻过夜,第2 d取出三角瓶,置室温,待液体析出,收集上清液用于毒素测定。
分别选取产米酵菌酸、毒黄素含量较高的菌株,在培养温度为20、26、30、36 ℃进行上述产毒实验,同步收集各温度下的毒素粗提液,上机测定。
1.3.5 毒素测定
分别取食品样本、毒素粗提液、空白对照粗提液进行米酵菌酸和毒黄素的含量测定,参照本实验室建立的米酵菌酸和毒黄素含量测定的液相色谱质谱法。
1.3.5.1 标准溶液配制
米酵菌酸标准储备液(0.1 mg/mL):准确称取米酵菌酸标准品10 mg(精确至0.01 mg),用甲醇溶解,转移至100 mL容量瓶中,用甲醇定容。
毒黄素标准储备液(0.1 mg/mL):准确称取毒黄素标准品10 mg(精确至0.01 mg),用甲醇溶解,转移至100 mL容量瓶中,用甲醇定容。
1.3.5.2 样品前处理方法。
(1)样品提取。称取经初步粉碎后试样5 g(精确至0.01 g)或毒素粗提液5 ml于50 mL塑料离心管中,离心管中加入1颗氧化锆均质珠(φ25 mm),将离心管置于1 500 r/min振动频率的振动球磨仪中均质2 min,向均质好的试样中加入80%甲醇水溶液10 mL,涡旋混匀1 min,超声萃取10 min,6 000 r/min 离心5 min,吸取上清液5 mL待净化。毒素粗提液和空白对照粗提液可省过此过程。
(2)样品净化。将5 mL提取液置于已预装dSPE EMR-Lipid吸附剂的15 mL净化中,涡旋2 min,6 000 r/min 离心5 min,取上清液2 mL于氮吹管于40 ℃水浴中氮吹至近干,用甲醇定容至1 mL,0.22 μm有机滤膜过滤后待测定。
1.3.5.3 色谱条件
色谱柱:ACQUITY UPLC BEH C118(2.1×100 mm,1.7 μm);流动相:A:0.1%甲酸水溶液,B:乙腈;流速:0.3 mL/min;柱温:30 ℃;进样量:2 μL,梯度洗脱程序见表1。

表1 毒黄素和米酵菌酸的测定梯度洗脱程序
1.3.5.4 质谱条件
离子源:电喷雾离子源(ESI);检测方式:多反应监测(MRM);扫描方式:正负离子模式;DL管温度:250 ℃;加热器温度:400 ℃; 雾化气流量:3 L/min;干燥气流量:15 L/min;其他质谱参数见表 2。

表2 毒黄素和米酵菌酸的质谱参数
1.3.6 毒性实验
选取SPF级昆明种雄性小白鼠(质量18~22 g)作为实验动物,根据两种毒素测定结果,选取米酵菌酸含量5 000 μg/kg以上,毒黄素含量1 000 μg/kg以上的粗提取液共11 份、空白对照粗提液2 份,进行动物实验[10]。每份粗提液样品取0.5 mL灌胃小白鼠3只,观察受试动物反应和死亡情况。
1.3.7 MALDI-TOF MS检测
挑取纯化后的唐菖蒲伯克霍尔德菌单菌落至含300 μL去离子水的离心管中,充分震荡混匀,加入900 μL无水乙醇,混匀,10 000 r/min离心4 min,弃上清;37~40 ℃干燥沉淀5 min,加入10 μL裂解液1,混匀;再加入10 μL裂解液2,混匀;10 000 r/min离心4 min后,取1 μL上清夜,滴加到样品靶上,室温下晾干;晾干后,取1 μL基质溶液覆盖在上述样品点上,室温下晾干;将样品靶放入质谱仪进行测定。参数设置:氮气激光器,波长337 nm,正离子模式,加速电压20.0 kV,延迟电压18.1 kV,延迟时间230 ns,聚焦电压7 kV,检测器电压2.56 kV,分子质量为2~20 ku,激光频率60 Hz。每次上机前都要在设定的质量范围内用标准品进行仪器校正,要保证至少有4个特征峰重叠,校正完毕后方进行样品检测的数据采集。
2 结果与讨论
2.1 流通环节中样品的细菌污染情况
木耳和本地大米中唐菖蒲伯克霍尔德菌的检出率最高。本次实验随机采集 144 份样品,样品中未检出米酵菌酸和毒黄素,说明正确泡发和食用木耳、在保质期内食用河粉米粉等米面制品,是安全的。本地大米中检出唐菖蒲伯克霍尔德菌9株,占比为28.13%(9/32),其中2株为酵米面亚种,占比为6.3%(2/32);木耳中检出唐菖蒲伯克霍尔德菌9株,占比为28.13%(9/32),其中3株为酵米面亚种,占比为9.4%(3/32);1批玉米粉中检出唐菖蒲伯克霍尔德菌,占比12.5%(1/8);55批湿米面制品中,虽未检出唐菖蒲伯克霍尔德菌,但存在伯克霍尔德菌属家族其他菌如类鼻疽伯克霍尔德菌和洋葱伯克霍尔德菌的污染。除此以外,本次的样品还检出假单胞菌属、泛菌属、少动鞘氨醇单胞菌、肠杆菌和鲍曼不动杆菌等,详见表3。
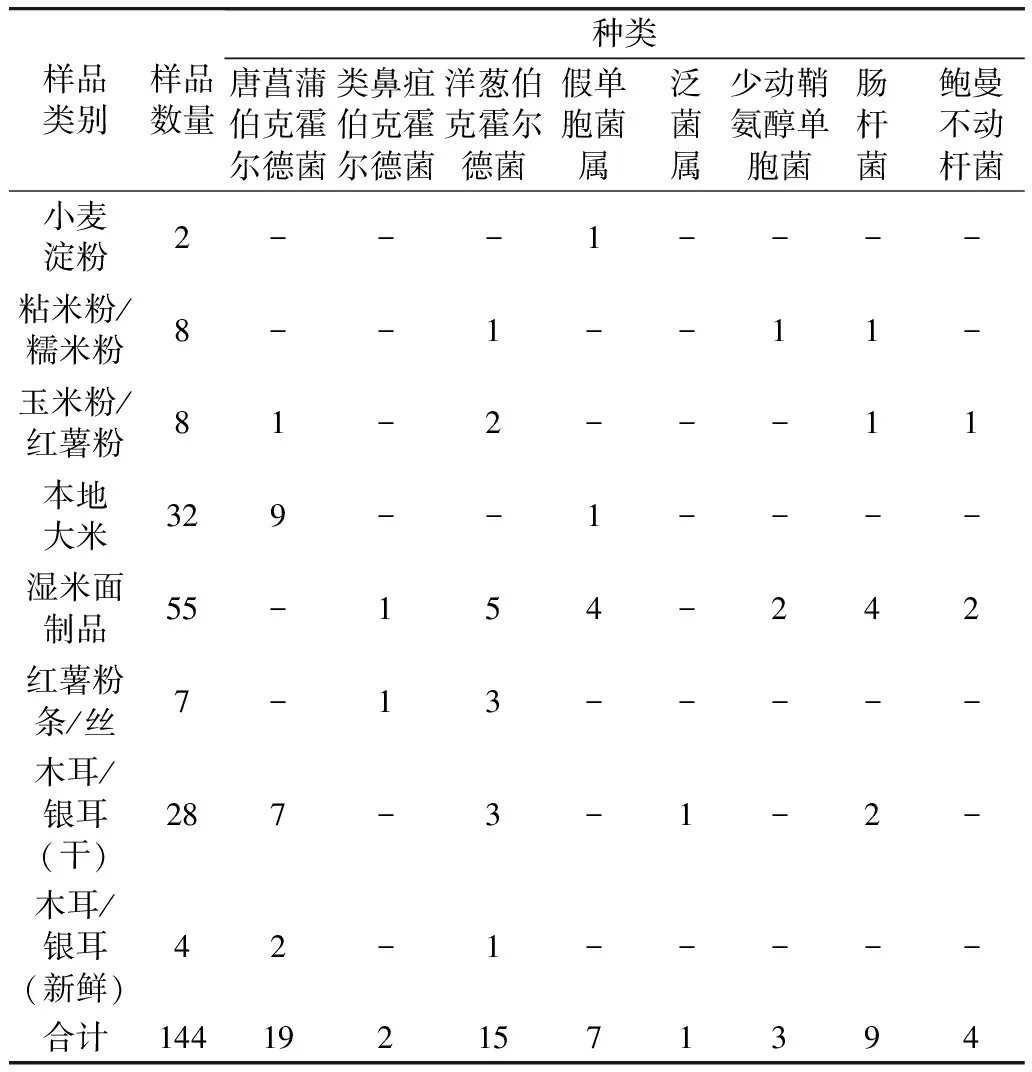
表3 流通环节样品的细菌污染情况
2.2 生产环节中样品的细菌污染情况
在原料和成品中检出唐菖蒲伯克霍尔德菌,推测污染来源于原料。实验选取本市不同县区共6家河粉生产企业进行生产环节的采样,包括原料(米、淀粉)、原料包装袋表面、米浆、蒸煮设备表面及冷却风扇、切粉设备表面及包装台、各车间的排水渠、河粉成品等,共132份样品。磨浆车间和蒸煮车间未发现伯克霍尔德菌属的污染,在原料间的大米和碎米、成品车间的河粉中分别检出唐菖蒲伯克霍尔德菌5株和1株,其中1株为酵米面亚种,来自缅甸碎米;此外,原料和包装袋表面,还发现了洋葱伯克霍尔德菌、假单胞菌和肠杆菌;成品中也发现了假单胞菌。具体数据见表4。为了避免企业使用存在风险的大米原料,将源头污染风险传递至下游各个环节;湿米粉生产环节的关键控制点在于原料验收控制、原料与各个生产环节功能间的有效分隔以及执行严格的车间环境清洁消毒程序。
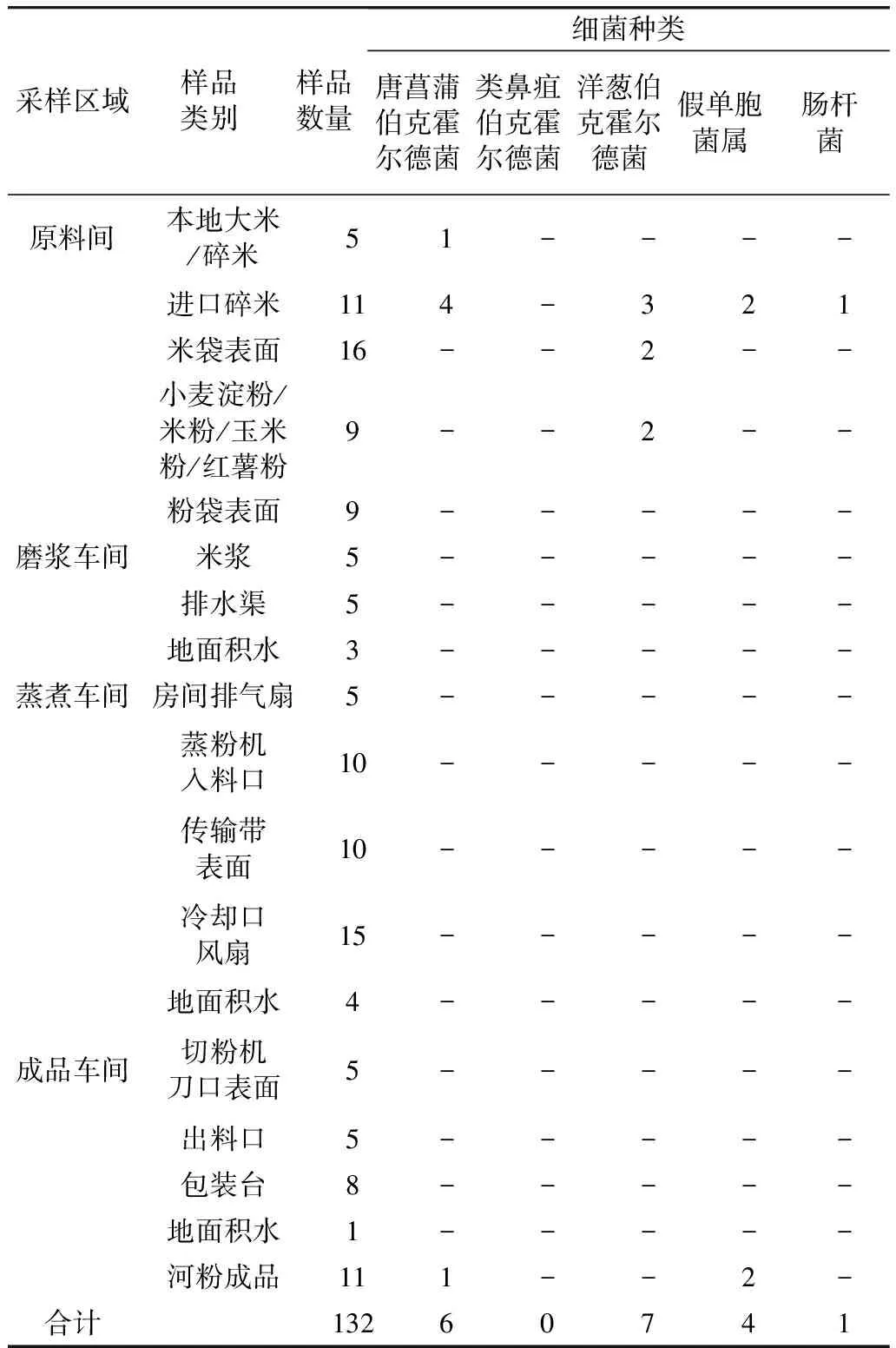
表4 生产环节中样品的细菌污染情况
2.3 唐菖蒲伯克霍尔德菌产毒素情况
本次调查共分离出25株唐菖蒲伯克霍尔德菌,主要来自于大米、碎米和木耳。经过产毒实验收集得到毒素粗提液,用液质法同时检测毒黄素和米酵菌酸,含量结果见表5,经过动物实验确认,6株为酵米面亚种,其中3株来自木耳,3株来自大米和碎米。产毒类型有4种,分别为不产毒(2株)、只产米酵菌酸(7株)、只产毒黄素(5株)和两种毒素均产(11株),6株酵米面亚种的菌种编号为别为F、K、M、V、X、Z,毒素测定的液质图谱见图3。

表5 分离菌株毒素测定结果
产毒株中毒黄素最高含量为2 611.24 μg/kg,来自本地大米,编号为X;米酵菌酸最高含量为34 678.99 μg/kg,来自某超市的干木耳,编号为F。11株分离株两种毒素均产,占比44%,仅有2株分离株两种毒素均不产,占比8%。产毒株中两种毒素含量差异较大,米酵菌酸最高量是毒黄素的10倍以上。推测原因可能是产毒株产米酵菌酸的能力更强,因此米酵菌酸也是引起中毒的主要原因[25];或者是产毒培养的培养基利于米酵菌酸的合成,却不利于毒黄素的合成。后续研究将选取毒黄素含量高的菌株,进行不同培养基的产毒条件,摸索适合毒黄素检测的产毒培养基。
2.4 两种毒素含量与温度的变化呈正相关
实验挑取分别产米酵菌酸和毒黄素量较大的典型菌株F和G,在20、26、30、36 ℃下进行产毒实验,培养5 d后,收集得到毒素粗提液,用液质法检测,2种毒素随温度的变化趋势见图3。
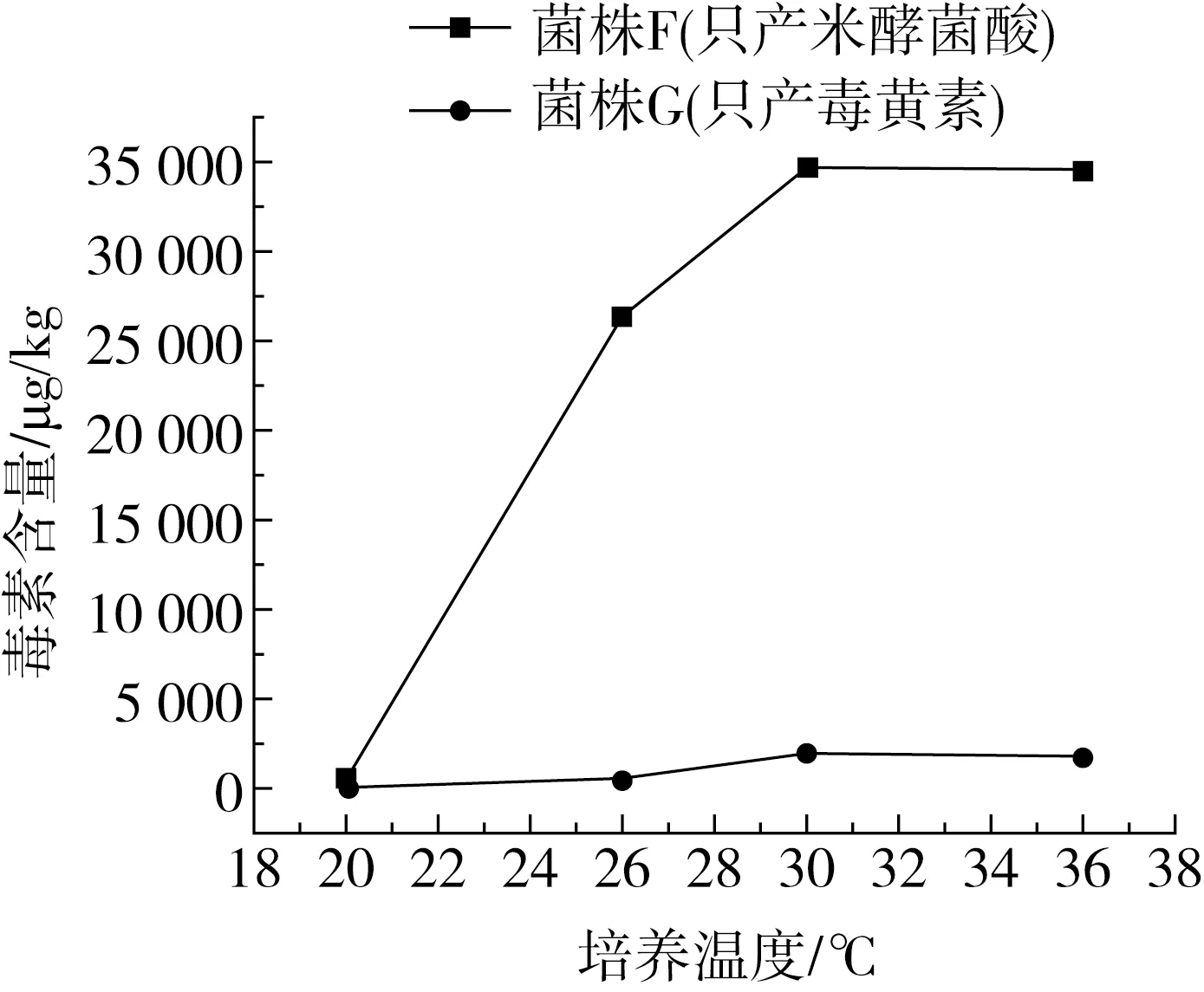
图3 菌株F中米酵菌酸、菌株G中毒黄素随温度变化的趋势
F菌株的米酵菌酸含量,在20 ℃培养下为485.20 μg/kg,在30 ℃时达到最高含量34 678.99 μg/kg。G菌株的毒黄素含量,在20 ℃培养下为56.86μg/kg,在30 ℃时达到最高值1 956.43μg/kg。米酵菌酸和毒黄素的含量均随着培养温度的升高而显著升高,并在30 ℃时达到最高值。20 ℃和30 ℃条件下,米酵菌酸含量相差近70倍,毒黄素含量相差近40倍。因此,在湿米粉的流通环节,将样品的储存温度控制在20 ℃以下,能有效减少毒素的合成,减少中毒事件的发生。
2.5 唐菖蒲伯克霍尔德菌的进化树分析
通过全自动微生物质谱检测系统进行菌株鉴定和蛋白质聚类分析,采用软件Auto Analyzer V2.0.14,使用k-means自底向上的聚类分析方法。标准菌株L和25株分离菌均为唐菖蒲伯克霍尔德菌,得分均在9.0以上,鉴定结果与VITEK 2生化鉴定一致。菌株的聚类分析图见图4,菌株X和V、P和Q均来自某镇1的黏米,W和R来自某镇2的黏米,U和T来自丝苗米,O和G、F和C、Z和Y均来自木耳/鲜木耳,N和M来自同一进口商的缅甸碎白米,I和D来自同一进口商的泰国碎白米。

注:图中右侧大写英文字母为实验室分离的唐菖蒲伯克霍尔德菌的菌株编号。
本实验同时使用VITEK 2 COMPACT和MALDI-TOF-MS对25株分离株进行鉴定,结果均为唐菖蒲伯克霍尔德菌。相比生化鉴定,MALDI-TOF-MS更快速、更省事,并可通过聚类分析得到进化树。本实验通过K类聚类分析,发现相同品种、同一产地的样品,分离的唐菖蒲伯克霍尔德菌具有高度同源性,为该类菌的污染溯源提供了科学可行的实验手段。
3 结论
本研究主要针对流通环节易受酵米面亚种及其毒素污染的食品进行污染调查,利用本实验室建立的液质方法同时对米酵菌酸和毒黄素2种毒素进行检测。结果发现,木耳、大米(碎米)、玉米粉较易受到唐菖蒲伯克霍尔德菌的污染;对湿米粉生产企业进行各环节的样品及环境采样,在原料大米(碎米)和成品河粉中发现唐菖蒲伯克霍尔德菌;25株唐菖蒲伯克霍尔德菌分离株经过毒性实验,证实6株为酵米面亚种,其中3株来源于木耳,2株来源于本地大米,1株来源于进口碎米(生产环节发现);所有样品均未检出米酵菌酸和毒黄素。通过对多家湿米粉生产企业生产环节采样结果的分析,推测终产品中唐菖蒲伯克霍尔德菌的污染来源于原料大米或碎米,为了避免企业使用存在风险的大米原料,将源头污染风险传递至下游各个环节,建议企业应严格把控原料的验收和储藏,同时将原料与各个生产环节功能间进行有效分隔,防止原料粉尘对其他环节的污染,以及执行严格的车间环境清洁消毒程序;而在湿米粉流通环节,应控制样品的储藏温度,最大限度的减少米酵菌酸和毒黄素的产生。通过生产环节的原料与环境控制、流通环节的温度控制,共同有效预防由该菌引起的严重食物中毒事件的发生。
——和田盘羊

