微小残留病与多发性骨髓瘤患者预后关系的分析
曹 波 徐 征
多发性骨髓瘤(multiple myeloma,MM)属于一种恶性血液肿瘤,由浆细胞浸润和克隆性增殖所诱发,其主要特征为骨髓异常增生且伴有多灶性增殖[1]。MM作为第二常见的血液系统恶性肿瘤,大约占血液系统恶性肿瘤的13%,我国每年发病率约为1/100 000[2]。目前,针对MM的治疗方案取得了不错的进展,经积极规范化治疗能够显著提高MM缓解率,约有75%的初诊患者可取得良好的部分缓解(partial response,PR)及以上疗效,从而延长其生存时间[3]。但不同患者预后仍然存在差异,其中治疗缓解后遗留的微小残留病(minimal residual disease,MRD)是复发的主要原因[4]。积极监测MRD不仅能够有助于预测MM复发,还可为MM患者治疗疗效评估和预后判断提供参考。多参数流式细胞术(multiparameter flow cytometry,MFC)是目前检测MM患者MRD的主要手段之一[5]。国外报道[6]表明,通过MFC检测MRD对初诊/复发、移植/非移植或细胞遗传学高危MM患者均具有一定的应用价值。故通过MFC检测MRD及分析MRD与MM患者预后生存的关系可能具有重要意义。本研究通过收集113例MM患者MRD、细胞遗传学状况以及生存时间等资料,以明确影响患者生存预后的因素,现报道如下。
1 资料与方法
1.1 一般资料 选择2017年1月至2019年1月信阳市中心医院收治的113例MM患者,男性74例,女性39例;年龄40~77岁,平均(58.41±8.83)岁。纳入标准:①符合《中国多发性骨髓瘤诊治指南(2017年修订)》[7]有关MM诊断标准;②初诊患者,此前未进行任何化疗治疗;③随访资料齐全。排除标准:①心肺功能较差且无法耐受化疗者;②髓外病变者。全部患者均接受规范化治疗。
1.2 MFC检测 全部患者均于初诊时通过MFC检测MRD,诱导治疗期间每2周评估治疗疗效,并且通过MFC复查MRD,诱导以及强化治疗完成后每3个月通过MFC复查MRD,1年后每6个月通过MFC复查MRD。MRD采用8色2管法,检测敏感度为10-4~10-5,具体检测方法参照文献[8]。MRD阴性:≥200 000个有核细胞中检测到<20个克隆性异常浆细胞。
1.3 疗效评估 按2016年国际骨髓瘤工作组(International Myeloma Working Group,IMWG)疗效标准[9]进行临床疗效评估,包括严格完全缓解(strict complete response,sCR)、完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、PR、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。
1.4 随访 以门诊、住院以及电话等多种形式进行随访,随访截止时间为2020年12月,随访6~48个月,中位随访时间26个月。无进展生存时间(progress free survival,PFS)定义为MM患者开始治疗时间至患者疾病进展或死亡之间的时间,总生存时间(overall survival,OS)定义为MM患者开始治疗时间至患者死亡或最后一次随访之间的时间。

2 结果
2.1 一般情况 期间共进行MRD检测396次,平均检测3.5次。113例MM患者中,通过MFC检测发现,治疗后有67例(59.29%)为MRD阴性,82.09%(55/67)患者在诱导治疗后6个月内达到MRD阴性,达到MRD阴性时间为治疗后1.8~25个月,中位时间4个月,MRD阴性时间>4个月患者和MRD阴性时间≤4个月患者PFS和OS比较,差异均无统计学意义(P>0.05)。
2.2 MRD状态与MM患者临床特征的关系 MRD阳性与阴性MM患者在性别、年龄、M蛋白类型、血清LDH水平、骨髓浆细胞计数(bone marrow plasma cells,BMPCs)、细胞遗传学危险分层、疾病修订版国际分期系统(revised international staging system,RISS)分期方面比较,差异无统计学意义(P>0.05);而在诱导治疗是否含硼替佐米、是否接受ASCT及是否接受维持治疗方面对比,差异具有统计学意义(P<0.05)。见表1。
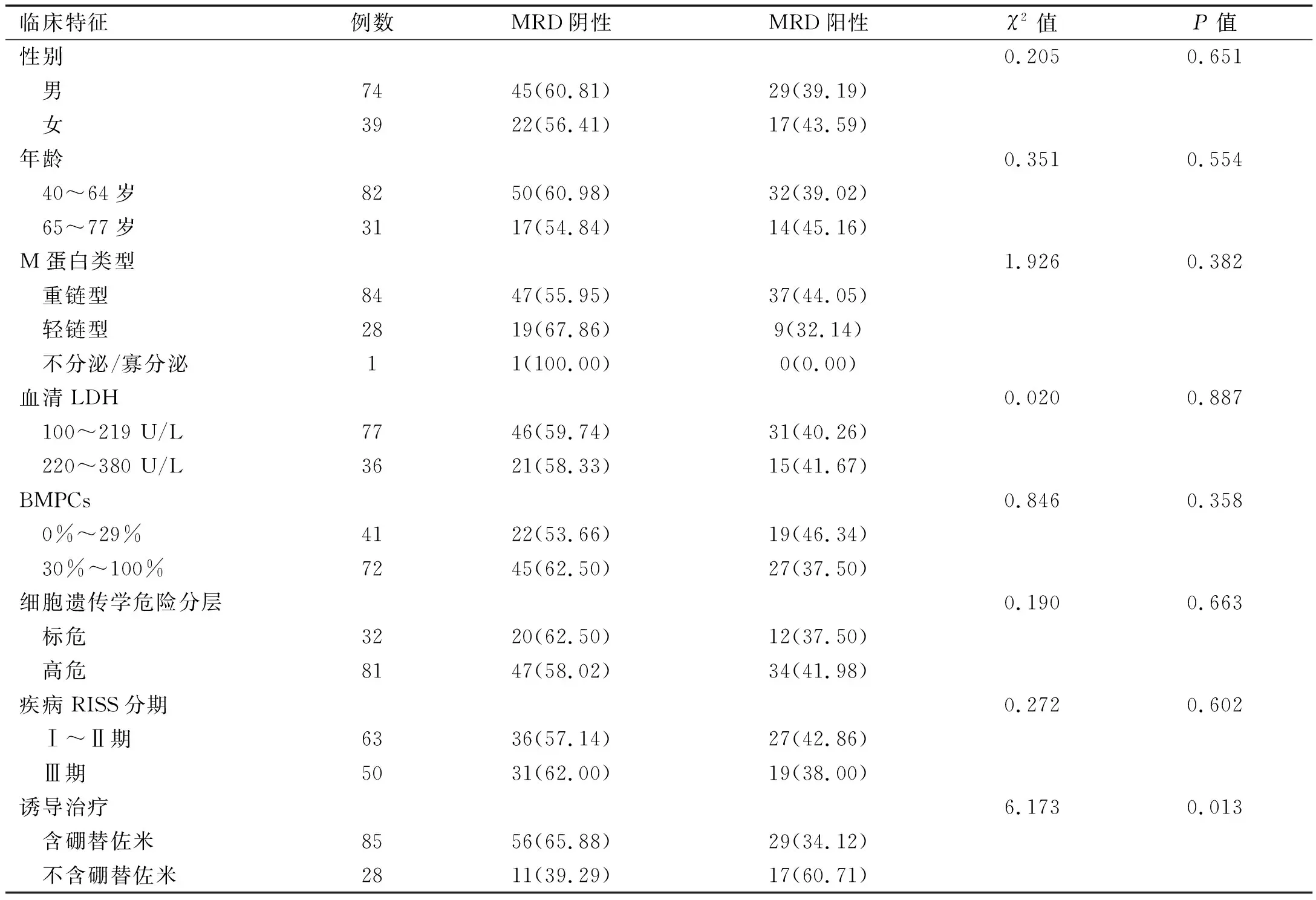
表1 MRD状态与MM患者临床特征的关系[例(%)]

续表1
2.3 113例MM患者预后生存情况 113例MM患者中位随访26个月,死亡37例,生存76例,患者总生存率为67.26%,无进展生存率为49.56%。
2.4 MM患者预后生存的Cox回归分析 单因素分析结果显示,细胞遗传学危险分层(高危)、MRD状态(阳性)是影响MM患者预后不良的因素。见表2、3。

表2 MM患者PFS的单因素分析

表3 MM患者OS的单因素分析
以生存状态为因变量(死亡=1,存活或失访=0),以单因素分析中有统计学意义的预后生存因素为自变量(细胞遗传学高危=1,细胞遗传学标危=0;MRD阳性=1,MRD阴性=0),通过向前逐步回归法进行MM患者预后生存的多因素Cox回归分析,结果显示,细胞遗传学高危、MRD阳性是影响MM患者预后的危险因素。见表4、5。
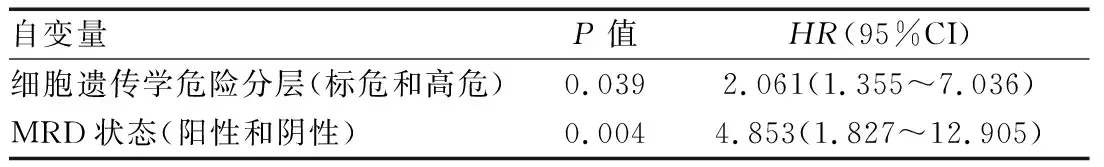
表4 MM患者PFS的多因素Cox回归分析
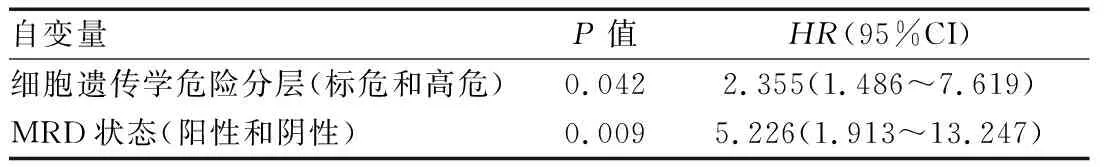
表5 MM患者OS的多因素Cox回归分析
Kaplan -Meier生存分析,MRD阴性组中位PFS为38个月(95%CI:35.314~41.582),MRD阳性组中位PFS为29个月(95%CI:24.698~33.974),两组患者PFS生存曲线比较,差异有统计学意义(log-rankχ2值=5.911,P=0.015);标危组中位PFS为47个月(95%CI:46.245~48.117),高危组中位PFS为29个月(95%CI:26.374~32.836),两组患者PFS生存曲线比较,差异有统计学意义(log-rankχ2值=9.725,P=0.002)。见图1、2。

图1 MRD阳性与阴性MM患者PFS生存曲线

图2 标危和高危MM患者PFS生存曲线
Kaplan -Meier生存分析,MRD阴性组OS为42个月(95%CI:39.776~44.994),MRD阳性组OS为34个月(95%CI:29.337~38.271),两组患者OS生存曲线比较,差异有统计学意义(log-rankχ2=9.725,P=0.002);标危组OS为46个月(95%CI:44.403~47.691),高危组OS为33个月(95%CI:28.112~37.905),两组患者OS生存曲线比较,差异有统计学意义(log-rankχ2=19.408,P<0.001)。见图3、4。
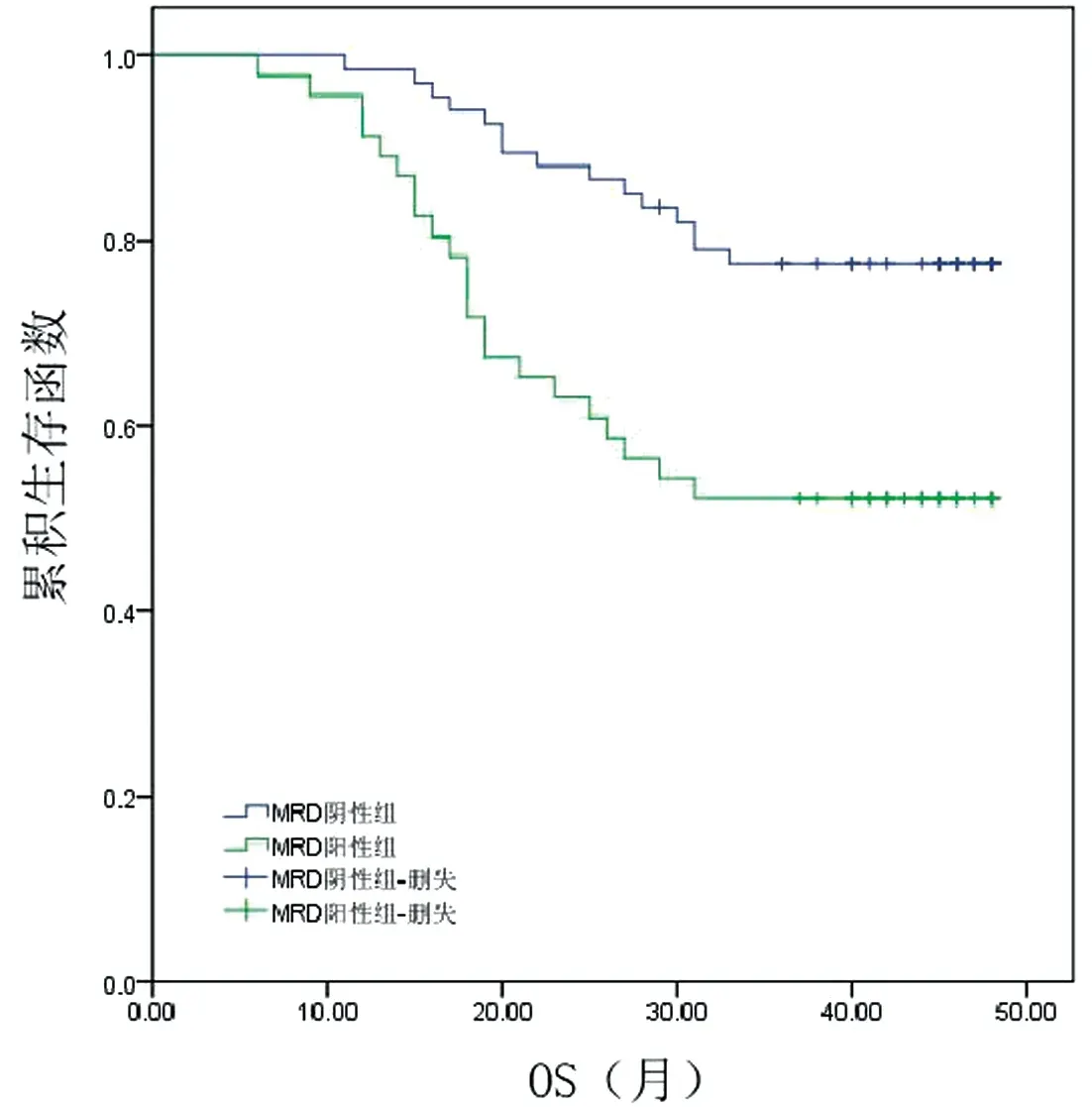
图3 MRD阴性与阳性MM患者OS生存曲线

图4 标危组和高危组MM患者OS生存曲线
3 讨论
近年来,随着对MM生物学机制的深入研究以及新药的开发和ASCT技术的日趋成熟,使MM患者的治疗取得了进展,提升了CR率,延长了MM患者的PFS和OS[10]。但研究[11]指出,即使达到sCR仍然有相当高比例的患者复发,提示经过有效治疗后患者体内仍可能存在恶性骨髓瘤细胞,也即MRD。因此,MRD检测对于判断疾病治疗效果、评估预后以及预测MM复发方面具有重要意义。
MFC是检测MRD的主要方法之一,该方法具有适用范围广、灵敏度高以及花费低等优势[12]。本研究通过采用MFC对治疗后的113例MM患者进行MRD检测发现,59.29%的患者为阴性,这与既往研究[13]相符。本研究达MRD阴性中位时间为治疗后4个月,提示可将治疗后4个月作为观察MM患者MRD的时间节点。多项证据[14-16]表明,在初诊/复发、移植/非移植MM患者中,MFC检测MRD阴性均能够作为预测PFS和OS的有效指标。本研究结果显示,MRD阴性组和MRD阳性组中位PFS、OS比较,差异均有统计学意义,提示MRD状态可能与MM患者治疗后预后生存有关。本研究结果还显示,细胞遗传学危险分层标危MM患者PFS、OS明显长于高危者。进一步多因素Cox回归分析结果显示,细胞遗传学高危、MRD阳性是影响MM患者治疗后预后生存的独立危险因素。临床上需格外重视细胞遗传高危及MRD阳性MM患者,并及时对其进行干预治疗。既往文献研究[17]表明,细胞遗传学高危与MM患者预后生存紧密相关。亦有报道[18]指出,不同细胞遗传学危险度MM患者MRD与其预后有一定关系。另外,报道[19]表明,MRD阴性伴细胞遗传学高危患者PFS和OS均优于MRD阳性伴细胞遗传学高危患者,但MRD阴性不伴细胞遗传学高危患者和MRD阳性不伴细胞遗传学高危患者PFS和OS比较,差异均无统计学意义,提示MRD阴性患者治疗后预后可能与细胞遗传学标危无显著关系,但对于MRD阳性且伴细胞遗传学高危的患者需引起重视,可能需要尽早加强治疗。而Li等[20]研究显示,对于细胞遗传学标危患者或细胞遗传学高危患者,MRD阴性患者PFS和OS均长于MRD阳性患者,但MRD阴性伴细胞遗传学高危患者和MRD阳性伴细胞遗传学标危患者在PFS和OS方面无显著差异,MRD阳性和细胞遗传学高危是MM患者的独立预后因素,MRD阴性还可改善细胞遗传学高危MM患者不良预后。故通过MFC检测MRD在MM患者治疗后预后生存评估中具有可行性。同时,本研究结果显示,MRD阳性患者诱导治疗含硼替佐米、接受ASCT及维持治疗均低于MRD阴性患者,表明不同治疗方案可能影响MRD,诱导治疗含硼替佐米、接受ASCT和进行维持治疗可能是通过促进MM患者达到MRD阴性,从而改善患者治疗后生存预后,与Lahuerta等[13]报道一致。但本研究未对接受不同方案治疗患者的PFS和OS进行分析,有待进行深入分析探讨。
综上所述,MRD阳性可影响MM患者生存预后,诱导治疗含硼替佐米、接受ASCT及进行维持治疗具有一定改善作用,通过MFC检测MRD评估患者治疗后生存预后至关重要,从而为个体化治疗提供根据。但本研究仍存在一定的局限性,所纳入病例数相对有限,且MRD检测尚缺乏统一标准,仍需不断完善相关检测技术,开展大样本和多中心有关MRD检测的研究,从而为临床实践提供更加可靠的依据。

