聚苯乙烯微塑料与铜离子单一和复合污染对THP-1细胞的DNA损伤效应研究
尹 艳,王海燕*,韩大雄,林 彩,林锡煌,单 柏
(1.自然资源部第三海洋研究所,福建 厦门 361005; 2.厦门大学药学院,福建 厦门 361102)
塑料制品由于它的便捷和经济性而被广泛使用,然而塑料在自然环境中的降解十分缓慢,在外力、风化、细菌、生物分解等作用下,大块的塑料被破碎成更小的碎片,学界将5 mm以下的塑料定义为微塑料[1-2]。研究人员在西北太平洋表层海水、北极深海沉积物中发现数量可观的微塑料[3-4]。重金属是环境中常见的持久性污染物,工业活动中的矿产冶炼、电子加工、电镀等产生的废气废水中包含大量的重金属离子。若处理不当,排入海洋环境中的重金属对生物的危害巨大,并且某些重金属可以在生物体内蓄积,在食物链中不断积聚,其毒性被放大,最终对人类健康造成巨大威胁。研究发现,高铜环境下细胞更容易转变为肿瘤细胞,血铜浓度越高,死于癌症的风险越高[5]。Wang等(2020)也证实了相较于Cd2+和Hg2+,Cu2+的毒性更大[6]。真实环境中对生物体造成危害不可能是单一污染,而是复合污染,而且复合污染的危害性可能更大。研究发现微塑料在环境中可以充当载体吸附其他污染物,从而加重其他污染物的毒性[7-8]。如今对微塑料的研究多数停留在调查研究的层面,对其生物毒性方面的研究还处于探索阶段。而对微塑料的生物毒性研究重点放在检测微塑料的体内积累[9]、对基因表达的影响[10]、载体作用[8]等,无法量化反映生物体实际承受的伤害。由于传统的环境污染评估的滞后性无法检测早期的生物毒性,相对而言“生物标志物”技术的应用可以在污染物产生危害的早期就可以检测其毒性,DNA损伤作为检测基因毒性参数的一种手段,已经被广泛应用于环境污染物的早期预警,而目前对微塑料和重金属及其复合污染下细胞承受的DNA损伤效应的研究较少。因此利用该手段检测微塑料及其复合毒性效应是非常有必要的。
单细胞凝胶电泳(Single Cell Gel Eletrophoresis,SCGE),又称彗星实验(Comet Assay),是检测细胞DNA损伤的一种成熟技术。由于它具有快速、灵敏、经济等优点,自1984年方法建立以来,被广泛地应用于检测生物体的基因毒性[11-14]。人单核细胞白血病(Human Acute Monocytic Leukemia, THP-1)细胞由于其易在实验室中培养和扩增,且具有较稳定的基因背景,不存在外周血单核细胞的个体差异性问题,利于实验结果的重现[15],因此,THP-1细胞是各大实验室常用的细胞系,Wang等也证实THP-1细胞对污染物具有较高的敏感性[6]。本研究采用优化后的单细胞凝胶电泳实验方法,探究Cu2+、聚苯乙烯微塑料(Polystyrene, PS)以及两者复合污染条件下对THP-1细胞的DNA损伤效应,为海洋环境的污染监测与评价提供科学依据。
1 材料与方法
1.1 实验细胞
THP-1细胞由厦门生命互联科技有限公司提供。THP-1细胞用含体积分数为10%的胎牛血清(FBS)、1%双抗(Penicillin-Streptomycin)的RPMI-1640培养基,在37 ℃,体积分数为5%的二氧化碳培养箱中培养,每隔1~2 d传代1次,用0.4%台盼蓝染色检测细胞存活率。采用存活率在95%以上的对数生长期的细胞用于实验。
1.2 实验材料
低熔点琼脂糖凝胶(Low Melting Point Agarose Gel, LMA)购于麦克林生化科技有限公司;10×PBS、RPMI-1640培养基、胎牛血清和双抗购于HyClone公司;无水乙醇购于广东光华科技股份有限公司;溴化乙锭(EB)购于Sigma公司;Na2EDTA、NaOH、Triton X-100、DMSO、NaCl、Tris-base、50×TAE、CuCl2均为国产分析纯;H2O2溶液购于厦门莱奥生物科技有限公司;PS购于天津大鹅公司。
1.3 细胞染毒
Cu2+和PS用超纯水配置成一定浓度的储备液。Cu2+浓度设置参照《生活饮用水卫生标准》[16]和《地下水质量标准》[17],本研究浓度选择涵盖了上述标准中涉及的浓度范围,与实际环境浓度相近。PS浓度设置参考Espinosa 等(2019)的研究[18]。收集长势较好的细胞(一般为对数生长期),以1 000 r/min转速离心5 min,弃上清,用PBS重悬两遍。用PBS调节细胞浓度至5×105~8×105个/mL[19]。取180 μL细胞悬液,实验组分别加20 μL污染物储备液,使Cu2+终浓度为10、50、100、500、1 000、2 500、5 000 μg/L,PS(0.1、0.2、0.3、0.5、0.7、1.0、2.0 μm)终浓度为1、10、15、20、25 mg/mL。复合污染则各取10 μL的Cu2+储备液和一定体积的PS储备液(2.0 μm),复合实验分为两组,一组固定Cu2+浓度为500 μg/L,改变PS浓度分别为1、10、15、20、25 mg/mL ,第二组固定PS浓度为25 mg/mL,改变Cu2+浓度分别为10、50、100、500、1 000、2 500、5 000 μg/L;实验同时设一个空白对照组(加入20 μL PBS)、一个溶剂对照组(加入20 μL超纯水)、一个阳性对照组(加入20 μL H2O2,终浓度为20 mmol/L),所有对照组Cu2+浓度均为0 μg/L,PS浓度均为0 mg/mL。然后将污染物与细胞混匀,于恒温培养箱中孵育1 h。每个实验组以及溶剂、空白、阳性对照组均设置3个平行。孵育完成后离心去上清,加入PBS清洗1遍,清洗完毕用200 μL PBS重悬细胞用于后续彗星实验。
1.4 单细胞凝胶电泳实验
取24孔板的板盖,剪去一组对边,置于无水乙醇中24 h以上备用,临用前冷风吹干。将上述细胞悬液与37 ℃的低熔点琼脂糖凝胶按一定比例混匀(体积比为1∶3)。取70 μL混合液均匀铺在24孔板板盖的样品孔中,置于4 ℃下冷却5~10 min,使琼脂糖凝胶完全固化。将胶板置于配好的细胞裂解液(2.5 mol/L NaCl,100 mmol/L Na2EDTA,10 mmol/L Tris-base,pH 为10,体积分数为1%的Triton X-100,体积分数为10% DMSO)中,于4 ℃避光裂解1 h。小心地将胶板从裂解液中取出,用超纯水浸洗两遍,缓慢地放入解旋液(1 mmol/L Na2EDTA,300 mmol/L NaOH,pH大于13)中,4 ℃解旋30 min。解旋完毕,电泳槽中加入1×TAE缓冲液(pH 为7.5),在20 V、30~40 mA条件下电泳15 min。电泳完毕,取出胶板,放入超纯水中中和10 min,重复3次。中和完毕,用滤纸吸去表面水分,置于预冷的无水乙醇中,于-20 ℃脱水2次,每次1 h。脱水完毕后置于阴凉干燥处,使其自然晾干。胶板上每个孔加入100 μL EB(1 μg/mL),避光染色10 min。采用515 nm的绿光为激发波长,将染色完成的胶板放于倒置荧光显微镜下进行拍照分析[11]。每组观察约100个细胞,图片用于后续分析。
1.5 数据分析
本实验采用CASP软件分析图像,用尾部DNA(Tail DNA)的占比(%)为损伤指标。DNA损伤值用平均值±标准偏差表示。实验数据采用Sigmaplot14绘图,用SPSS 25.0软件单因素方差分析(One-way ANOVA)中的Dunnett检验进行显著性差异分析。
2 结果与讨论
2.1 Cu2+对THP-1细胞的DNA损伤效应
Cu2+对THP-1细胞的彗星实验如图1所示,可见典型的彗星拖尾现象,由于篇幅原因,其余彗星图像暂不展示。不同浓度的Cu2+对THP-1细胞DNA损伤值如图2所示。从图中可见,与对照组相比(本实验中,空白对照组与溶剂对照组无显著性差异,因此图中为溶剂对照组,下同),低浓度Cu2+(50 μg/L)开始对THP-1细胞产生极其显著的DNA损伤效应(p<0.01)。而且随着Cu2+浓度的增大,彗星拖尾率(尾部DNA的占比)也增大,呈现明显的剂量-效应关系(正相关关系)。参照Anderson等(1994)的DNA损伤分级方法[20],将Cu2+对细胞的DNA损伤进行分级:以尾部DNA的占比进行分级,0%~10%,0级;>10%~25%,I级;>25%~50%,II级;>50%~75%,III级;>75%~100%,IV级。结果如表1所示。除最低浓度10 μg/L组外,其余浓度Cu2+都对THP-1细胞造成I级或II级损伤。

图1 Cu2+对THP-1细胞的彗星实验图像Fig. 1 Comet assay image of DNA damage in THP-1 cells by Cu2+

图2 不同浓度Cu2+对THP-1细胞的DNA损伤效应Fig. 2 DNA damage effects of different concentrations of Cu2+ on THP-1 cells图中“**”代表p<0.01极显著性差异,下同。

表1 不同浓度Cu2+对THP-1细胞DNA损伤分级表Tab. 1 Classification of DNA damages in THP-1 cells by different concentrations of Cu2+
2.2 不同粒径的PS对THP-1细胞的DNA损伤效应
不同粒径的PS对THP-1细胞的损伤效应如图3所示。2.0 μm PS组从10 mg/mL时与对照组产生极显著差异(p<0.01),随着浓度的增大,DNA损伤程度增加,且均与对照组产生统计学差异。2.0 μm组的损伤分级见表2,除1 mg/mL外,其余各组都对THP-1细胞产生了不同等级的DNA损伤,最高浓度组(25 mg/mL)产生了II级损伤。与对照组相比,0.1~1.0 μm粒径的PS虽然对THP-1细胞产生了一些损伤,但并未呈现显著的统计学差异。

图3 不同粒径的PS对THP-1细胞DNA损伤效应Fig. 3 DNA damage effects of different particle sizes of microplastics on THP-1 cells

表2 不同浓度的PS (2.0 μm)对THP-1细胞DNA损伤分级表Tab. 2 Classification of DNA damages in THP-1 cells by different concentrations of PS (2.0 μm)
2.3 Cu2+与2.0 μm PS复合对THP-1细胞的DNA损伤效应
选取不同浓度的2.0 μm PS与Cu2+复合,探究两种污染物共同作用下对THP-1细胞的DNA损伤效应。图4(a)显示固定Cu2+浓度为500 μg/L而改变PS浓度,二者复合后对DNA的损伤效应,图4(b)则显示固定PS浓度为25 mg/mL,同时改变Cu2+浓度,二者复合后对DNA的损伤效应。由图4可知,两种不同复合污染方式,产生的作用都是一致的,即:PS与Cu2+复合后,DNA损伤值显著高于单一污染(PS或Cu2+)的损伤值。复合污染后的DNA损伤值和DNA损伤分级列于表3、4,从表中可见:二者复合后,最高DNA损伤值为71.9%,产生了III级损伤。 而Cu2+、PS两者单一污染时,500 μg/L Cu2+的损伤级数为I级,25 mg/mL PS(2 μm)的损伤级数为II级,而复合污染后的损伤级数则增大为III级。通过表3、4对两种污染物的理论加和值和实际损伤值比较还发现,大多数浓度组的实际损伤值大于理论加和值,呈现一定的剂量-效应关系,且复合污染的DNA损伤值与单一污染的DNA损伤值存在极显著性差异(p<0.01)。从DNA损伤值和损伤分级来看,微塑料的加入导致Cu2+产生更大的DNA损伤效应。

图4 PS (2.0 μm)与Cu2+单一和复合污染对THP-1细胞的DNA损伤效应Fig. 4 DNA damage effects of single and combined contamination of PS (2.0 μm) and Cu2+ on THP-1 cells(a)固定Cu2+浓度为500 μg/L,改变PS浓度;(b)固定PS浓度为25 mg/mL,改变Cu2+浓度。

表3 2.0 μm不同浓度PS与500 μg/L Cu2+复合污染的DNA损伤分级表Tab. 3 Classification of DNA damages by different concentrations of PS (2.0 μm) combined with 500 μg/L Cu2+
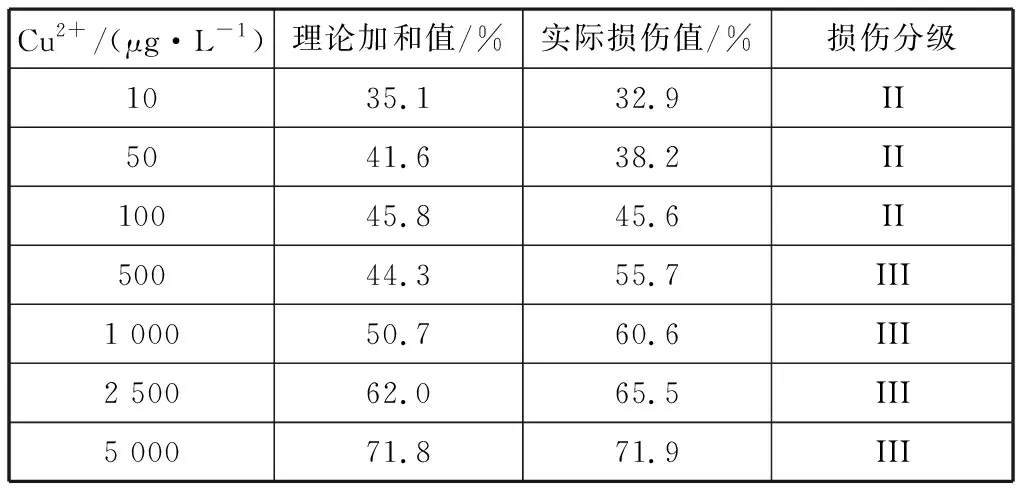
表4 不同浓度Cu2+与25 mg/mL PS (2.0 μm)复合污染的DNA损伤分级表Tab. 4 Classification of DNA damages by different concentrations of Cu2+ combined with 25 mg/mL of PS (2.0 μm)
2.4 讨论
2.4.1 金属离子对DNA损伤机理的探究 DNA损伤是评价基因毒性的常用手段之一,常用于检测环境中污染物的生物毒性[21-23]。本研究结果表明Cu2+对THP-1细胞产生显著的DNA 损伤效应,且污染物浓度越高尾部DNA占比也越大,表明DNA损伤程度越大,呈现良好的剂量-效应响应关系。刘秋妤等(2018)将Cu2+与锦鲤(Cyprinuscarpio)共暴露,发现随着Cu2+浓度的增加,DNA损伤越严重,表现在血细胞微核率显著升高[24],本研究与其结果相似。Alak等(2019)发现虹鳟(Oncorhynchusmykiss)在与不同浓度的Cu2+共暴露下,其血细胞产生DNA损伤,且Cu2+浓度越大,损伤程度越严重[25]。
金属诱导DNA损伤的机制主要是通过诱导活性氧自由基 (Reactive Oxygen Species,ROS)生成,破坏抗氧化系统,从而引起ROS清除效率降低,导致DNA损伤[26]。ROS不仅可以攻击DNA上的碱基,直接导致DNA损伤,而且可以攻击脂质,生成的不稳定物质再与DNA碱基配对,造成间接损伤[27]。此外,金属离子由于其带正电的特性,易与DNA链上的负基团发生反应,导致DNA结构发生变化,从而破坏DNA双链的完整性[28]。研究还证实:金属能干扰DNA修复系统的正常运行,导致不稳定位点的积累,从而导致DNA损伤加剧[29]。
2.4.2 微塑料对DNA损伤效应机理的探究 微塑料作为近年来出现的新型污染物,其生物毒性备受关注[18,30-31]。我们使用THP-1细胞作为受试细胞模型,探讨在微塑料单一和复合污染下对细胞的DNA损伤情况。Prietl等(2014)研究了不同种类细胞在不同粒径的羧基聚苯乙烯微粒的作用下各种生物指标的变化情况,结果表明,未分化的THP-1细胞灵敏度更高,证实了本实验使用THP-1细胞作为受试细胞模型的可靠性[32]。而且细胞分泌的炎症因子IL-6与羟基聚苯乙稀微粒粒径大小呈显著正相关。本研究结果表明,微塑料粒径与细胞的DNA损伤相关。实验组中最大粒径的2.0 μm PS组对THP-1细胞产生显著的DNA损伤,而小于2.0 μm PS组则未产生显著的DNA损伤。Wu等(2019)研究了PS对Caco-2的细胞毒性发现,5.0 μm 和0.1 μm PS均可诱导细胞产生大量的ROS,然而5.0 μm PS在1 μg/mL时显著降低线粒体膜电位,而0.1 μm PS在20 μg/mL时才能显著降低线粒体膜电位,表明5.0 μm PS产生了更大的细胞毒性[33]。本研究中,2.0 μm PS对THP-1细胞产生DNA损伤效应的原因可能是粒径较大的2.0 μm PS更容易破坏线粒体膜电位的稳定,诱导细胞产生大量ROS,导致细胞毒性增强,从而造成DNA损伤。微塑料造成DNA损伤的机制尚不明确,更多机理还需要进一步研究。
2.4.3 复合污染下DNA损伤效应机理的探究 实际上,环境中,单一存在的污染物非常少,往往都是多种类和多浓度的污染物共同作用。它们同时对环境和生物产生影响,如果仅根据单一污染物的毒性去评估环境质量,则有可能低估污染物的危害。因此,对污染物的复合毒性效应进行研究是非常有必要的。Zhu等(2019)发现菲与纳米ZnO颗粒共暴露对小麦幼苗根系造成更大伤害[34]。越来越多的证据表明,微塑料在环境中可以作为“载体”而吸附其他污染物,导致被吸附的污染物毒性增强。Lu等(2018)综合各项生物指标后得出,微塑料的加入增加了Cd对斑马鱼(Danioreriovar.)的毒性[35]。荧蒽在微塑料的作用下增加了贻贝(Mutilus)细胞中活性氧的产生,在细胞和分子水平上产生毒性[31]。滕瑶(2018)观察到与单一十溴联苯醚暴露相比,在加入2 μm聚苯乙烯后,栉孔扇贝(Chlamysfarreri)细胞的DNA损伤值显著增加[36]。Deng等(2018)研究表明微塑料加重了有机磷阻燃剂对小鼠的毒性[37]。与上述实验结果类似,我们研究发现微塑料的加入显著加重了Cu2+对THP-1细胞的毒性,而且DNA损伤值大于两者单一污染时产生损伤值的加和值,两者相互作用呈现交互增强作用。可见环境中多种污染物在微塑料的共同作用下,对生物体的危害程度将大大增加。因此,在将污染物纳入风险指标时,应该考虑其他因素的复合影响,例如微塑料存在下的复合影响。复合污染的危害尚不明确,目前还鲜有研究报道。我们推测可能是微塑料和金属离子复合后,两者同时诱导产生过量ROS,而ROS未能及时清除,会进一步破坏抗氧化系统,导致DNA损伤加剧。当然,具体机理还需要进一步研究。
3 结论
本研究采用单细胞凝胶电泳实验的方法,探究了新型污染物PS和典型污染物Cu2+对THP-1细胞的DNA损伤毒性,并探究两种污染物复合作用下的DNA损伤效应。结果表明无论是新型污染物PS还是典型污染物Cu2+均对THP-1细胞产生DNA损伤。不同浓度的Cu2+胁迫下的DNA损伤存在一定剂量-效应关系。2.0 μm粒径的PS对THP-1细胞也产生一定的毒性,对细胞造成了II级DNA损伤。而且在2.0 μm粒径的PS 存在下, Cu2+对THP-1细胞产生了更严重的DNA损伤。在环境污染物大量出现和累积的今天,本研究为快速、有效地补充新型污染物毒性效应数据和评估环境质量提供科学依据的同时,也为海洋环境中复合污染存在下标准的制定提供一定的数据支持。

