传染性胰脏坏死病毒敏感细胞系比较及其在CHSE-214 细胞上的增殖特性
赵文闻,徐黎明,陈桂花,段凯越,赵景壮,任广明,邵轶智,张颖,卢彤岩
(1.大连海洋大学,辽宁 大连 116023;2.中国水产科学研究院黑龙江水产研究所,黑龙江省水生动物病害与免疫重点实验室,黑龙江 哈尔滨 150070;3.中国水产科学研究院珠江水产研究所,广东 广州 510380)
传染性胰腺坏死病(Infectious pancreatic necrosis,IPN)是鲑鳟鱼类最为严重的传染性疾病之一。该病病原传染性胰脏坏死病毒(Infectious pancreatic necrosis virus,IPNV)隶属于双RNA 病毒科Birnaviridae、水生双RNA 病毒属Aquabirnavirus[1]。IPNV 为二十面体对称,无囊膜,直径为50~75 nm,核酸为双链RNA[2,3],主要危害虹鳟Onchorhynchus mykiss、美洲红点鲑Salvelinus fontinalis、褐鳟Salmo trutta、大西洋鲑Salmo salar 和大麻哈属Oncorhynchus spp.的鱼苗及幼鱼[4]。不同毒株、宿主和环境因素,IPNV可造成宿主10%~90%的死亡率[5,6]。IPNV 在美国[7]、法国[8]、土耳其[9]、智利[10]、墨西哥[11]、芬兰[12]、挪威[13]、西班牙[14]、日本[15]、韩国[16]以及伊朗[17]等国家均有检出。IPNV 最早于20 世纪80 年代在我国甘肃[18]、山西[19]以及山东[20]等地被检出,近些年又从四川省[21]以及云南省[22]分离到IPNV 毒株。本实验室于2013—2020 年在我国鲑鳟主养区进行IPNV流行病学监测过程中分离到了大量的IPNV 毒株[23]。目前尚无有效防治IPN 的药物,进行IPNV检测,阻止病毒的流通扩散,对减少我国虹鳟养殖业的经济损失具有重要的意义。
目前用于IPNV 检测的方法有聚合酶链式反应(Polymerase Chain Reaction,PCR)、实时荧光定量PCR、酶联免疫吸附测定法、免疫荧光法、基因探针法[24-26]、基因芯片法[27]原位杂交法[28]以及环介导等温扩增法(Loop-mediated isothermal amplification,LAMP)[29,30]等多种方法,其中PCR 是最常用的实验室检测方法。该方法需扩增提取病毒的核酸,但扩增效果受病毒含量的影响,通常会先利用敏感细胞对病毒进行扩增,然后再检测出现细胞病变的细胞培养物的病毒。江育林等[19]研究结果表明:目前可用于IPNV 体外培养的细胞系有鲤上皮瘤细胞(Epit helioma papulosum cyprini,EPC)、大鳞大麻哈鱼胚胎细胞(Chinook salmon embryo,CHSE-214)、虹鳟性腺细胞(Rainbow trout gonad,RTG-2)、虹鳟肝细胞(Liver cells of rainbow trout,R1)、狗鱼性腺细胞(Gonad cells of pike,PG)等鱼类细胞系。刘淼等[31]研究发现,IPNV ChRtm213 分离株可在CHSE-214 和RTG-2 细胞上增殖,并产生典型细胞病变,但CHSE-214 比RTG-2 细胞具有更好的敏感性。现有研究表明,CHSE-214 细胞和RTG-2 细胞是IPNV 体外培养最常用细胞系。为筛选出IPNV 体外培养最佳敏感细胞系,本研究将实验室保存的24 株IPNV 分离株分别接种于CHSE-214 和RTG-2 细胞,通过细胞病变情况比较这两种细胞对IPNV 的敏感性,确定IPNV 敏感细胞并分析IPNV 毒株在敏感细胞上的增殖特性,以期为IPNV 的检测提供科学依据。
1 材料与方法
1.1 材料
本研究中所用的全部IPNV 分离株由本实验室分离保存[23]。CHSE-214 细胞和RTG-2 细胞由中国水产科学研究院长江水产研究所鱼类病害教研室曾令兵研究员惠赠。胎牛血清、胰蛋白酶、MEM 培养基(Minimum essential medium)购自Gibco 公司,青霉素-链霉素购自ThermoFish 公司;TRIzol Reagent 购自Invitrogen 公司;PrimeScriptTMOne Step RT-PCR Kit Ver.2 试剂盒购自宝生物工程(大连)有限公司。
1.2 细胞培养与传代
从液氮罐里取出CHSE-214 和RTG-2 细胞,将其置于30℃水浴锅融化,在无菌条件下将其移入15 mL 离心管中,1 000 g/min 离心2 min,弃去冻存液,加入1 mL 细胞培养液(MEM 培养基+10%胎牛血清+1%双抗)吹匀,之后将细胞移入T-25 细胞培养瓶中,补加4 mL 细胞培养液,置于18℃二氧化碳生化培养箱中培养。待长成均匀的单层细胞,用胰蛋白酶消化并用细胞培养液吹打混匀,放入新T-25细胞培养瓶中进行1∶2 传代培养。
1.3 细胞敏感性分析
将24 株IPNV 分离株以1 000 TCID50的剂量分别接种于单层RTG-2 和CHSE-214 细胞上,连续观察7 d。每天观察细胞变化,记录在RTG-2 和CHSE-214 细胞上病变的IPNV 毒株数量,以确定IPNV 最敏感细胞系,用以开展IPNV 在最佳敏感细胞上的增殖特性研究。
1.4 IPNV 在CHSE-214 细胞上增殖的实验设计
将IPNV 毒株ChRtm213 分别以10 TCID50和100 TCID50的剂量接种于六孔板上的CHSE-214 单层细胞中,每天在显微镜下观察并记录细胞病变情况,并在接种后第1、2、3、4、5 d 收获细胞培养物。每3 个孔为一个平行样,冻存于-80℃冰箱备用。
1.5 IPNV 在CHSE-214 细胞上增殖的分析
每个平行孔取200 μL 病毒液于一个EP 管中,混匀后取出200 μL 病毒液于无RNA 酶的离心管中,用Trizol 法提取病毒RNA[32]。分别以IPNV A 链和IPNV B 链为靶标基因,β-actin 为内参基因,对各组样品中IPNV 载量的变化情况进行RT-qPCR分析。反应体系(20 μL)包括:10 μL 2×One Step TB Green RT-PCR Buffer 4、1.2 μL TaKaRa Ex Taq HS Mix、0.4 μL PrimeScript PLUS RTase Mix、2 μL RNA 模板、各0.8 μL 的上下游引物以及4.8 μL 的RNase Free dH2O。反应程序为:42℃5 min,95℃10 min,95℃5 s;60℃34 s(40 个循环);95℃15 s,60℃1 min;95℃30 s,60℃15 s。以10 TCID50接种后1 d 收获的细胞样本作为阴性对照,采用2-ΔΔCT方法计算基因相对表达量[33]。β-actin 上游引物βactin F:GCCGGCCGC GACCTCACAGACTAC,下游引物β-actin R:CGGCCGTGGTGGTGA AGCTGTAAC;A 基因上游引物AF:GCATTCAACTACGGGAGAC,下游引物AR:CATCAGGCTGTTGTAGGTTAG;B 基因上游引物BF:CCGCAGCAC AGTTCCTAA,下游引物BR:GCTTGCCATCGTCTACCA。引物由吉林省库美生物合成。
1.6 IPNV 在CHSE-214 细胞上的生长曲线绘制
在1.5 mL 无菌离心管中,用细胞维持液(MEM培养基+2%胎牛血清+1%双抗)将1.4 中收获的IPNV 病毒液分别进行10 倍系列稀释(10-1~10-8)。将稀释好的病毒悬液分别接种于96 孔微量细胞培养板上单层CHSE-214 细胞,每孔接种病毒悬液100 μL,每个浓度接种8 个孔,将只加细胞维持液的孔设成阴性对照孔,置于15℃二氧化碳生化培养箱中恒温培养,连续观察7 d,记录出现及未出现CPE 的孔数,利用Reed-Muench 法计算IPNV 的TCID50[34]。
2 结果与分析
2.1 敏感性分析
将24 株IPNV 分离株1 000 TCID50剂量接种于CHSE-214 细胞和RTG-2 细胞,观察细胞病变产生、变化情况及导致细胞病变的毒株数量。显微镜观察结果显示,接毒后1 d 时,CHSE-214 细胞和RTG-2 细胞均未出现任何变化;接毒后2 d 时,各CHSE-214 细胞组均出现变薄、变圆、崩解脱落等明显的典型细胞病变,个别RTG-2 细胞组出现了明显的细胞病变;接毒后3 d 时,CHSE-214 细胞出现大面积脱落,RTG-2 细胞病变部位扩大,出现了崩解脱落的现象(图1)。接毒后7 d,CHSE-214 细胞产生了典型的细胞病变并几乎完全崩解脱落,8 组RTG-2 细胞产生了典型的细胞病变及崩解脱落。这表明所有的IPNV 分离株均能在CHSE-214 上增殖,而仅有8 株IPNV 分离株可以在RTG-2 细胞上增殖,说明CHSE-214 细胞IPNV 敏感性更好,更适用于IPNV 的分离培养,推荐CHSE-214 细胞用于IPNV 的体外分离培养。
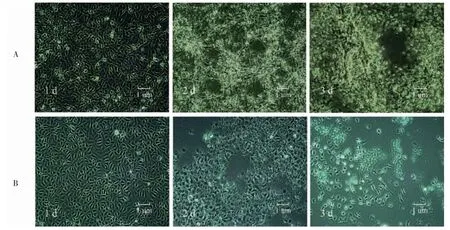
图1 IPNV 在RTG-2 细胞和CHSE-214 细胞上产生的细胞病变Fig.1 Cytopathic effect of IPNV on RTG-2 and CHSE-214 cells
2.2 IPNV 不同接毒剂量下CHSE-214 细胞的病变
分别以10 TCID50和100 TCID50接毒剂量将IPNV 分离株ChRtm213 接种于CHSE-214 细胞,观察细胞病变产生及变化情况以及出现细胞病变的时间。结果显示,在接毒后1 d,以两种剂量接种IPNV 分离株的CHSE-214 细胞均未出现任何变化;接毒后2 d,两个剂量组的CHSE-214 细胞均出现了细胞变圆、变薄、部分消融的典型细胞病变(图2),其中,以100 TCID50剂量接种IPNV 的CHSE-214细胞病变更为明显;接毒3 d,以10 TCID50接种的细胞全部出现典型细胞病变,开始出现部分崩解,以100 TCID50剂量接种的细胞也同样开始出现崩解,但尚未严重脱落;接毒后4~5 d,所有剂量组细胞均几乎全部崩解,严重脱落,仅能观察到极少量的完整细胞结构(图2)。

图2 接种不同剂量IPNV 后CHSE-214 细胞产生的细胞病变Fig.2 Cytopathic effect of CHSE-214 cells inoculated with IPNV at different doses
2.3 IPNV 在CHSE-214 细胞上增殖的RTqPCR 分析
将IPNV 毒株分别以10 TCID50和100 TCID50接种于6 孔细胞培养板上单层的CHSE-214 细胞,接毒后5 d 内每天收获病毒培养物,提取RNA,分别以IPNV A 链和IPNV B 链为靶标基因,β-actin为内参基因,利用RT-qPCR 方法检测接毒后不同时间病毒在细胞中载量的变化,以10 TCID50剂量接种IPNV 病毒1 d 后收获的病毒培养物提取的RNA 作为阴性对照。结果显示,随着时间的增加两种剂量组的IPNV 载量呈现先升高后降低的趋势,在接毒后3 d 时达最大值,显著高于其余各时间点,不同靶基因检测结果相一致(P<0.05,图3)。接种后3 d 时,10 TCID50剂量组的IPNV 病毒载量显著高于100 TCID50剂量组(P<0.05)(图3)。上述结果表明,利用CHSE-214 细胞对IPNV 进行增殖时病毒载量先升高再下降。

图3 以不同剂量接种于CHSE-214 细胞的IPNV 载量变化Fig.3 Variation in viral load in CHSE-214 cells inoculated with different doses of IPNV
2.4 IPNV 生长曲线的绘制
将IPNV 毒株以10 TCID50、100 TCID50两种不同剂量接种于单层CHSE-214 细胞,接种后5 d 内,每天收获病毒液,进行TCID50测定,绘制生长曲线。两个剂量组的IPNV 滴度均呈现先上升后下降的趋势,在接毒后3 d 时达最大值:接种后第1~3 d 呈对数增长,第4~5 d 缓慢下降(图4)。当接种剂量为10 TCID50时,接毒后第3 d 时IPNV 滴度高达106.57TCID50/0.1 mL,而在接毒后第5 d 时IPNV 滴度降低至103.88TCID50/0.1 mL;除接种后1 d 外,10 TCID50剂量组IPNV 滴度在各时间点均显著高于100 TCID50剂量组。接毒后第3 d 和5 d 时,100 TCID50剂量组IPNV 滴度分别为105.62TCID50/0.1 mL和103.43TCID50/0.1 mL,显著低于10 TCID50剂量组(P<0.05)。
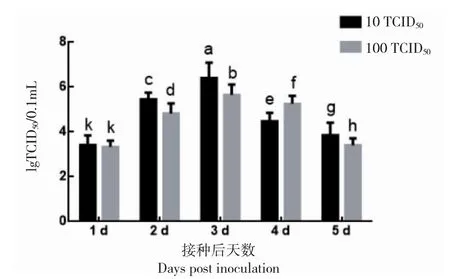
图4 IPNV 在CHSE-214 细胞上的滴度变化Fig.4 Changes in IPNV titers in CHSE-214 cells
3 讨论
3.1 IPNV 毒株的选择
水生双RNA 病毒共包括7 个基因型(基因组I-基因组VII 型)[35],包括Blake 等[8]基于VP2 序列建立的6 个基因型(基因组I 型-VI 型)和Nishizawa 等[24]基于VP2/NS 基因建立的1 个基因型。每种基因型的IPNV 毒株的地理分布不同,基因组I 型IPNV 毒株主要分布于美国[7]、智利[10]、墨西哥[11]、西班牙[14]、日本[15]和中国[18-20],基因组II 型、III 型和IV 型IPNV 毒株主要分布于加拿大[31]、西班牙[14]和加拿大,基因组V 型IPNV 毒株分布于土耳其[9]、芬兰[12]、挪威[13]、伊朗[17]和意大利[36],基因组VI 型IPNV 毒株分布于德国以及芬兰。根据GenBank 公布的中国IPNV 毒株VP2 基因序列,对本实验室于2013—2020 年分离获得的二十余株IPNV 毒株,Duan 等[23]进行了基因型分析。结果显示:我国IPNV基因型为I 型和V 型,I 型分布更广。因此在本研究中选择了I 型IPNV 来分析CHSE-214 和RTG-2的敏感性,将实验室保存的我国不同养殖区域的全部I 型IPNV 作为实验表株,以期为我国IPNV 病毒的检测提供指导。
3.2 细胞敏感性分析
IPNV 可从许多感染的鱼类中分离出,并在许多鱼类细胞系中增殖。不同的细胞对IPNV 敏感性不同。IPNV 可在许多细胞系中增殖感染并产生典型的细胞病变状态:CHSE-214、RTG-2、EPC、淡水鲤科鱼类细胞系(fathead minnow muscle cell line,FHM)、铜吻鳞鳃太阳鱼细胞系(Bluegill fry,BF-2)、虹鳟肝细胞系(Liver cells of rainbow trout,R1)、虹鳟鱼细胞系(steelhead trout embryo-137,STE-137)、红鲑胚胎细胞系(sockeye salmon embryo-5,SSE-5)、虹鳟肝脏瘤细胞系(rainbow trout hepatoma-149,RTH-149)、虹鳟脾脏细胞系(Rainbow trout spleen,RBS)、虹鳟鱼苗细胞系(rainbow trout fry-1,RTF-1)以及大西洋鲑细胞系(Atlantic salmon,AS)等[37]。其中CHSE-214 细胞、RTG-2 细胞以及EPC 细胞均可用于IPNV 的检测[19],但刘淼等[31]发现,IPNV ChRtm213 分离株在EPC 细胞上的滴度最低,产生细胞病变最慢,而CHSE-214 和RTG-2 细胞比EPC 细胞的敏感性更好。IPNV 检测的国家标准《GB 15805.1-2008-T 鱼类检疫方法 第1 部分:传染性胰脏坏死病毒(IPNV)》推荐使用RTG-2、CHSE-214 或者PG 细胞分离IPNV。我国大多数实验室更倾向于利用鲑鳟鱼来源的CHSE-214 和RTG-2 分离IPNV。本研究中选用了CHSE-214 和RTG-2 细胞分析IPNV 敏感性,以此来筛选出更适合IPNV 分离鉴定的细胞系。将IPNV 分离株全部以较大剂量接种于CHSE-214 和RTG-2 细胞,结果发现所有的IPNV 分离株均能在CHSE-214 细胞上增殖并产生典型细胞病变,而仅有三分之一的IPNV 分离株能在RTG-2 细胞上增殖并产生细胞病变,证明CHSE-214 细胞比RTG-2 细胞对IPNV 敏感。Lorenzen 等[37]研究发现,不同实验室的同一细胞系对同一病毒的敏感性存在一定的差异,但是该差异性并不会影响细胞对病毒敏感性的判断。本研究证明CHSE-214 细胞更适合用于IPNV 的体外分离培养。
3.3 IPNV 在CHSE-214 细胞上的增殖特性
病毒体外增殖的主要决定因素包括细胞系、接种剂量、培养时间、培养温度等。江育林等[19]将IPNV 毒株分别接种于鲫(Carassius auratus auratus)的囊胚细胞(Blaetoderm ofCarassius auraius,CAR)、鲤(Cyprinus carpio)的白细胞(Leucocytes of common carp,GLC)和草鱼(Ctenopharyngodon idella)卵巢细胞(Overy cells of grass carp,CO),于20℃培养7 d,细胞未出现任何病变;而在CHSE-214、RTG-2、PG和R1 细胞上,3 d 内皆出现CPE,7 d 内CPE 达到90%以上,7 d 时测得滴度分别为105.8TCID50/0.1 mL、105.5TCID50/0.1 mL、106.5TCID50/0.1 mL 和106.2TCID50/0.1 mL。刘淼等[31]发现,将IPNV ChRtm213 毒株分别接种于CHSE-214、RTG-2、EPC 细胞上,在接毒后48 h时,CHSE-214 细胞出现皱缩变圆、崩解脱落等明显的细胞病变,RTG-2 细胞只出现少数的病变灶,在接毒后72 h,CHSE-214 细胞大面积崩解脱落,RTG-2 细胞病变部位扩大,部分细胞崩解脱落,而EPC 细胞生长正常。20℃下培育7 d 时ChRtm 213 在CHSE-214、RTG-2 和EPC 细胞上病毒滴度分别为105.2TCID50/0.1 mL、103.2TCID50/0.1 mL、102.3TCID50/0.1 mL。谢文萍等[38]将IPNV 接种于FHM 细胞上,18 h细胞病变,出现空洞,15℃培育7 d 所测得的病毒滴度分别为103.064TCID50/0.1 mL。上述各研究所采用的培养温度均在15~20℃的最适范围[19],但所用毒株各不相同,接种剂量也不相同,因此无法精确衡量各培养条件对病毒滴度的影响。将IPNV 接种于CHSE-214 细胞上,第7 d 时收获病毒,但本研究发现在CHSE-214 细胞上,IPNV 表现出独特的增殖特性:接毒后第3 d 时IPNV 滴度高达106.57TCID50/0.1 mL,而第5 d 时IPNV 滴度降低至103.43TCID50/0.1 mL。由此可见,病毒载量和病毒滴度随着接种时间的增加,呈现先升高后降低的趋势。这与段凯越等[39]研究结果相一致;且在接毒后3~5 d 时,低剂量组收获的IPNV 的病毒量显著高于高剂量组。由此可见,将IPNV 接种于单层CHSE-214 细胞后,病毒培养时间并非越长越好,接毒剂量也并非越大越好,应在大部分细胞出现细胞病变,但尚未完全崩解脱落时收获病毒进行检测,不但可缩短检测时间而且会提高检出效率。IPNV 在CHSE-214 细胞中的增殖特性在先前的研究中并未被报道过。掌握该增殖特性,有利于IPNV 的检测和在灭活疫苗的制备时降低接毒剂量,缩短培养时间降低成本,提高病毒产量。利用CHSE-214 培养IPNV,培养温度18℃,病毒接种量为10 TCID50,培养时间3 d 时最为合适。

