心肌素基因在结直肠癌中的抑癌作用*
严涵鹏,吴 齐,邵胜利,冯永东
华中科技大学同济医学院附属同济医院胃肠肿瘤研究所/分子医学中心/胃肠外科,武汉 430030
肿瘤发生的原因至今还没有定论。癌基因的激活,或者抑癌基因的失活是目前所知最为根本的原因。随着癌症发病率不断攀升,结直肠癌(colorectal cancer,CRC)已成为全球第四大致命癌症;每年造成约90万人死亡[1]。因而了解结直肠癌发生发展的分子基础,从而找到结直肠癌治疗靶点已成为结直肠癌研究的主要目的之一。
心肌素(myocardin,MYOCD)是一种主要存在于心肌与平滑肌细胞内的转录共激活因子,主要通过与血清反应因子(serum response factor,SRF)的直接相互作用,调控离子通道、细胞骨架、钙转运调控蛋白等大量相关基因的表达,在心肌细胞与平滑肌细胞的分化过程中发挥重要作用[2]。但对该转录因子的研究多集中在心血管系统[3-5]。研究显示MYOCD在肿瘤的发生、发展中也起着重要的作用;其在平滑肌肉瘤中经常表达异常;分化良好、侵袭性强的腹膜后平滑肌肉瘤中MYOCD呈高表达状态[6],而人子宫平滑肌肉瘤细胞中呈低表达[7];有报道认为其发挥了癌基因的作用。比如,在肺癌细胞中MYOCD高表达可以促进TGF-β诱导的肺癌细胞上皮间质转化(epithelial-to-mesenchymal transition,EMT)和侵袭迁移[8];也有报道MYOCD在肿瘤中扮演抑癌基因的角色[7,9],可抑制子宫平滑肌肉瘤的生长[7]。但是,关于该基因在结直肠癌中的作用知之甚少。有研究报道,MYOCD可抑制多种类型癌细胞的生长[9-10],这引起我们对该基因在结直肠癌中所扮演角色的兴趣。本文主要通过基本的分子生物学技术研究其在结直肠癌中的作用,初步探讨其对结直肠癌增殖、侵袭、转移的作用及其机制。
1 材料与方法
1.1 细胞与试剂
人结肠癌细胞株HCT116、Lo Vo以 及HEK293T细胞株由华中科技大学同济医学院附属同济医院分子生物中心保种培养传代;过表达人MYOCD质粒以及对照质粒购于上海吉凯基因科技有限公司;人MYOCD基因慢病毒过表达PLVXpuro质粒由本实验室提供模板后由启动子公司构建;过表达对照质粒由启动子公司提供;包膜质粒p MD2.G与包装质粒psPAX2由本实验提供;培养液DMEM高糖(2×)购于吉诺生物公司;DMEM培养液、OptiMEM培养液、McCoy’s 5A培养液、NP-40裂解液、Turbo Fect Transfection Reagent购于赛默飞世尔科技公司;Cell Max胎牛血清购于赛澳美细胞技术(北京)有限公司,CCK-8检测试剂盒(Cell counting kit-8)、MYOCD一抗、β-actin一抗、CD133一 抗、ABScriptⅢRT Master Mix for qPCR with gDNA remove试剂盒购于爱博泰克生物公司;qPCR SYBR Green Master Mix、ECL化学发光超敏显色试剂盒购于上海翊圣生物科技有限公司;辣根过氧化物酶标记二抗购于西酶科技有限公司;Matrigel基质凝胶购于康宁(中国上海)公司;Agarose L.M.P低熔点琼脂糖购于Biosharp公司;Transwell 24孔(8μm孔径)板购于武汉启动子公司。
1.2 临床样本收集和细胞培养
临床样本来自于诊断为结直肠癌患者的癌组织与配对的癌旁正常组织;结肠癌HCT116细胞与Lo Vo细胞培养在含有5%CO2的37℃恒温箱中,细胞传代时,使用0.25%胰蛋白酶消化细胞数分钟,加入培养液(含10%胎牛血清)中和胰蛋白酶,离心后将细胞轻柔吹打成单细胞悬液。
1.3 细胞转染
将细胞铺于6孔板中,加入2 m L完全培养液培养。待细胞贴壁,融合度达70%时进行转染。分别将质粒和TurboFect转染试剂溶于250μL Opti-MEM培养液中,轻柔混合再次静置20 min。弃6孔板中细胞培养液,加入1.5 m L完全培养液。20 min后,将质粒和TurboFect转染试剂混悬液轻柔加入6孔板中,继续放入培养箱培养。
1.4 Western blot检测蛋白表达
细胞铺于6孔板中培养,蛋白提取时将细胞置于冰上,以NP-40细胞裂解液冰上裂解30 min,刮取细胞置于1.5 m L EP管中,高速低温离心(4℃,12000 r/min)15 min,取上清液测蛋白浓度,计算样品浓度及蛋白上样量。加样,以SDS-PAGE凝胶电泳分离蛋白,湿转至PVDF膜,5%脱脂牛奶封闭2 h。分别加入一抗(1∶1000)后孵育过夜,TBST缓冲液漂洗后,辣根过氧化物酶标记二抗室温孵育2 h,再次TBST漂洗后在Western blot曝光机下利用ECL发光显色,组织蛋白灰度值测量运用Image J软件。
1.5 荧光实时定量RT-PCR检测
总RNA提取采用Trizol法,ABScriptⅢRT Master Mix for aPCR with gDNA remove逆转录试剂用于合成cDNA,qPCR SYBR Green Master Mix试剂用于定量PCR,均按说明书操作。β-actin用作内参基因,相对双Delta Ct法用于相对定量结果分析。引物序列:MYOCD上游引物,ACGGATGCTTTTGCCTTTGAA;MYOCD下游引物,AACCTGTCGAAGGGGTATCTG;β-actin上 游 引 物,CATGTACGTTGCTATCCAGGC;β-actin下 游 引物,CTCCTTAATGTCACGCACGAT;CD133上游引物,AGTCGGAAACTGGCAGATAGC;CD133下游引物,GGTAGTGTTGTACTGGGCCAAT。
1.6 CCK-8法检测细胞增殖
细胞转染24 h后,将各组细胞铺于96孔板,采用细胞计数板计数,每孔约5000个细胞(体积100 μL),每组设置3个复孔。待细胞贴壁后,分别于0、24、48、72 h在每孔中加入10μL CCK-8,孵育1.5 h后,使用酶标仪检测细胞在450 nm波长处的吸光度,绘制各组细胞生长曲线。
1.7 划痕实验
将CRC细胞种植在6孔板中,100%融合后。用200μL移液管尖端绘制线性划痕。然后用磷酸盐缓冲液(PBS)轻轻冲洗细胞,用无血清培养液抑制细胞增殖,用显微镜拍照,培养24 h后,通过比较起始时间点(0 h)和最后时间点(24 h)的图像,计算细胞迁移面积(运用Image J软件),再转化为平均迁移距离。
1.8 Transwell迁移与侵袭实验
在24孔培养皿中使用Transwell小室进行侵袭实验。转染24 h后,细胞消化后用无血清培养液重悬,在上腔加入200μL(细胞数目约10万),同时,将含20%胎牛血清(FBS)的培养液放入下腔。孵育24 h后,上室细胞用4%甲醛固定,0.05%结晶紫染色。用显微镜在200倍放大率下观察并计数迁移的细胞数。
1.9 稳定高表达细胞系的构建
所有操作均在生物安全柜中进行。运用HEK293T细胞进行病毒颗粒的包装,转染12 h后换一次培养液;再过24 h后用针筒和0.45μm滤器将培养液过滤收集;随后感染目的细胞,经过嘌呤霉素筛选48 h得到MYOCD稳定高表达的CRC细胞系用于后续实验。
1.10 克隆形成实验
用嘌呤霉素筛选后的CRC细胞消化计数,每孔2000细胞接种于软琼脂或6孔板中;其中软琼脂需配置1.2% Argrose下胶和0.7% Argrose上胶,细胞均匀悬浮混于上层胶;再放入培养箱培养,每2天换一次液,2周后取出弃上清;PBS清洗2遍,甲醇固定,结晶紫染色拍照。
1.11 临床生物信息学
UALCAN分析工具(http://ualcan.path.uab.edu/)被用于分析TCGA数据库(https://portal.gdc.com)中MYOCD基因在不同癌组织与癌旁正常组织基因表达差异。
在比较MYOCD表达量与p TNM stage分期的关系时,用到TCGA数据库(https://portal.gdc.com)下载的620例结直肠癌RNA测序数据(第三级)的表达谱数据和相应的临床信息与779例TEGx数 据 库(https://gtexportal.org/home/)中的正常组织样品,R软件V4.0.3进行统计分析,以P<0.05为差异具有统计学意义。
干细胞特性分析:从Genomic Data Commons(GDC)(https://portal.gdc.cancer.gov/)数据门户网站下载肿瘤RNA-seq(FPKM)数据(TCGA),将FPKM数据转化为TPM并对数据进行归一化处理log2(TPM+1),同时保留记录有临床信息的样本。使用OCLR算法来计算mRNAsi,基于mRNA表达的特征包含11774个基因的基因表达谱,使用相同的Spearman相关(RNA表达数据),随后利用减去最小值并除以最大值的线性变换将干性指数映射到[0,1]范围[11-12]。
1.12 统计学方法
Graphpad prism 9用于实验数据统计学分析与绘图,检验方法根据数据类型分别采用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test)、t检验(Student’st-test)、卡方检验(chi-square test);每组实验均进行了3次独立重复实验。以P<0.05为差异有统计学意义。
2 结果
2.1 MYOCD在癌组织中低表达
为了阐明MYOCD在肿瘤发生发展中的作用,我们使用UALCAN分析工具[13],在TCGA数据库中分析了MYOCD在癌组织和癌旁正常组织中的表达水平,如图1A~1F,与癌旁正常组织相比,MYOCD在乳腺癌、肺腺癌、前列腺癌、胃腺癌、食管癌、结直肠腺癌中,m RNA表达量明显下调。为进一步验证,我们收集了4例临床癌组织与配对的癌旁组织样本,用实时荧光定量PCR检测MYOCD mRNA的表达量(图1G),可以看到,与癌旁正常组织相比,结直肠癌组织MYOCD的m RNA表达量均明显下降。进一步,我们用Western blot检测蛋白水平的变化,并用Image J分析,得到了相同的结果(图1H)。
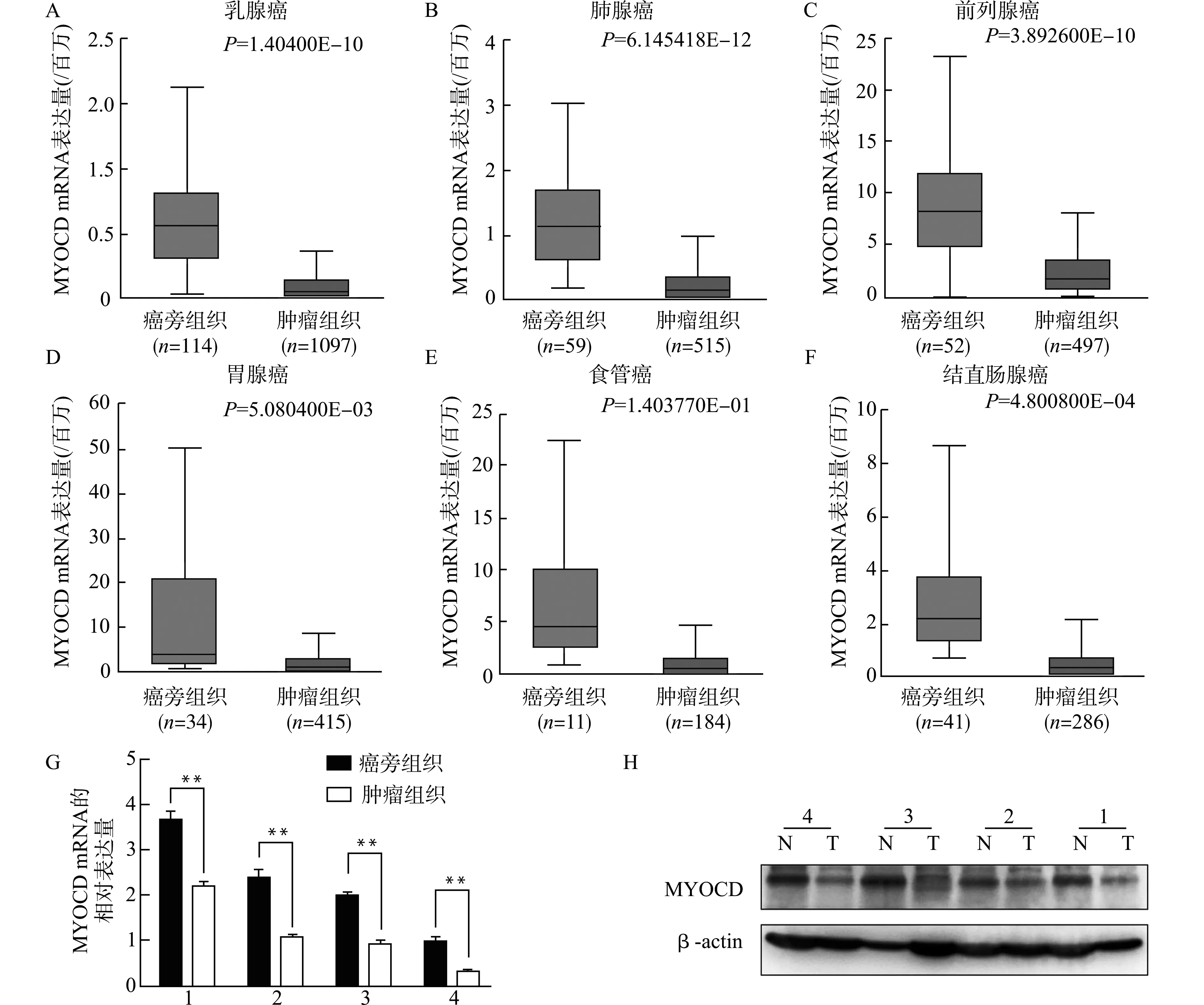
图1 MYOCD在多种类型的癌组织中表达下调Fig.1 MYOCD expression was down-regulated in different carcinoma tissues
2.2 MYOCD可抑制结直肠癌细胞增殖
为研究MYOCD基因在CRC细胞中的功能,我们在结直肠癌细胞株HCT116、Lo Vo中瞬时转染高表达MYOCD质粒与对照质粒(NC)。如图2所示,转染后48 h后,用实时荧光定量PCR分别检测高表达组与对照组MYOCD mRNA的水平(图2A,2B),用Western blot检测高表达组与对照组MYOCD蛋白水平(图2C、2D)。可以看到,与对照组相比,HCT116、Lo Vo细胞的MYOCD基因在mRNA和蛋白水平均明显增加。用CCK-8实验检测高表达对CRC细胞增殖能力的影响(图2E、2F),可见高表达MYOCD后CRC细胞增殖能力明显低于对照组。
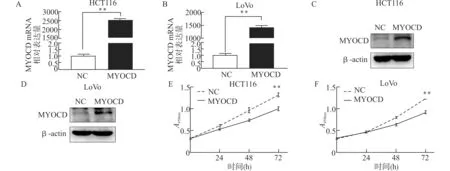
图2 MYOCD可抑制结直肠癌细胞增殖Fig.2 Overexpression of MYOCD inhibited the proliferation of colorectal cancer cells
2.3 高表达MYOCD对CRC迁移与侵袭无明显影响
为了进一步研究MYOCD的功能,我们分别使用划痕实验与Transwell实验研究高表达MYOCD对CRC迁移与侵袭能力的影响。如图3所示,高表达MYOCD对HCT116与Lo Vo细胞的迁移与侵袭能力均无明显影响。运用生物信息学工具,我们将TCGA数据中结肠癌与直肠癌组织MYOCD表达量根据四分位数分组(图4),运用卡方检验比较临床信息百分比例是否有差异;发现癌组织MYOCD的表达水平与p TNM stage分期无显著相关性(结肠癌低表达组vs.结肠癌高表达组P=0.291;直肠癌低表达组vs.直肠癌高表达组P=0.300)。

图3 MYOCD高表达对结直肠癌细胞迁移及侵袭的影响Fig.3 Effect of overexpression of MYOCD on migration and invasion of colorectal cancer cells

图4 MYOCD对CRC干细胞特性的影响Fig.4 MYOCD inhibited the stem cell properties of colorectal cancer cells
2.4 MYOCD与肿瘤干细胞特性
大多数人类癌症是由干细胞和祖细胞群通过各种遗传和表观遗传改变的顺序积累而发展起来的,其进展包括分化表型的逐渐丧失和祖细胞及干细胞样特征的获得,因而干细胞特性与肿瘤密切相关。为了进一步研究MYOCD在肿瘤中所起的作用,我们运用TCGA数据库分析MYOCD表达与干细胞特性的关系,可见MYOCD表达越高,结直肠癌组织干性评分越低,MYOCD表达越低,结直肠癌组织干性评分越高,且均高于正常组织样本的干性评分(图4A),提示MYOCD可抑制结直肠癌细胞的干细胞特性。为进一步验证其对CRC干细胞特性的影响,我们检测了高表达MYOCD后对其CD133表达的影响(图4B~4E),发现高表达MYOCD后CD133在m RNA水平(图4B、4C)与蛋白水平(图4D、4E)表达均下降(均P<0.01)。
2.5 高表达MYOCD抑制CRC细胞的克隆形成能力
为了进一步验证MYOCD对CRC干细胞特性的调控作用,我们利用慢病毒构建了MYOCD高稳定表达的Lo Vo细胞系;并对其在转录和翻译水平进行了验证(图5A、5B);随后用此细胞分别进行平板克隆形成实验与软琼脂成球实验(图5C、5D)。结果表明,高表达MYOCD可明显抑制CRC细胞的克隆形成能力。

图5 高表达MYOCD可抑制CRC细胞的克隆形成能力Fig.5 Overexpression of MYOCD inhibited the colony forming ability of colorectal cancer cells
3 讨论
癌症干细胞(CSC)的概念于40年前提出,该理论认为,肿瘤的生长由隐藏在癌组织中的少量肿瘤干细胞推动,并由此解释了许多临床现象,包括肿瘤在最初成功的化疗和放疗后几乎不可避免地复发、肿瘤休眠现象、转移等[14-17]。用于分离CSC生物标志物之一的CD133是一种5次跨膜糖蛋白,与CSC在肿瘤复发、转移和化疗耐药中的作用密切相关,广泛参与肿瘤发生、代谢、凋亡和自噬等,被认为是CSC的“阿喀琉斯之踵”[18]。实验中我们发现,MYOCD在结直肠癌细胞中发挥着肿瘤抑制基因(TSG)的作用,抑制了CRC的增殖,对CRC细胞的侵袭转移能力无明显影响,并发现在肿瘤细胞高表达MYOCD后,出现了CD133的表达降低,提示MYOCD可能通过降低肿瘤细胞的干细胞特性从而发挥TSG的作用。
有研究发现MYOCD可通过招募PRMT5/MEP50甲基转移酶复合物通过表观遗传修饰TGFBR2启动子区域以沉默其在肺癌细胞中的转录,降低Smad3的磷酸化,抑制TGFBR信号,从而发挥TSG的作用;并发现MYOCD缺失的非小细胞肺癌细胞对于转化生长因子受体(TGFR)抑制剂更加敏感,提示MYOCD缺失在临床上的应用价值[19];此外还可抑制ALDH1的表达,而ALDH1也作为一种CSC的标志物,在肿瘤中发挥重要的功能[20]。有趣的是,另有文献报道MYOCD可促进TGF-β诱导的EMT和非小细胞肺癌的转移,与SMAD3/SMAD4结合形成的正反馈环路促进snail的表达诱导肺癌细胞的EMT。但在结直肠癌细胞中,我们并未发现其对细胞迁移侵袭有显著影响。值得注意的是TGF-β可促进MYOCD的表达[2,8],然而TGF-β信号通路在肿瘤发展前期抑制肿瘤生长,后期该功能丢失[21]。一个重要的原因是其丧失对下游基因如CDKN2B,CDKN1A和CDKN1C等抑癌基因的调控,而该过程仍然有待彻底阐明。有研究发现淋巴瘤激酶(ALK)可磷酸化Smad4的酪氨酸残基,使癌细胞阻断TGF-β介导肿瘤抑制信号[22];而在TGF-β信号中起到中心转导作用的Smad4突变在结直肠癌中更是高达10%[21]。可以推测,MYOCD表达降低可能与TGF-β的细胞内信号转导阻断有关。此外,在数种鼻咽癌细胞系中观察到MYOCD的低表达与其启动子高甲基化有关,用去甲基化剂5-氮杂胞苷处理这些癌细胞,可以增加MYOCD的表达[23]。在乳腺癌中,MYOCD可以促进乳腺丝抑蛋白(Maspin)的表达,而Maspin可诱导乳腺癌细胞的凋亡[9]。除了癌组织中MYOCD表达普遍降低,在其他类型肿瘤细胞的恶变中,MYOCD表达经常受抑制,导致细胞分化障碍,MYOCD重新表达又可引起细胞分化,抑制肿瘤增殖[7,9-10]。同时还可激活CNN1和一些平滑肌细胞收缩基因,而这些基因在转移瘤中表达量减少[24-25]。值得注意的是血管平滑肌表型具有较强的可塑性,而血管平滑肌肉瘤却极其罕见[26],该原因的分子基础还不是很清楚,可能与平滑肌限制性MYOCD亚型有关,该亚型与心肌细胞内的亚型相比有着更强的生长抑制作用[27]。
然而,任何研究均有其局限性,本实验中我们用到了TCGA数据库与临床组织样本检测癌组织与癌旁组织的MYOCD的表达,但组织在除外癌细胞外还存在其他间质细胞,肿瘤组织中存在的血管可表达MYOCD,而血管又在肿瘤的生长与转移中起着重要的作用[17],从而影响结果分析;此外,体内外实验也有很大的不同,在迁移侵袭实验中,缺少了肿瘤间质,而肿瘤微环境在肿瘤侵袭转移中起着非常重要的作用[28],肿瘤细胞EMT程序的激活通常需要癌细胞和邻近基质细胞(如免疫细胞等)之间的信号传递[29],因而无法完全反映体内肿瘤细胞的真实生物学行为。
总之,我们的研究发现MYOCD在结直肠癌组织中低表达,高表达MYOCD后可抑制CRC细胞的增殖,而对其迁移与侵袭无明显影响。此外,生物信息学方法提示MYOCD表达与结直肠癌组织的干细胞特性呈负相关,高表达MYOCD可抑制CD133的表达,并显著抑制CRC细胞的克隆形成能力,提示MYOCD可能通过影响CRC细胞的干细胞特性在结直肠癌中发挥TSG的作用。
——一道江苏高考题的奥秘解读和拓展

