miR-155通过调节IL-21受体参与特应性皮炎的发病机制初探
葛维维 吴黎明 陈再明 廖米荣
特应性皮炎(AD)是一种常见的慢性复发性炎症性皮肤病,通常发生在婴儿早期,AD发病归因于环境因素、宿主易感基因、免疫系统失调等多因素相互作用[1]。MicroRNA(miRNA)是一类小的非编码 RNA,参与机体众多生物学过程[2]。人T辅助细胞系Jurkat是近年来发现的CD4+T细胞亚群[3-4],其可能参与包括AD在内的多种自身免疫性疾病发病过程[5]。既往研究揭示众多miRNA在免疫和炎性疾病中的作用,其中miR-155可通过下调细胞毒性T淋巴细胞抗原4(CTLA-4)增加T辅助细胞增殖反应,从而导致慢性哮喘发病[6]。产生白介素(IL)-21的T辅助细胞(Th21)是最近鉴定出的CD4+T辅助细胞亚群,在调节免疫系统中起重要作用,并参与包括AD在内的各种自身免疫和炎性疾病[7-8]。动物实验研究显示,缺乏miR-155的小鼠无法发展为实验性自身免疫性脑脊髓炎(EAE),而在胶原诱导的关节炎模型中,miR-155敲除小鼠对抗原特异性Th21细胞反应具有抗性[9]。本研究探讨miR-155是否通过调节IL-21受体参与AD的发病,为AD的治疗提供理论依据。
1 资料与方法
1.1 临床资料 选取2018年1月至2020年5月台州市第二人民医院急性AD患者110例为观察组,根据Rajka定义的标准确诊,并使用SCORingAD(SCORAD)指数评估疾病的严重程度。纳入标准:①近6个月未接受过全身性糖皮质激素及免疫抑制剂治疗;②近1个月AD患者无疫苗接种;③近2周无感染。排除标准:①合并肿瘤者;②合并自身免疫性疾病;③其他皮肤病。同时选取健康体检者102例为对照组。两组一般情况比较差异无统计学意义(P>0.05)。见表1。本项目经医院伦理委员会批准,所有受试者及家属知情同意。

表1 两组一般情况比较
1.2 方法 (1)外周血Jurkat细胞miR-155、IL-21R mRNA水平测定:通过Ficoll-Hypaque密度梯度离心从500 μL外周血中分离出Jurkat细胞,使用RNAiso Plus提取Jurkat细胞RNA,并在20 μL反应系统中使用Trans Script Green一步qRT-PCR SuperMix通过一步qRT-PCR检测基因的相对表达,qRT-PCR反应条件为:45 ℃,5 min ;94 ℃,30 s;(94℃,5 s;60℃,30 s)×40个循环,用2-△△Ct法分析靶基因表达量。(2)外周血CD44、IL-4、IL-10、TNF-α、hs-CRP、Th21测定:流式细胞仪(AttuneNxT,美国热电)检测CD44、Th21细胞占总淋巴细胞的比例(抗体购于上海玉博生物科技有限公司,批号:5632456、8546296),相应试剂盒评估参与者外周血中IL-4、IL-10、TNF-α、hs-CRP的水平(MSKBIO中国,武汉),使用Multiskan Sky酶标仪检测样品光密度值。(3)细胞复苏培养及分组:在含有10%FBS和1%青霉素/链霉素的RPMI-1640(美国Gibco)培养基中培养Jurkat细胞,根据制造商的说明,用lipofectamine 2000(美国Invitrogen)转 染Jurkat细 胞。miR-155 NC组、miR-155 mimics组、miR-155 inhibitor组培养方法:miRNA载体包括miR-155 NC载体(无miR-155表达)、miR-155过表达载体(mimics),miR-155低表达载体(miR-155 inhibitor组)(购自RiboBioCo,中国广州)。其载体序列分别为:5'-TGCGTGACTGAACTGACTGGACTGAC TG-3';5'-TGCGTGACTGCAATGCGTGACTGC-3'。使用Lipofectamine2000试剂根据质粒进行差异转染,各组设6个平行样,培养72 h。(4)Jurkat细胞活力、凋亡测定:将细胞以1×103/孔的浓度铺在96孔板上,库尔特计数器孵育1天后对细胞数进行计数,并使用细胞计数试剂盒8(CCK-8)计算细胞增殖率,酶标仪检测490 nm吸光度评估细胞活力。通过胰蛋白酶消化收集细胞,并根据说明将其重悬于100 μLAnnexin V Binding Buffer中。将5 μL FITC Annexin V添加到细胞中,然后添加10 μL碘化丙啶(PI)。在室温下孵育15 min后添加400 μL膜联蛋白V结合缓冲液,通过FC500MCL流式细胞仪检测细胞凋亡。(5)Jurkat细胞IL-21R蛋白表达水平测定:将RIPA裂解试剂添加到细胞沉淀中,在冰上裂解15 min后,提取蛋白质上清液。通过双辛可宁酸(BCA)测定蛋白质量浓度后,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上电泳分离蛋白40 μg,电泳至聚偏二氟乙烯(PVDF)膜上(250 mA,100 min),在室温下封闭放置60 min,并与一抗(IL-21R,β-肌动蛋白稀释比例为1∶2,000、1∶1,500)在4℃下过夜。用磷酸盐缓冲盐水和Tween-20(PBST)洗涤3次后,加入HRP偶联的二抗(1∶5,000,60 min),然后用PBST洗涤3次,加入化学发光溶液可视化蛋白质条带。使用GS-900TM校准密度计定量密度,并使用ImageLab(BioRad)进行分析。
1.3 统计学分析 采用SPSS19.0统计软件。计量资料以()表示,两组比较采用t检验,三组比较采用单因素方差分析,多重比较采用SNK-q检验,相关分析采用Pearson积差相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组miR-155、IL-21R mRNA及炎症指标比较 观察组miR-155、IL-21R mRNA、IL-4、hs-CRP、TNF-α、CD44、Th21、IL-21 水平高于对照组(P<0.05)。
表2 两组miR-155、IL-21R mRNA及炎症指标比较()

表2 两组miR-155、IL-21R mRNA及炎症指标比较()
注:与对照组比较,*P<0.05
指标 对照组(n=102) 观察组(n=110)miR-155mRNA 0.86±0.48 3.58±0.39*IL-21R mRNA 1.23±0.39 4.59±0.39*IL-4(pg/mL) 8.89±4.54 19.59±3.36*hs-CRP(μmol/L) 328.47±10.29 467.59±12.84*TNF-α(pg/mL) 4.59±2.48 39.85±5.48*CD44(%) 72.59±3.96 82.45±5.86*Th21(%) 2.30±0.58 3.96±0.39*IL-21(pg/mL) 5.54±2.69 16.96±3.55*
2.2 miR-155与各变量的相关性分析 miR-155与TNF-α、IL-4、IL-21、TH21、IL-21R mRNA、hs-CRP、CD44正相关(r=0.458、0.563、0.489、0.539、0.636、0.574、0.669,P=0.004、0.001、0.030、0.020、0.003、0.007、0.010)。
2.3 各组Jurkat细胞OD值、存活率和凋亡率比较 与Jurkat组比较,miR-155 NC组OD值、存活率、凋亡率差异无统计学意义(P>0.05);与Jurkat组比较,miR-155 mimics组OD值、存活率升高,凋亡率降低,miR-155 inhibitor组OD值、存活率降低,凋亡率升高(P<0.05);与miR-155 mimics组比较,miR-155 inhibitor组OD值、存活率降低,凋亡率升高(P<0.05)。见表3、图1~2。

表3 各组Jurkat细胞OD值、存活率、凋亡率比较
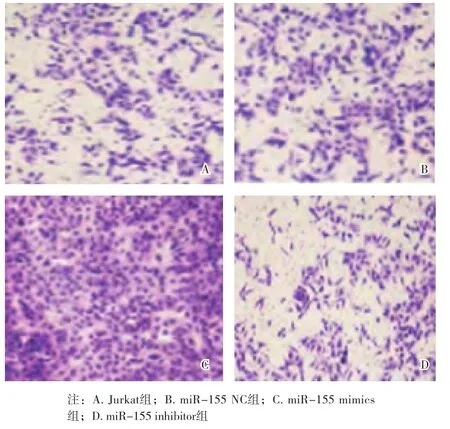
图1 各组Jurkat克隆形成数目比较
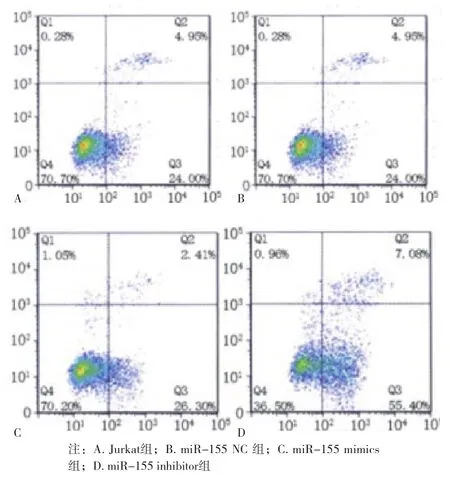
图2 各组Jurkat细胞凋亡率比较
2.4 各组Jurkat细胞miR-155、IL-21R mRNA表达水平比较 与Jurkat组比较,miR-155 NC组miR-155、IL-21R mRNA和蛋白无明显变化(P>0.05);与Jurkat组比较,miR-155 mimics组细胞miR-155、IL-21R mRNA和蛋白升高,miR-155 inhibitor组细胞miR-155、IL-21R mRNA和蛋白降低(P<0.05);与miR-155 mimics组比较,miR-155 inhibitor组细胞miR-155、IL-21R mRNA和蛋白降低(P<0.05)。见表4、图3。
表4 各组Jurkat细胞miR-155、IL-21R mRNA和蛋白表达比较()

表4 各组Jurkat细胞miR-155、IL-21R mRNA和蛋白表达比较()
注:与Jurkat组相比,*P<0.05;与miR-155 mimics组比较,#P<0.05
组别 复孔数 miR-155 mRNA IL-21R mRNA IL-21R蛋白(/GAPDH)Jurkat组 6 1.83±0.18 1.39±0.39 0.93±0.18 miR-155 NC 组 6 1.80±0.20 1.36±0.30 0.94±0.18 miR-155mimics组 6 3.92±0.20* 3.81±0.37* 1.28±0.17*miR-155inhibitor组 6 0.63±0.21*# 0.77±0.43*# 0.53±0.16*#

图3 各组Jurkat细胞IL-21R蛋白比较
3 讨论
AD是一种常见的慢性炎症性皮肤病,影响全世界约20%的儿童。该病表现出高度的病理生理异质性,导致相似的湿疹性皮肤病灶。皮肤组织中高水平表达的miR-155被鉴定为AD的组织标志物,这改善分子诊断。然而,当前诊断程序的侵入性、不便性限制其应用。因此,需要鉴定用于检测AD的新型非侵入性生物标志物。最近,据报道在无细胞血浆中检测到的miRNA可充当将患病个体与健康对照区分开的标记。由于血浆中miRNA的水平稳定,可重复在同一物种的个体中保持一致。血浆miRNA的非侵入性及其在疾病中的敏感性促使人们寻求更多的miRNA生物标志物。在血浆中已鉴定出约100种miRNA,这表明血浆miRNA包含多种疾病的信号,并可作为较多疾病的非侵入性诊断标记[10]。
MicroRNA(miRNA,miRs)是短的内源性非编码RNA,通过翻译抑制、mRNA失稳或这两种机制的组合抑制蛋白质编码基因的表达。miRNA在免疫稳态,淋巴谱系的发育和炎症反应中起重要的调节作用。miRNA的差异表达已在几种免疫和炎症疾病中得到证实。MiR-155在多种免疫细胞谱系表达[11](包括T淋巴细胞、B淋巴细胞、肥大细胞、成纤维细胞、巨噬细胞和树突状细胞),其中一些与慢性皮肤炎症的发病机制有关。有报道miR-155可以直接靶向促进IL-21R[12]。miRNA通过与带有互补位点的靶mRNA的3'非翻译区(UTR)结合而起作用。在人类中,根据生物信息学分析,IL-21R也是miR-155的靶基因,最近使用TaqMan低密度阵列(TLDA)研究表明,miR-155在AD病变中过表达,并主要在浸润的免疫细胞中表达。本研究显示,观察组miR-155、IL-21R mRNA水平高于对照组,且miR-155与TNF-α、IL-4、IL-21、TH21、IL-21R mRNA、hs-CRP、CD44正相关(P<0.05)。这与上述研究一致,同时也揭示miR-155、IL-21R在AD发病机制中具有重要调控作用。miR-155是AD皮肤中排名最高的miRNA之一(4.6倍上调)。研究表明,miR-155主要在浸润的皮肤免疫细胞中表达,特别是在CD4+T辅助细胞和树突状细胞中表达。Th21细胞是最近鉴定出的CD4+T辅助细胞亚群,通过产生有效的细胞因子IL-21R,在自身免疫以及炎症和过敏反应的发展中发挥关键作用[13-14],这些报道均与本研究结果一致。
本研究结果表明,与Jurkat组比较,miR-155 mimics组OD值、存活率升高、细胞凋亡率降低,miR-155 inhibitor组OD值、存活率降低、细胞凋亡率升高;与miR-155mimics组比较,miR-155inhibitor组OD值、存活率降低、细胞凋亡率升高(P<0.05),表明,miR-155能明显促进炎症细胞Jurkat增殖、抑制其凋亡。miR-155明显增加培养的CD4+T细胞中Th21细胞的百分比,并促进IL-21R的mRNA表达,以及无细胞上清液中IL-21R的蛋白浓度[15-16]。IL-21R是Janus激酶/信号转导子和转录激活子(JAK/STAT)信号通路的负调节剂,可调节T淋巴细胞的激活、发育和分化,并参与免疫和炎症性疾病。最近,通过表征IL-21R的模拟物,明确IL-21R对Th21细胞分化和功能的影响,IL-21R可促进IL-6诱导的STAT3活化并激活Th21细胞的发育[17-18]。本研究显示,与Jurkat组比较,miR-155 mimics组细胞miR-155、IL-21R mRNA和蛋白升高,miR-155 inhibitor组细胞miR-155、IL-21R mRNA和蛋白降低;与miR-155 mimics组比较,miR-155 inhibitor组单细胞miR-155、IL-21R mRNA和蛋白降低(P<0.05),这与前述讨论一致。同时也表明在炎症细胞Jurkat中,miR-155可能通过促进IL-21R的表达进而参与AD的发病机制。
综上所述,AD患者miR-155、IL-21R表达水平升高,miR-155可能通过促进IL-21R的表达进而参与AD的发病。

