糖尿病视网膜病变伴糖尿病肾病患者转录组学差异分析
陈建斌 刘颖 张华北 李志琛 何徐军 梅伟群 钱佳丽 欧阳建
糖尿病视网膜病变(DR)和糖尿病肾病(DN)是糖尿病(DM)常见的微血管并发症。随着全球糖尿病患病率的增加,DR和DN引起的视力丧失及肾功能衰竭严重危害患者的健康甚至生命。DM患者中,DR和DN同时或先后发生的比例较高,表明两者可能存在共同的发病机制。本研究采用转录基因组测序技术检测入组患者外周血白细胞,从中筛选DR伴DN差异表达基因,为进一步明确DR伴DN易感基因提供候选基因。
1 资料与方法
1.1 临床资料 选取2012年2月至10月联勤保障部队第903医院T2DM患者14例,其中6例不伴DN和DR纳入DM组,8例伴DR和DN纳入DNDR组。入选患者均符合1999年WHO糖尿病诊断标准[1]。DM组纳入标准:眼底照相除外DR,ACR<30 mg/g。DNDR组纳入标准:①依据2002年DR国际分期标准[2]。双眼眼底彩色照相检查符合中度以上非增殖性DR(NPDR)或增殖性DR(PDR);②依据2012年ADA筛查和诊断标准。即时尿标本的白蛋白/肌酐(ACR)>30 mg/gCr,且3个月内监测3次ACR至少有2次升高。排除标准:①T1DM、妊娠糖尿病和特殊类型糖尿病;②闭角型青光眼及葡萄膜炎患者;③除DR外的其他视网膜疾病;④高血压、冠心病、慢性阻塞性肺病、恶性肿瘤、脑卒中;⑤剧烈运动、发热、尿路感染、肾病综合征等其他原因导致ACR升高。两组患者糖化血红蛋白水平、病程、年龄差异均无统计学意义。本项目经联勤保障部队第903医院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法 (1)主要试剂及仪器:北京爱普华美生物科技有限公司对每份外周血白细胞样本进行RNA抽提、文库构建和质检,华大基因公司对转录组文库进行测序和数据质控。采用荧光定量PCR技术检测蛋白激酶C delta结合蛋白(PRKCDBP)基因、CD177抗原(CD177)基因的mRNA表达。RNase OUT™(5,000 U)(10777-019)、5X第一链缓冲液(18064-015)、5X第二链缓冲液(10812-014)、SuperScript III逆转录试剂盒(18064-014)、Trizol(15596026)、Dynabeads mRNA 纯化试剂盒(610-06)、苯酚/氯仿/异戊醇(15593-31)购自美国Invitrogen公司;Phusion DNA聚合酶(F-531L)、外切核酸酶1(M0293S)、DNA连接酶(M2200L)均购自美国NEB公司;红细胞裂解液(批号RT122-02Lot//N2214)购于杭州开泰生物技术有限公司;dNTPs混合物(BF7801A)、荧光定量PCR试剂盒TB Green®Premix Ex Taq™ II(TliRNaseH Plus)购自日本TaKaRa公司;GAPDH引物、CD177、PRKCDBP均购自上海生工生物工程技术服务有限公司。PTC-100型PCR仪购自美国BIO-RAD公司;凝胶成像系统(Tanon)购自上海天能科技有限公司;紫外线分光光度仪(nanodrop1000)购自美国Thermo Fisher Scientific公司;安捷伦2100生物分析仪购自美国Agilent公司。(2)白细胞分离:空腹采集患者外周血,加入装有抗凝剂(乙二胺四乙酸二钾,EDTA-K2)的血常规管中。离心后沉淀部分加入红细胞裂解液,期间再颠倒混匀几次,沉淀中加入1 mL Trizol试剂,分离后的白细胞分装,放置冰箱保存。(3)RNA提取、反转录和转录组测序:采用RNA提取试剂盒提取总RNA,nanodropRNA质检和安捷伦2100生物分析仪检测RNA完整度,然后进行测序。(4)转录组测序数据的过滤和评估:由Illumina HiSeq TM 2000测序所得的数据为raw reads。通过软件得到clean reads,并进行质控。(5)基因表达注释和定量:将clean reads比对到参考基因组和参考基因序列,统计其分布情况及覆盖度。利用每个碱基长度reads数计算基因表达量。(6)GO以及Pathway显著性富集分析:基因本体(GO)包括3个本体:分别描述参与的生物过程GO-P、所处的细胞位置GO-C、分子功能GO-F。应用超几何检验,再通过富集分析确定差异基因的主要生物学功能。通过生化代谢与信号转导通路(Pathway)显著性富集分析确定差异基因参与的主要生化代谢和信号转导途径。(7)基因相互作用网络分析:对差异表达基因、直接相互作用的基因进行基因互作网络分析。(8)RT-qPCR验证:实时荧光定量PCR(RT-qPCR)检测PRKCDBP、CD177的mRNA相对表达量。同时绘制熔解曲线,采用2-ΔdΔCT法计算目的基因的相对表达量。引物序列如下:PRKCDBP-forward:5'-CACGTTCTGCTCTTCAAGGAG-3',PRKCDBP-reverse:5'-TGTACCTTCTGCAATCCGGTG-3';CD177-forward:5'- CGGCAATGGACCCCTAAGAAC-3',CD177-reverse:5'- AACGAGGTTGTTGCAGAAGTC-3';GAPDH-forward:5'- CTGGGCTACACTGAGCACC-3',GAPDHReverse:5'- AAGTGGTCGTTGAGGGCAATG-3'。
1.3 统计学方法 采用SPSS20.0统计软件。取DM及DNDR组基因表达量的均数(mean)和中位数(median),分别计算两组间各个基因相应的ratio值。差异表达基因的设定标准为mean和median倍数上下调均≥2.0倍。PRKCDBP和CD177mRNA表达量以()表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 质控结果 nanodropRNA质检和安捷伦2100检测14份样本RNA质量均合格,采用RNA-seq和qPCR定量两种方法对转录组文库质检均合格。全部样本数据过滤后Q20比例均>93.9%,GC含量为46.61%~49.15%,clean reads比例平均占raw reads的>97%,测序数据良好。reads在基因覆盖度以及参考序列上的分布情况均合格,可用于后续分析。
2.2 差异表达基因 与DM组比较,DNDR组所筛选出的差异表达基因98个,上调42个,下调56个。见表1。
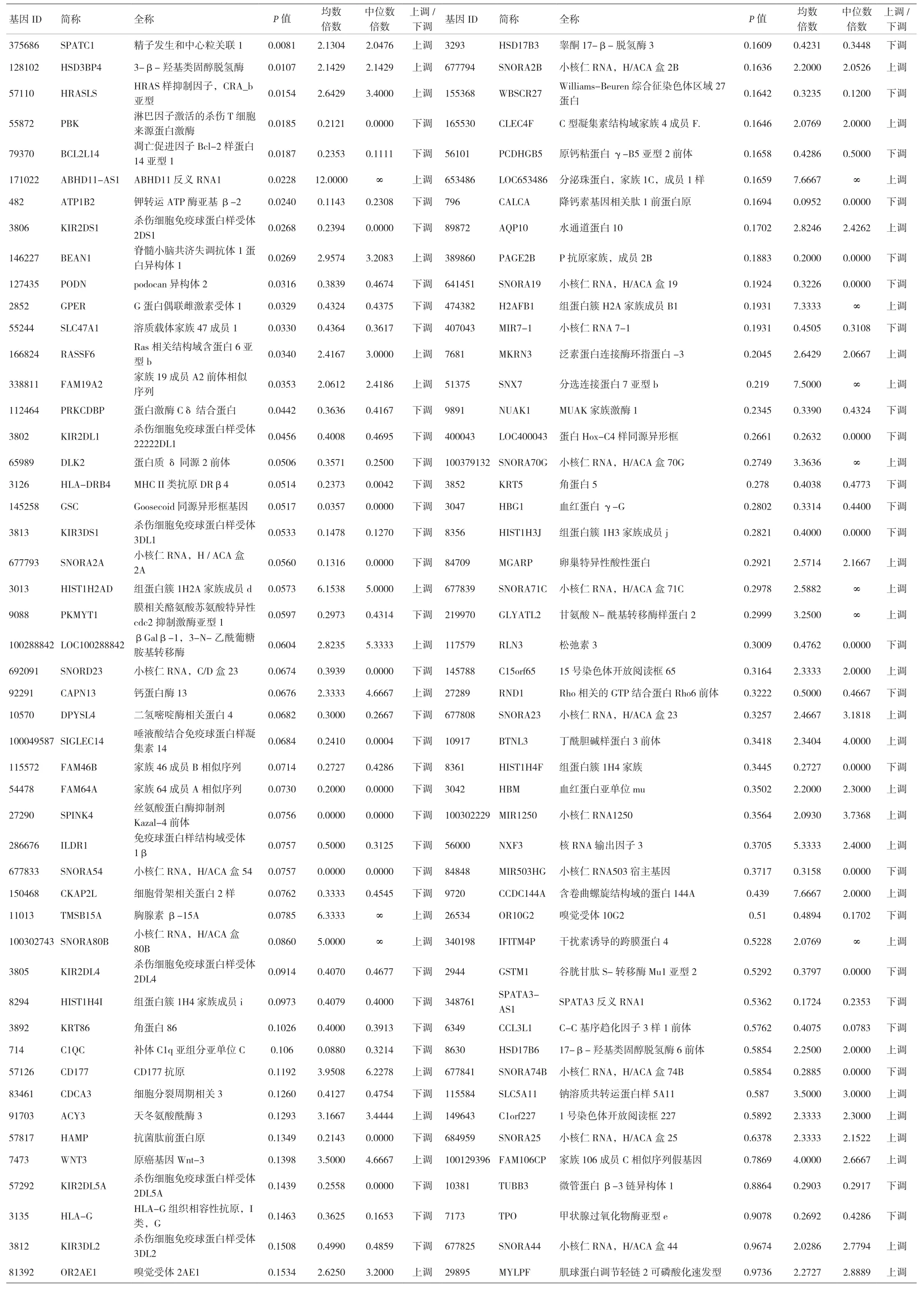
表1 DRDN与DM组比较差异表达基因
2.3 GO注释和富集分析结果 见图1。
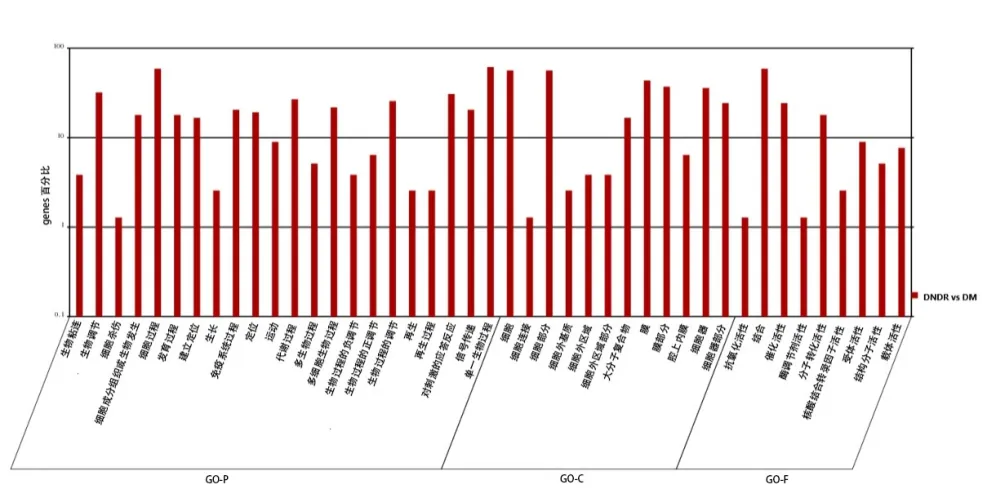
图1 差异基因本体分析
2.4 Pathway显著性富集分析 差异表达基因参与77条Pathway(图2结果显示富集到差异基因最多的前20条Pathway),其中最显著的为移植物抗宿主病、系统性红斑狼疮以及抗原处理和递呈。上调最明显的ABHD11反义 RNA 1(ABHD11 antisense RNA 1,ABHD11-AS1)未富集到相关Pathway,下调最明显的丝氨酸肽酶抑制剂Kazal 4前体(SPINK4)参与ECM-受体相互作用(ECM-receptor interaction)Pathway。
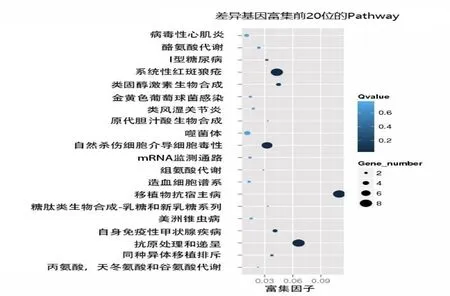
图2 前20 pathway富集分析图
2.5 差异基因相互作用网络分析 差异基因对应的蛋白相互作用网络,PDZ结合激酶(PBK)与蛋白激酶C delta结合蛋白(PRKCDBP)、Ras关联域家族成员6(RASSF6)相互作用。KIR2DL1与KIR2DS1存在相互作用。见图3。
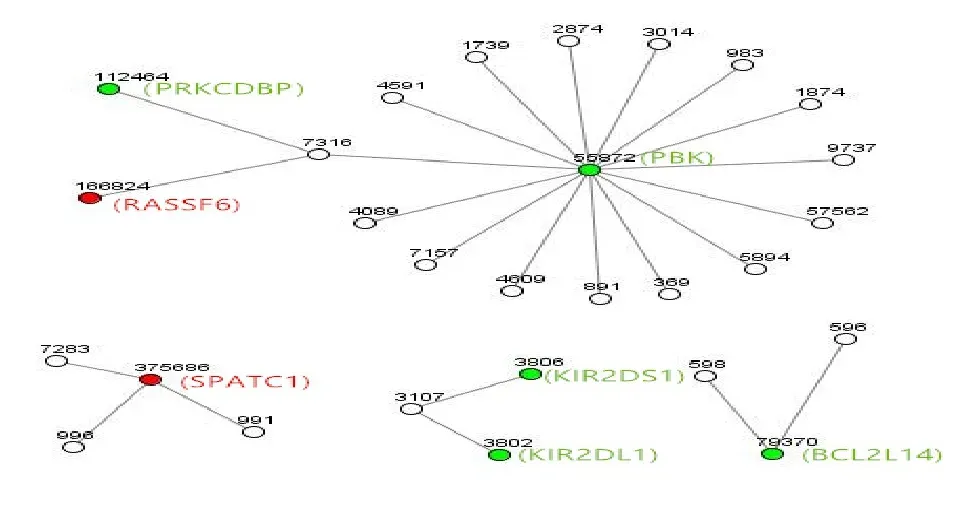
图3 基因相互作用网络分析图
2.6 PRKCDBP和CD177mRNA表达RT-qPCR检测结果 DNDR组PRKCDBPmRNA表达量低于DM组,DNDR组CD177的mRNA表达量高于DM组,差异均有统计学意义(P<0.05)。见图4。
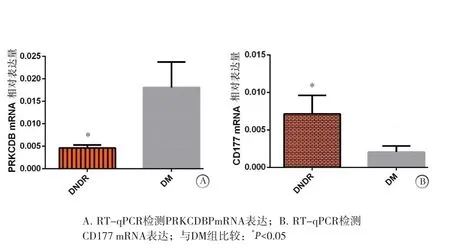
图4 2组PRKCDBP和CD177 mRNA表达比较
3 讨论
糖尿病发病率逐年升高,严重威胁人类健康,我国约20%~40%的DM患者合并DN[3],而糖尿病患者中约有1/3 出现糖尿病视网膜病变症状[4]。研究发现,严格控制血糖可降低DR和DN的发生风险,但不能完全阻止其发生和进展[5]。临床观察显示,部分DM患者持续高血糖但不发生微血管并发症,而部分DM患者病程较短,血糖控制良好,却发生严重的DR和DN。在单卵双生双胞胎中,DR和DN的患病率一致[6],表明遗传因素在DR和DN发病中具有重要作用。
本研究共筛选出98个DNDR差异表达基因,为进一步验证DRDN易感基因提供了候选基因。差异基因相互作用网络分析显示多个差异基因之间存在相互作用,富集性分析发现一个基因可以参与多个GO或Pathway,也可以多个基因参与一个GO或Pathway,表明DNDR发生发展是多基因相互作用的结果。
KIR2DL1、KIR2DS1通过自然杀伤细胞介导的细胞毒性调节NK细胞活性,在抗原处理与提呈过程中发挥作用。有文献报道,活化的KIR2DS1受体与自身免疫性疾病[7],病毒感染的控制[8]、恶性肿瘤[9]等有关。KIR2DL1是NK细胞表面主要的抑制性因子,PARHAM等[10]发现,KIR2DL1识别KG1A细胞株表面HLA-C2表型,可抑制NK细胞对KG1A细胞的杀伤活性。KIR2DL1作为NK细胞表面主要的抑制性因子,在各种恶性肿瘤免疫效应中发挥重要作用。SHASTRY等[11]研究发现,KIRs与糖尿病易感性相关且存在种族差异。在拉脱维亚成人患者中,KIRs 2DL1、2DS2和2DS4是易感因子,2DS5是保护因子;而在印度成人患者中,KIRs 2DL5和3DL1是易感因子,2DS1和2DS3是保护因子。本研究中DNDR组KIR2DL1、KIR2DS1下调,KIR2DL1、KIR2DS1与DR伴DN之间的关系仍需进一步验证。
文献报道,上调最明显的ABHD11-AS1基因主要与肿瘤有关[12-13],下调最明显的丝氨酸肽酶抑制剂Kazal 4型(SPINK4)参与ECM-受体相互作用(ECM-receptor interaction)的Pathhway SPINK4在乳糜泻(CD)患者中显示差异基因表达,在未治疗患者中最高,在无谷蛋白饮食开始时急剧下降,与CD病理改变相关的差异基因表达,可能来自杯状细胞活性的改变[14]。PIETZ等[15]发现活动性CD的肠上皮细胞中SPINK4显著上调,活动性CD中,SPINK4和抗微生物凝集素1(ITLN1)的表达水平的显著增加表明对细菌的先天免疫。研究揭示下调最明显的SPINK4与炎症过程有关,而在DNDR发病机制中的作用仍待深入研究。
PRKCDBP,又称为细胞膜穴样内陷相关蛋白3(CAVIN3),通过CAVIN1靶向细胞膜穴样内陷,与窖蛋白1(caveolin1)的支架结构域相互作用并促进细胞膜穴样内陷动力学[16],CAVIN3缺失减少平滑肌中细胞膜穴样内陷的数量,且部分使CAVIN1不稳定,使血管对一氧化氮的敏感性升高,在严重细胞应激的情况下干扰高尔基体内稳态。ZHU等[17]研究发现,CAVIN3有助于体内平滑肌中细胞膜穴样内陷的形成。CAVIN3消融使平滑肌细胞中细胞膜穴样内陷的密度降低40%~45%,而内皮细胞保持细胞膜穴样内陷丰度。PRKCDBP是一种推定的肿瘤抑制因子,已经在几种癌症中观察到改变[18],也有研究发现与溃疡性结肠炎(UC)有关,PRKCDBP被鉴定为响应肿瘤坏死因子(TNF)-α而被核因子-κB激活。PRKCDBP的黏膜表达与UC患者中的TNF-α表达强烈相关,且IFX治疗导致PRKCDBP和TNF-α的显著降低。因此,这些发现支持PRKCDBP表达受TNF-α严格控制,且IFX的抗炎作用可能部分源于阻断TNF-αPRKCDBP信号传导途径[19]。本研究中PRKCDBP明显下调,其对DR、DN的影响是否与血管平滑肌内陷或炎症作用有关需进一步研究。
编码分泌信号蛋白结构的相关基因组成了WNT基因家族。WNT3通过激活WNT-β-catenin信号通路参与肿瘤发生,WANG等[20]发现胃癌中的WNT3表达显著升高,表明上调的WNT3可以通过诱导癌细胞的增殖、侵袭和迁移,并通过抑制癌细胞的凋亡在胃肿瘤发生中起关键作用。研究发现[21]WNT3可通过WNT3α/β-catenin信号通路影响足细胞,可能与肾病有关。ZHOU等[22]报道,WNT信号通路在年龄相关性黄斑变性和DR动物模型的视网膜和视网膜色素上皮细胞中被激活,诱导血管生成和炎症因子的过量产生。另一方面,由经典WNT途径的激活诱导ROS产生可能通过NF-B途径促成炎性因子的过表达,反过来炎性因子的过度表达加剧炎症的发展,经典WNT途径的激活诱导视网膜炎症和氧化应激,在DR中发挥致病作用,本研究中WNT3上调,上述机制是否参与其在DR、DN发病中的作用需进一步探讨。
CD177是由可变比例的人嗜中性粒细胞表达的糖基磷脂酰肌醇锚定蛋白,其介导抗中性粒细胞胞质抗体(ANCA)抗原蛋白酶3的表达,D177与β2整联蛋白结合并识别血小板内皮细胞黏附分子[23]。在抗中性粒细胞胞浆抗体相关的系统性血管炎(AASV)患者中发现膜表达蛋白酶3(PR3)的增加依赖于CD177表达,并且与CD177基因的转录相关,中性粒细胞亚群向MPR3+/CD177+表型转变与成熟中性粒细胞过度产生CD177有关,表明CD177在中性粒细胞迁移中的作用。成熟的MPR3和CD177在包括AASV患者在内的所有个体的中性粒细胞质膜上共同表达。AASV和SLE患者的中性粒细胞中,MPR3+/CD177+表型以及PR3和CD177的mRNA表达增加[24],以上研究表明CD177与炎症有关。本研究中DNDR组CD177表达上调,其在DR、DN发病中的作用是否与其致炎症作用有关,需进一步证实。

