MCT1在预测肝细胞癌患者预后中的作用研究
韩 晟,周锦仁,邵 青,戴新征,古 鉴
南京医科大学第一附属医院肝胆中心,中国医学科学院肝移植重点实验室,江苏 南京 210029
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤。除了手术切除和肝移植外,针对HCC的抗肿瘤药物治疗效果有限,患者预后较差[1]。调节性T 细胞(Treg)是一类具有免疫调节功能的T细胞亚群,在肿瘤中可观察到明显升高的Treg 浸润,这类细胞可通过多种途径抑制效应性细胞激活,诱导肿瘤免疫逃逸[2-4]。近年来文献表明,肿瘤代谢产物乳酸在调控肿瘤内Treg 功能方面具有核心作用[5],而单羧酸转运蛋白1(monocarboxylate transporter,MCT1)是肿瘤环境中最重要的乳酸转运载体[6]。本研究以南京医科大学第一附属医院行肝切除术的HCC 患者作为研究对象,探讨MCT1 表达水平在HCC预后评估中的作用和可能机制。
1 材料和方法
1.1 材料
为探讨MCT1 在HCC 预后评估中的作用,团队收集了2018 年于南京医科大学第一附属医院行肝部分切除术的43 例HCC 患者的肝癌组织与癌旁组织标本。为分析HCC 患者免疫细胞对乳酸的反应活性以及MCT1 表达水平对Tregs 分化和功能的影响,收集了2021年于南京医科大学第一附属医院行肝部分切除术的10 例患者的肝癌组织与癌旁组织标本以及外周血标本,所有患者均有完整病历临床资料并签署知情同意书,所有程序均符合南京医科大学伦理委员会研究伦理委员会的伦理标准(SYXK2018⁃0020)。
纳入标准:①经临床综合检查,符合HCC 诊断标准;②手术前有明显的炎症感染;③截至目前有完整的随访资料。排除标准:①免疫系统疾病或感染性疾病;②合并其他肿瘤;③手术治疗前曾接受其他抗肿瘤治疗(介入、药物、放疗等)。
1.2 方法
1.2.1 RT⁃PCR
根据说明书,利用RNA提取试剂盒提取组织中的总RNA,逆转录得到cDNA。根据试剂盒说明书配置25 μL 反应体系,包括逆转录产物2 μL,上、下游引物各1 μL,Taq 酶0.2 μL,2×Buffer 12.5 μL,ddH2O 8.3 μL。反应条件:95 ℃预变性5 min;95 ℃变性20 s,62 ℃退火并延伸1 min,循环40 次;72 ℃总延伸5 min。
相关引物序列设计如下:MCT1,Forward Prim⁃er:5′⁃CAATGCCACCAGCAGTTG⁃3′,Reverse Prim⁃er:5′⁃GCAAGCCCAAGACCTCCAAT⁃3′;Foxp3,For⁃ward Primer:5′⁃GTGGCCCGGATGTGAGAAG⁃3′,Re⁃verse Primer:5′⁃GGAGCCCTTGTCGGATGATG⁃3′;CTLA4,Forward Primer:5′ ⁃ CATGATGGGGAAT⁃GAGTTGACC⁃3′,Reverse Primer:5′⁃TCAGTCCTTG⁃GATAGTGAGGTTC⁃3′;IL⁃10,Forward Primer:5′⁃ATAAAAGGGGGACACCGGGC⁃3′,Reverse Primer:5′⁃CTCATAACCCATGGCTTGGC⁃3′。
1.2.2 流式细胞仪检测
运用Ficoll 淋巴细胞分离液从肝素抗凝静脉血中提取PBMC,加入抗CD4、CD8、CD25、CD127 等流式抗体,运用流式细胞仪检测外周血细胞分型差异。PBMC 在进行表面染色后,PBS 洗涤2 次,加入固定剂固定,破膜剂打孔后,离心弃上清液后进行胞内Foxp3染色。4 ℃孵育30 mins后PBS洗涤并上机检测。流式图像和数据采用Flowjo software处理。
1.2.3 乳酸处理和Treg诱导效率检测
运用磁珠分选仪(美天旎公司,德国)分选CD4+CD45RA+T 细胞,流式细胞仪检测所得细胞纯度(>97%),随后在CD4+CD45RA+T细胞中加入抗CD3/CD28 扩增磁珠(1 磁珠∶3 细胞),TGF⁃β(20 ng/mL)和IL⁃2(100 U/mL)培养7 d,运用流式检测技术分析Treg诱导的情况。
1.3 统计学方法
应用SPSS21.0统计软件,对于计数资料的组间比较使用χ2检验,数值变量资料的组间比较使用t检验。生存分析采用Kaplan⁃Meier法进行分析并进行Log⁃rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 HCC患者外周T细胞MCT1高表达导致Treg分化倾向
为研究MCT1 基因的表达差异与患者T 细胞分化以及Treg功能的关系,收集了因HCC行肝切除患者的肿瘤与癌旁标本以及外周血,并统计和整理了相应的临床信息。通过qPCR检测比较肿瘤与癌旁表达MCT1的mRNA比率,随后通过MCT1表达的高低将患者人为进行排序,分为MCT1 高表达组和MCT1低表达组(图1A)。运用流式细胞技术检测各患者的外周血分型,结果显示无论是CD4+T、CD8+T细胞抑或是CD4+CD25+CD127-Treg 细胞,均无明显差异(图1B、C)。实际上,肿瘤微环境与外周血存在明显差异,而近年研究显示,糖酵解的发生和乳酸沉积是肿瘤微环境的重要组成部分[7-9]。因此,通过对naïve T 细胞进行乳酸处理来模拟肿瘤微环境。运用10 nmol/L 乳酸处理各组CD4+CD45RA+naïve T 细胞后,观察到添加乳酸明显升高MCT1 高表达组的Foxp3表达,提示MCT1基因高表达患者的T细胞更易向Treg 转化(图1D)。为了研究MCT1 在其中发挥作用的可能机制,检测了两组中MCT1 蛋白的表达情况,结果显示,MCT1 基因高表达患者的MCT1蛋白表达水平在乳酸作用环境下明显升高(图1E),而在MCT1 基因低表达患者组差异不明显。最后,在MCT1基因高表达患者的Treg诱导环境中加入乳酸和MCT1 抑制剂,结果显示,虽然乳酸可以提高Treg 的分化,但是MCT1 抑制剂处理可逆转乳酸对Foxp3表达的促进作用(图1F)。
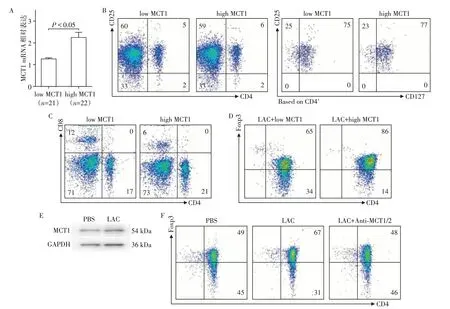
图1 HCC患者外周T细胞MCT1高表达导致Treg分化倾向Figure 1 High expression of MCT1 in peripheral T cells of HCC patients leads to Treg differentiation tendency
2.2 MCT1 高表达的HCC 中免疫细胞增殖频率降低而免疫抑制因子的表达上调
接下来进一步分析HCC 患者的肿瘤组织切片。分析结果显示,MCT1 高表达HCC 组织中浸润着较低频率增殖的免疫细胞,而MCT1 低表达的HCC 组织中浸润着大量活性免疫细胞,提示较好预后(图2A)。除此以外,qRT⁃PCR 检测显示高表达MCT1 的HCC 内免疫抑制因子如Foxp3、CTLA4、IL⁃10 的表达显著上调,提示MCT1 的高表达促进HCC 免疫微环境内免疫抑制因子的转录从而抑制免疫细胞的浸润,导致HCC 疾病进展和预后加重。

图2 MCT1高表达的HCC中免疫细胞增殖频率降低而免疫抑制因子的表达上调Figure 2 In HCC with high MCT1 expression,the frequency of immune cell proliferation is reduced while the expression of immunosuppressive factors is up⁃regulated
2.3 MCT1是HCC预后不良的标志物
由于肿瘤微环境中乳酸通过MCT1进入免疫细胞发挥调节细胞分化与功能的作用[10-11],本研究评估了乳酸与MCT1 在评价和预测HCC 预后中的作用。使用表1方案,分析了2018年接受HCC切除手术的43例患者的肿瘤组织标本,分别将患者分为高乳酸组和低乳酸组或高MCT1 高表达和MCT1 低表达组(表1)。入组43例患者中,MCT1高表达患者的甲胎蛋白(AFP)明显高于MCT1 低表达组,但是其他指标,如肿瘤大小、微血管癌栓发生率等无明显差异。本研究分析了不同分组的总生存期(overall survival,OS)和无病生存期(disease free survival,DFS)。结果显示,与乳酸水平较高的患者相比,乳酸水平较低的患者的OS 率略低。但总体而言,OS和DFS 分析无明显差异(图3A)。正如预期的那样,与较低MCT1组相比,具有较高MCT1 的患者在OS和DFS率方面显示了不良的预后结果(图3B)。
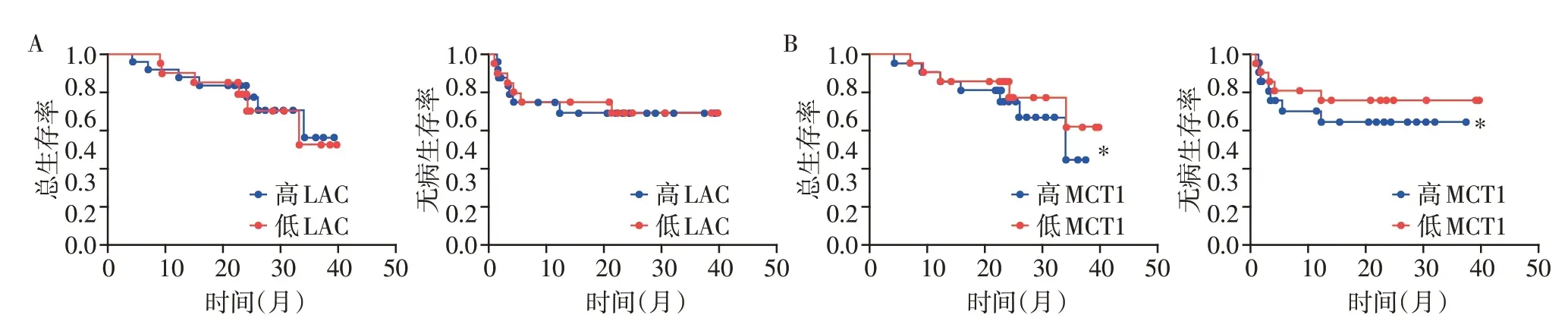
图3 MCT1 是HCC预后不良的标志物Figure 3 MCT1 is a poor prognostic marker of HCC

表1 HCC中MCT1表达与临床指标的相冯性Table 1 The correlation between MCT1 expression in HCC and clinical indicators
3 讨论
HCC是一种起源于肝细胞的致命恶性肿瘤,是目前世界上第二大癌症相关死亡原因[12]。全球每年报告850 000例HCC新发病例和745 500例死亡,而中国发生466 000 例HCC 新发病例和422 000 例死亡。由于HCC被发现时往往已严重进展,只有10%~15% 的患者具备手术切除的指征。目前,原发性HCC 的治疗方法多种多样;除了根治性手术切除外,还包括新型多靶点抗肿瘤药物、联合化疗、经动脉化疗栓塞、射频消融、无水酒精注射等[13]。
Treg在抑制免疫细胞的抗肿瘤反应过程中起核心作用[14-15],Treg 升高既可抑制具备杀伤毒性的CD8 T细胞的功能,而且能够抑制NK等杀伤细胞的肿瘤杀伤作用[16-17]。最近研究表明,肿瘤代谢物乳酸在调节肿瘤免疫微环境中至关重要[18],目前报道的作用主要集中在乳酸调节Treg和巨噬细胞上[19-20]。乳酸可以调节TME中Treg的细胞数量、抑制功能和代谢方式[21-23];而乳酸作用于细胞的机制主要依赖MCT1作为载体的转运作用[6,24]。MCT1是一种转运蛋白,主要在细胞膜上具有功能活性,在包括乳腺癌、肝癌等多种人类癌症中普遍高表达,可以增加肿瘤细胞的乳酸转运[25-27]。在HCC 中,MCT1 的乳酸转运作用受到WNT⁃β⁃catenin 信号调控[25]。基于以上研究基础,本研究以探究MCT1 依赖其调控乳酸转运的能力影响HCC 进展和预后的具体作用及相应机制为目的。
本研究结果表明,在非乳酸环境下(外周血),T细胞以及Treg细胞的分化和表型没有差异;但是乳酸处理下,MCT⁃1高表达组的Treg获得明显提升,该结果提示MCT⁃1高表达组通过增加MCT1可以在肿瘤微环境下提高对乳酸的摄取,进而提高Treg的分化以及下游的免疫逃逸。运用MCT 抑制剂处理可以废除乳酸对Treg的提升作用,进一步证实这种调节Treg 的作用依赖MCT1 通路的激活。在图2 中,在组织标本中发现MCT1低表达组较高表达组存在更多的免疫细胞浸润,已有报道,免疫细胞浸润可以促进更多的抗肿瘤T 细胞在肿瘤内增殖,是免疫细胞激活和抗肿瘤效果较好的标志,预示着较好的预后[2,28];本文猜想,MCT1 高表达的肝脏中存在大量Treg等免疫抑制细胞,他们可以抑制周边的免疫细胞激活和增殖,进而阻断抗肿瘤免疫反应。通过qRT⁃PCR 检测也观测到了MCT 浸润的HCC 肝脏中浸润大量的免疫抑制因子以及Treg 相关因子如Foxp3、CTLA4、IL⁃10 的表达,进一步证实了上述想法。最后,由于本课题组前期研究的患者均为2021年入院手术患者,为了评估MCT1 对HCC 患者远期预后的影响,分析了2018年行肝癌切除的患者组织样本43 例,并进一步检测了乳酸和MCT1 的表达与预后的关系。结果发现,MCT1 高表达组而不是乳酸高表达组与预后相关。本研究结果表明,即便乳酸在HCC 中堆积高表达,如果不能通过MCT1 作为载体转运进入免疫细胞,则不能发挥免疫调节作用,从而促进肿瘤逃逸。
综上所述,本研究通过细胞结合组织标本并依据临床数据从多方面探讨了HCC中MCT1表达与患者预后的关联,研究证实乳酸调控依赖MCT1 通路促进Tregs,并支持MCT1表达作为HCC患者预后的预测标志物,提示MCT1 高表达的HCC 患者具有较差的生存预后。

