肿瘤相关巨噬细胞亚型在子宫内膜癌中的表达和意义
葛素梅,强 贤*,程羽青,欧阳俊,刘孟璐
1南京医科大学附属常州市妇幼保健院病理科,江苏 常州 213003;2南京医科大学附属常州市第二人民医院病理科,江苏常州 213003
子宫内膜癌是子宫内膜发生的常见的恶性上皮性肿瘤,发病率在我国女性生殖系统恶性肿瘤居第2位,其病死率是妇科恶性肿瘤的第3位,严重威胁女性身体健康[1-2]。流行病学研究表明[3],子宫内膜癌的发生与胰岛素抵抗/代谢综合征、非甾体激素、炎症等因素有显著相关性。炎症微环境是子宫内膜癌重要的局部特征之一。近年来研究表明,肿瘤的发生与发展受到肿瘤微环境的影响,肿瘤微环境中主要浸润的炎症细胞为肿瘤相关巨噬细胞(tu⁃mor associated macrophage,TAM),其功能和表型受肿瘤微环境的影响,可分为经典活化型(M1)和替代活化型(M2型)两类。M1巨噬细胞被认为能够通过分泌高水平的促炎细胞因子杀灭病原体和肿瘤细胞,相反,M2 巨噬细胞可以抑制免疫反应和促进肿瘤的发展[4]。TAM是子宫内膜癌间质中一类非常重要的细胞群。目前中文文献中尚无研究探讨TAM与子宫内膜癌的临床病理特征和预后之间的关系,本研究检测TAM 标志物CD163、CD68 蛋白在子宫内膜癌和正常增生期子宫内膜中的表达水平,并分析其表达与子宫内膜癌临床病理特征及生存期的关系,为进一步明确子宫内膜癌的发生发展与TAM的关系提供研究基础。
1 对象和方法
1.1 对象
收集南京医科大学附属常州市妇幼保健院病理科2010 年1 月—2015 年12 月手术切除的子宫内膜癌标本46 例作为观察组,所有患者术前均未行放、化疗及激素治疗,均有完整的临床病理资料,包括患者年龄、病理组织学分级、浸润宫体肌层深度,病理学类型、区域淋巴结有无转移、FIGO分期、术后生存时间等。46 例子宫内膜癌患者年龄36~75 岁,中位年龄53岁,其中Ⅰ型子宫内膜样腺癌36例,Ⅱ型癌包括浆液性癌和透明细胞癌共10例。FIGO分期:Ⅰ期共32例,Ⅱ~Ⅳ期14例;组织学分级:G1/G2级30例,G3级16例;浸润肌层深度<1/2有21例,≥1/2有25例;有淋巴结转移9例,无淋巴结转移37例。所有切片均经2 名高年资病理医师阅片,子宫内膜癌的组织学分类及分级参照WHO(2014)女性生殖器官肿瘤分类,临床分期参照FIGO(2009)分期。以同期就诊的25 例非肿瘤内膜组织作为对照组。随访时间从手术后至2020年12月。
1.2 方法
免疫组化染色采用SP法,所有标本均经10%中性福尔马林及时固定,石蜡包埋,4 μm厚切片,枸橼酸(pH 6.0)热抗原修复,一抗稀释(1∶1 000),4 ℃过夜,二抗室温30 min。以PBS 代替一抗作为阴性对照,阳性对照选取相应的组织标本。CD163抗体(克隆号10D6)和CD68 抗体(克隆号PG⁃M1)均购自北京中杉金桥有限公司,LEICA BOND⁃MAX平台。
阅片和计数由2位高年资病理医师进行双盲法观察分析,CD68 阳性表达位于细胞质,CD163 阳性表达位于细胞质及细胞膜,以棕黄色或黄褐色颗粒状染色为阳性表达。组织切片后,判读肿瘤内部和肿瘤浸润前沿的TAM,先在低倍镜(×100)下找到TAM 密集区域,然后转至高倍镜(×400)下观察,随机选取5 个视野计数TAM。以TAM 计数的中位数为分界点,分为高表达组和低表达组[5]。其中CD163+巨噬细胞数>57 个/400 倍镜为高表达。CD68+巨噬细胞数>86 个/400 倍镜为高表达。同时将CD163/CD68 比值以其中位数(0.635)为界,分为高比值组和低比值组。
1.3 统计学方法
实验数据采用SPSS16.0软件进行统计学处理,CD163、CD68蛋白在子宫内膜癌和正常子宫内膜间表达差异采用t检验,子宫内膜癌各组间表达差异及其与临床病理特征的关系采用χ2检验,生存分析用Kaplan⁃Meier 法,Log⁃rank 检验比较生存差异。P<0.05为差异具有统计学意义。
2 结果
2.1 TAM 在子宫内膜癌和正常增生期子宫内膜中的表达
巨噬细胞浸润数量方面,非肿瘤子宫内膜组织中CD163计数为15~30个(中位值20),CD68计数为20~35 个(中位值25),子宫内膜癌组织CD163 计数为35~115 个(中位值57),CD68 计数为58~131 个(中位值86)。两组之间差异具有统计学意义(P=0.000 1,P<0.05)。巨噬细胞浸润部位方面,增生期子宫内膜中的巨噬细胞仅仅见于子宫内膜间质,子宫内膜癌中的巨噬细胞不仅出现在间质,而且在子宫内膜癌腺腔内和癌巢浸润前沿都有大量的巨噬细胞浸润(图1A~F)。
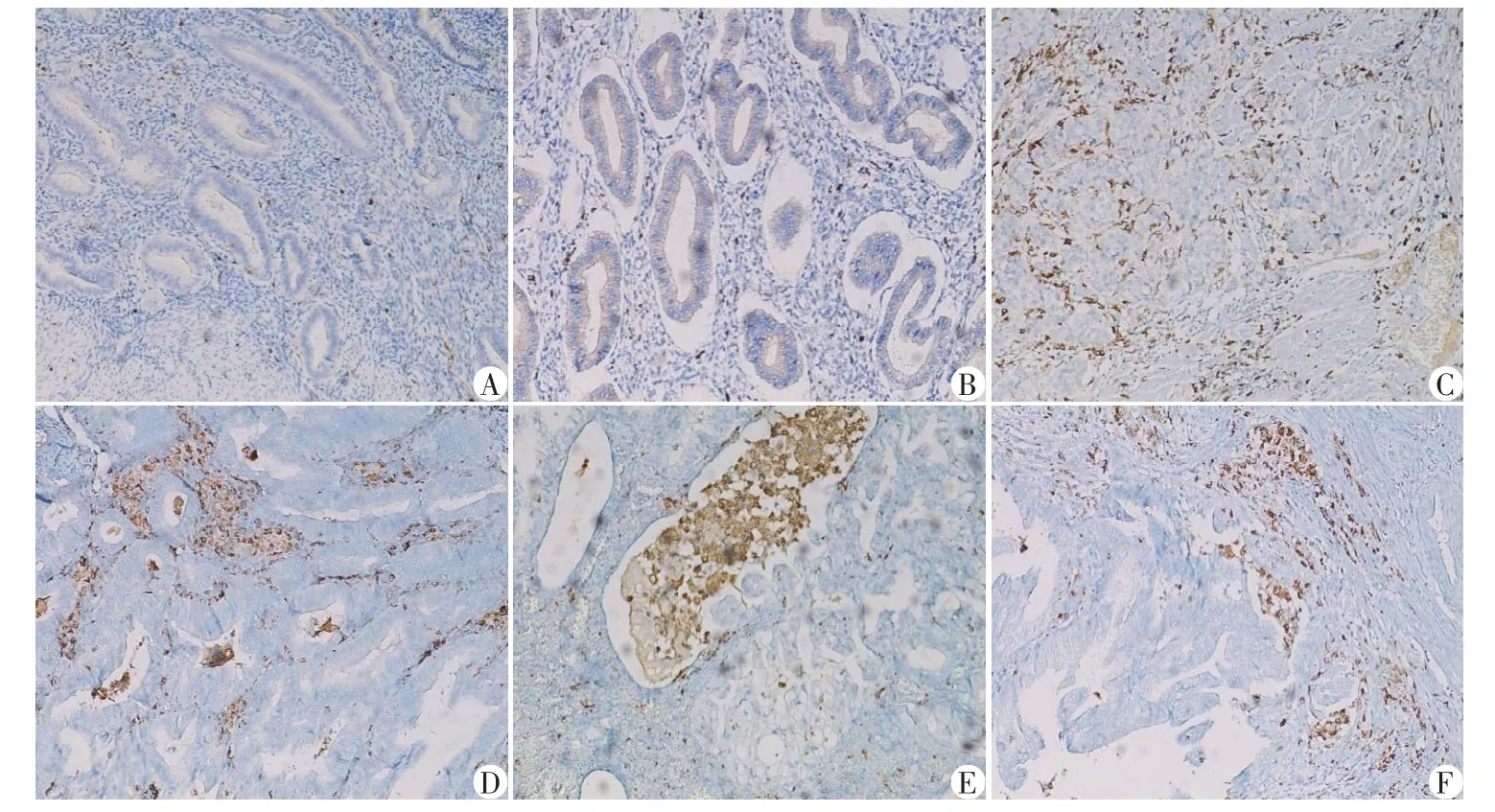
图1 CD163、CD68在增生期子宫内膜和子宫内膜癌中的表达(×100)Figure 1 Expressions of CD163 and CD68 in proliferative endometrium and endometrial cancer(×100)
2.2 TAM与子宫内膜癌临床病理参数的关系
CD163 的表达与患者年龄、病理类型和肌层浸润深度无关(P>0.05),CD68的表达与患者年龄、病理学分级、病理类型、淋巴结转移无关(P>0.05)。CD163的表达与病理学分级、有无淋巴结转移和FI⁃GO分期显著相关(P<0.05),CD68的表达与宫体肌层浸润和FIGO 分期显著相关(P<0.05),CD163/CD68 比值与患者年龄、病理学分级、淋巴结转移和FIGO分期显著相关(P<0.05,图2,表1)。
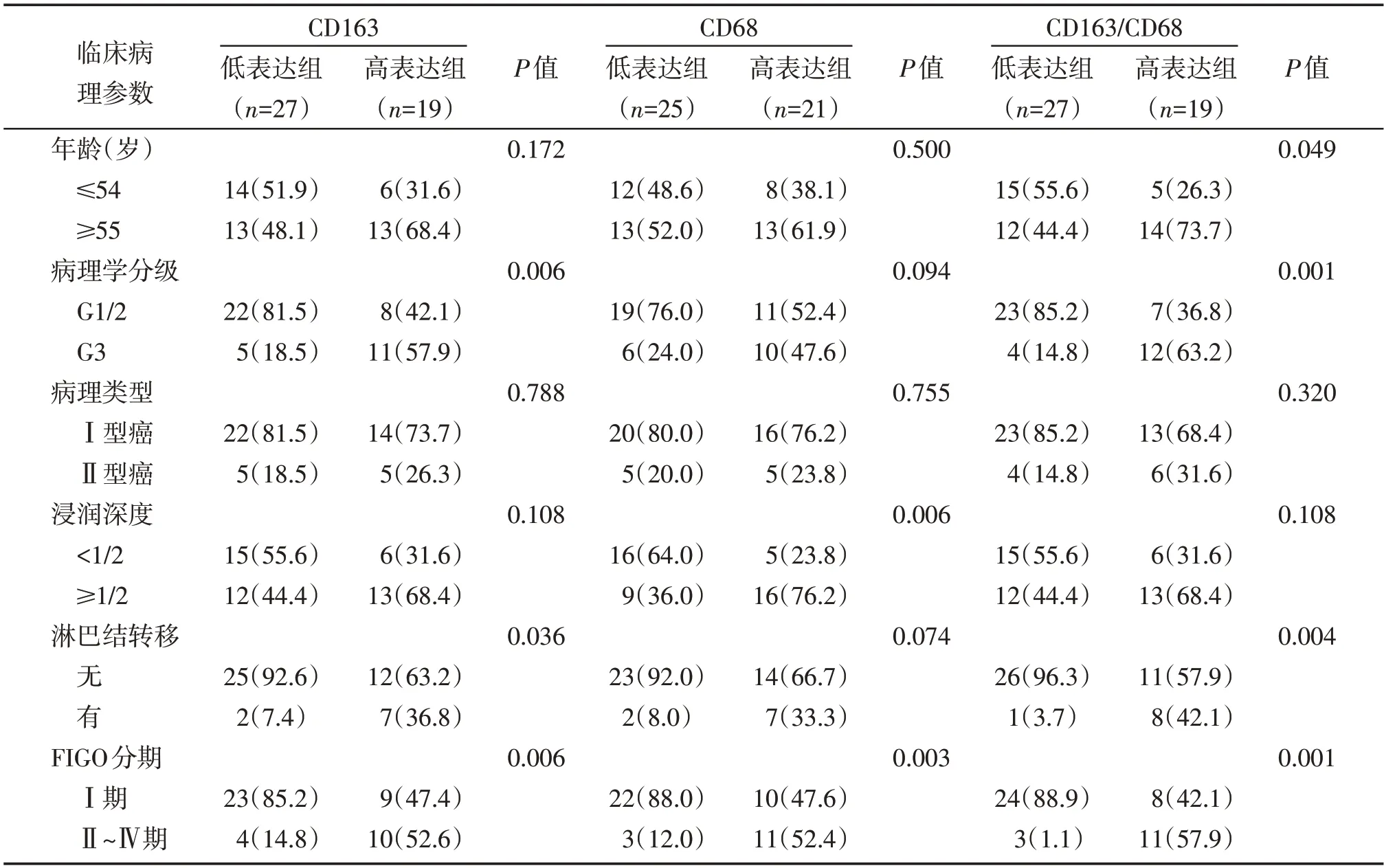
表1 CD163,CD68表达和CD163/CD68比值与子宫内膜癌临床病理参数的关系Table 1 The correlation of expressions of CD163 and CD68 and ratio of CD163/CD68 with clinico pathological features of erdometrial cancer[n(%)]

图2 CD163、CD68在不同病理分级子宫内膜癌中的表达(×100)Figure 2 Expressions of CD163 and CD68 in endometrial cancer with different pathological grades(×100)
2.3 生存分析
截至2020 年12 月,46 例子宫内膜癌患者均获得随访,其中42例存活,因子宫内膜癌死亡4例,随访时间2~138 个月,中位随访时间74 个月,生存分析结果显示,CD163、CD68的表达及CD163/CD68的比值、年龄、病理学分级、分期、浸润深度、病理类型与患者的生存率无明显相关性(P>0.05),淋巴结转移与预后相关(OR=14.34,95% CI,P=0.021),其中无淋巴结转移患者5 年生存率97%,有淋巴结转移患者5年生存率67%。
3 讨论
TAM是肿瘤微环境的重要组成,目前发现TAM与多种恶性肿瘤的发生发展有联系,包括乳腺癌、卵巢癌、胃癌、结直肠癌、前列腺癌、甲状腺癌等[6-8],TAM 具有促进肿瘤的侵袭转移和血管形成等作用。巨噬细胞是机体重要的固有免疫细胞,在维持稳态和宿主防御病原体方面起重要作用,巨噬细胞分为经典激活的M1型和替代激活的M2型,一般认为,在肿瘤早期,M1 型巨噬细胞可促进Th1 细胞免疫应答,产生促炎因子,发挥抗肿瘤效应;随着肿瘤进展,肿瘤细胞或间质细胞发出的微环境信号可使M1型巨噬细胞极化为M2型巨噬细胞。临床病理工作中通常使用CD68 和CD163 作为总TAM 和M2 的标志。近年研究表明[9],TAM 在肿瘤血管生成、侵袭、转移、免疫抑制及化疗抵抗等方面发挥重要作用,是肿瘤微环境的重要调控者。TAM可通过多条信号通路促进肿瘤的发生发展,是肿瘤预后不良的重要因素。特定肿瘤的临床病理特征与CD68、CD163 数量有关还是与CD68/CD163 比值有关在不同瘤种中有所不同[10]:如食管癌中CD68 与肿瘤分级、分期相关,在卵巢癌中肿瘤临床病理特征与CD68数量无关,而和CD163表达水平、CD68/CD163比值有关,在胃癌中只与CD163/CD68 比值有关。中国人群中子宫内膜癌与这些TAM 标志物的关系尚未明了。本实验以子宫内膜癌为研究对象,分析CD163、CD68的表达与子宫内膜癌临床病理特征的关系。
CD68 是由单核细胞以及循环和组织的巨噬细胞高表达的高度糖基化的跨膜糖蛋白对免疫的调控,可作为总的巨噬细胞标志物,主要通过诱导T细胞、巨噬细胞、NK细胞等免疫细胞分泌TGF⁃β,从而减少TNF、IL⁃8等促炎因子的分泌以及免疫细胞的激活,因此CD68+TAM 具有促进肿瘤发展的作用[11]。CD163 既是人体中血红蛋白⁃触蛋白复合物清除剂的高亲和力受体,是公认的M2 型巨噬细胞的高度特异性标志物。CD163+TAM 在肿瘤微环境中可通过分泌IL⁃10 等抗炎细胞因子,抑制T 淋巴细胞增殖,在肿瘤微环境中,CD163+TAM 促进肿瘤细胞增殖、免疫抑制以及侵袭转移[12],Sugemura 等[13]发现CD68+TAM 和CD163+TAM 的浸润与食管癌肿瘤浸润深度,淋巴和脉管侵犯显著相关。Dun 等[14]研究表明,与良性子宫内膜相比,子宫内膜癌组织的腺腔和间质中都可见高密度表达的CD68+巨噬细胞,特别是晚期子宫内膜癌组织中可见CD163+的M2型巨噬细胞聚集。高密度表达CD68+巨噬细胞及M2型TAM 常常与子宫肌层浸润风险、微血管密度、血管生成、淋巴管血管间隙浸润、淋巴结转移的高风险相关,并且与较高的FIGO 分期、较高的组织学分级相关,这些病例常常高表达Ki⁃67 与P53,预后及生存率较差。本研究探讨了TAM 与子宫内膜癌临床病理参数的关系,结果显示,CD68+TAM的数量与子宫内膜癌的病理分级、FIGO 分期有相关性,CD163+巨噬细胞的数量与子宫内膜癌的病理分级有相关性,病理分级较高的子宫内膜癌和深肌层浸润的子宫内膜癌,比病理分级低和浅肌层浸润的子宫内膜癌间质中具有更多的M2 型TAM,且CD163/CD68比值与更多的临床病理特征有关系,其中包括年龄、病理学分级、淋巴结转移和FIGO 分期均有关系,CD163/CD68 比值可反映巨噬细胞向M2 极化趋势,表明M2 型肿瘤相关巨噬细胞的浸润及由此引起的肿瘤炎症微环境的恶化可能在子宫内膜癌的发展过程中具有重要作用。
普遍认为影响子宫内膜癌预后的因素包括组织学亚型、肌层浸润深度、淋巴结转移、宫颈受累、腹膜转移和患者年龄等。TAM 促进肿瘤组织血管的形成,促进肿瘤细胞的侵袭与转移,TAM 参与子宫内膜癌的生长、血管和淋巴管生成、免疫抑制等方面,促进子宫内膜癌的发生和发展。肿瘤微环境中CD68与CD163阳性的巨噬细胞与患者的预后仍然有争议,研究表明肿瘤浸润CD68+的密度与胃癌患者的总生存率呈负相关[15],TAM数已被确定为一些癌症的独立预后因素,如乳腺癌和结直肠癌,本研究生存分析发现,子宫内膜癌中CD163 与CD68的表达与患者的生存率无显著的相关性,可能与子宫内膜癌预后较好有关。子宫内膜癌分为激素依赖型(Ⅰ型)和非激素依赖型(Ⅱ型),Ⅰ型主要与高雌激素状态有关,主要为子宫内膜样腺癌,低级别,预后良好,Ⅱ型主要为浆液性或透明细胞癌,预后明显较差,通常为高级别,常常需要辅助化疗和放疗。Kelly等[16]研究表明,Ⅱ型子宫内膜癌间质中有高密度的肿瘤相关巨噬细胞,Ⅱ型癌症的TAM密度几乎是Ⅰ型癌症的2倍,这种差异可能是由于M1巨噬细胞在Ⅱ型癌间质中占优势。本研究结果显示,CD163、CD68 的表达在Ⅰ型癌和Ⅱ型癌没有差异(P>0.05),本研究与上述结果不一致原因可能是标本选择的差异,造成Ⅰ型癌和Ⅱ型癌比例不同,需要进一步增加子宫内膜Ⅱ型癌病例数的研究,也提示M1型TAM与子宫内膜癌的关系需要进一步研究。
综上所述,TAM在在子宫内膜癌组织中表达升高,且与肿瘤的FIGO 分期、病理分级、淋巴结转移相关,提示TAM可能在肿瘤发生、发展、淋巴结转移方面发挥重要作用。TAM作为潜在治疗靶点,主要治疗策略包括:抑制M2巨噬细胞激活,阻止单核细胞向肿瘤中募集,激活单核细胞吞噬活性,调节M1型和M2型TAM比例,降低M2型TAM的比例,抑制TAM 的免疫信号通路等。相信今后以TAM 为靶点的治疗有望成为一种有价值的子宫内膜癌辅助治疗策略。

