慢性乙型肝炎合并脂肪肝人群疾病预后的流行病学研究
丁宇晴,王 涵,田 婷,戴晶晶,李 军,蒋龙凤*
1南京医科大学公共卫生学院流行病与卫生统计学系,江苏 南京 211166;2南京医科大学第一附属医院感染科,江苏 南京210029
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)在全球围内仍是一个重要的公共卫生问题。据估计,全球乙型肝炎表面抗原(hepatitis B surface anti⁃gen,HBsAg)血清阳性率为3.61%[1]。我国是病毒性肝炎大国,2006 年全国乙型肝炎流行病学调查显示,1~59 岁人群中HBsAg 携带率为7.18%。乙肝疫苗联合母婴阻断、成人乙肝疫苗等措施有效地降低了乙型肝炎病毒(hepatitis B virus,HBV)感染率,但由于庞大的人口基数,2015年世界卫生组织(World Health Organization,WHO)数据显示,中国仍有9 000 万HBV 携带者。与此同时,随着以过度饮食和久坐不动的生活方式为主的肥胖和代谢综合征的流行,脂肪肝的发病率不断增加[2]。近年来,有研究发现CHB合并脂肪肝的发病率逐渐上升,据估计亚洲CHB患者的脂肪肝患病率为14%~67%[3],CHB合并脂肪肝的现象越来越受到关注。
本研究通过分析CHB感染者合并脂肪肝状况,探索脂肪肝对CHB患者肝病进展的影响,为进一步制定防治策略提供依据。
1 对象和方法
1.1 对象
本研究为回顾性队列研究,研究对象来自2016—2017 年南京医科大学第一附属医院感染科门诊患者。纳入标准:符合《慢性乙型肝炎防治指南》[4]的诊断标准。排除标准:合并有甲型肝炎、丙型肝炎、戊型肝炎等其他病毒性肝炎;重要临床资料缺失。研究共纳入1 196 例CHB 患者,排除缺失HBV DNA 或HBsAg 信息者(n=281)后,最终纳入915例研究对象。根据有无合并脂肪肝将研究对象分成CHB合并脂肪肝组和单纯CHB组,分析两组患者HBV DNA 水平及肝纤维化情况。本研究确定纳入对象的流程详见图1。
图1 确定研究对象的流程Figure 1 Study recruitment and participant flow
研究经南京医科大学第一附属医院伦理委员会审批(2014⁃MD⁃144)。所有研究对象均签署知情同意书。
1.2 方法
1.2.1 资料收集
所有研究对象均需收集一般信息及临床资料:年龄、性别;血常规,生化常规,包括谷丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)等;乙肝病毒血清学标志物检查、HBV DNA病毒载量以及抗病毒治疗史。
1.2.2 瞬时弹性成像技术检查
采用瞬时弹性成像技术进行CHB 患者脂肪肝筛查。所有患者都被要求在筛查前禁食10 h。由法国Echosens 公司生产的Fibroscan⁃502 机型进行操作,实施操作的探头为M 型,操作者经Echosens公司授权培训获得操作资格证书。每位患者至少需要10 个有效值来获得控制衰减参数(controlled attenuation parameter,CAP)和肝硬度值(liver stiffness measurement,LSM)。肝脏脂肪变性定义为中位CAP值≥222 dB/m。轻度脂肪肝:CAP 222~232 dB/m;中度脂肪肝:CAP 233~289 dB/m;重度脂肪肝CAP≥290 dB/m。肝纤维化定义为中位LSM值≥9.0 kPa,灵敏度为76.7%,特异度为68.4%[5]。依据Fibroscan 检查结果将患者分成两组:CHB合并脂肪肝组和单纯CHB组。
1.3 统计学方法
应用STATA 15统计学软件对数据进行分析,对正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以(%)表示,采用χ2检验。使用局部加权回归散点平滑法(locally weighted scatter⁃plot smoothing,LOWESS)拟合曲线,分析随CAP 增加,HBV DNA、ALT 的变化趋势;应用Logistics 回归分析CHB 患者中,脂肪肝与HBV DNA 水平和肝纤维化的关联,计算比值比(odds ratio,OR)及95%可信区间(confidence interval,CI)。P<0.05 为差异有统计学意义。
2 结果
2.1 915例CHB患者的一般特征分析
本研究共收集南京医科大学第一附属医院感染科CHB 患者915 例,男671 例(占总数的73.3%),平均年龄为(41.7±11.6)岁。根据Fibroscan 筛查是否存在脂肪肝,分别进行基线信息情况分析(表1)。所有CHB患者中,合并脂肪肝者447例(占总数的48.8%)。与单纯CHB 组相比,CHB 合并脂肪肝组平均年龄更大(P=0.024),男性比例更高(76.3%vs.70.5%,P=0.048),进行过抗病毒治疗的比例更高(57.0%vs.49.6%,P=0.024)。两组间HBV DNA、ALT、AST水平差异无统计学意义。
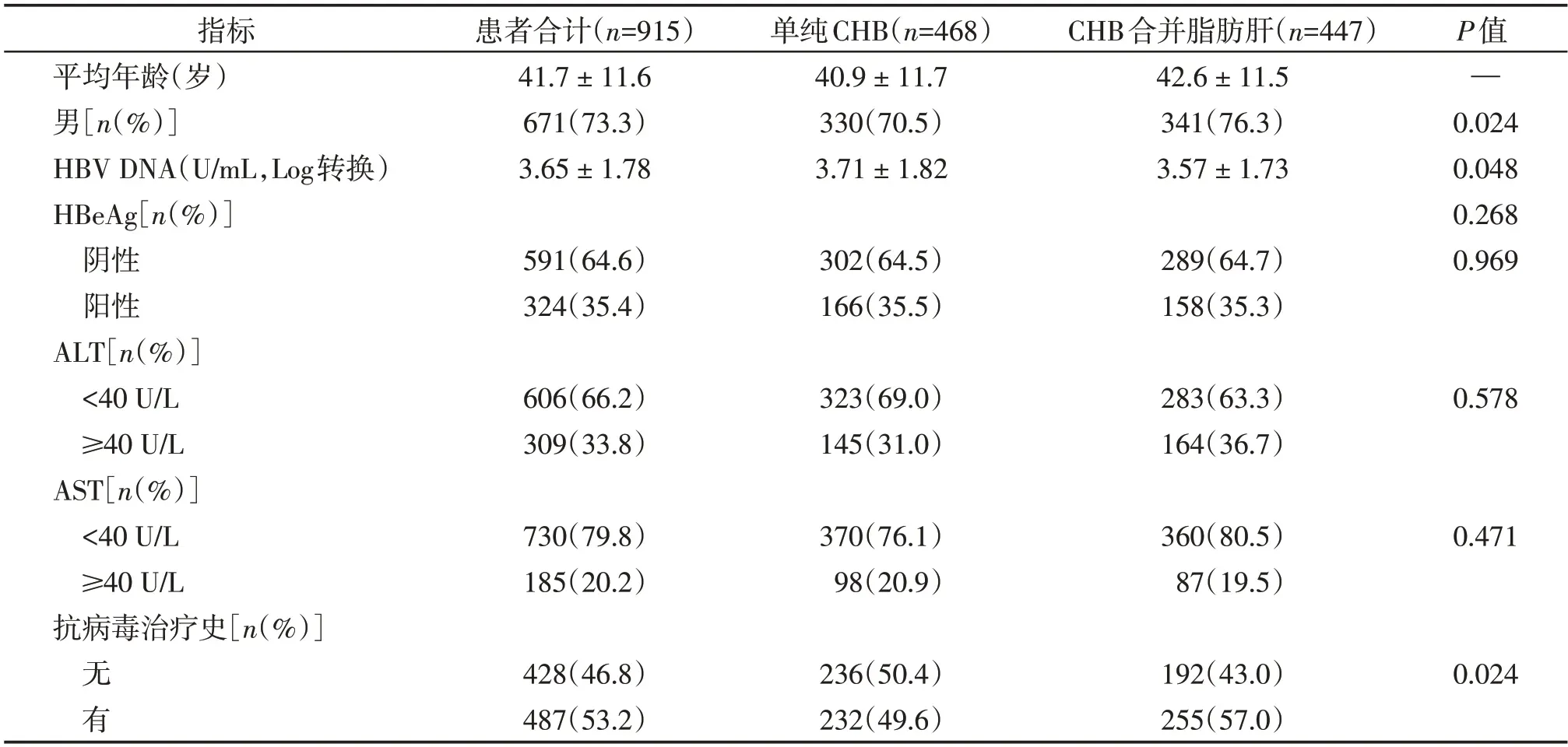
表1 慢性乙型肝炎患者的一般特征分析Table 1 Characteristics of the patients with CHB
2.2 CHB合并脂肪肝对HBV DNA的影响
将CAP 作为连续性变量,分析CAP 值增加时HBV DNA 水平的变化趋势发现,CAP 值与HBV DNA 水平呈负相关,脂肪肝越严重,病毒载量越低(图2)。根据是否进行过抗病毒治疗分层后,结果依然成立(图2)。在调整了年龄、性别、HBeAg、ALT、AST、抗病毒治疗史后,HBV DNA 与CAP 值之间关联的OR=0.86(95%CI:0.76~0.98)。
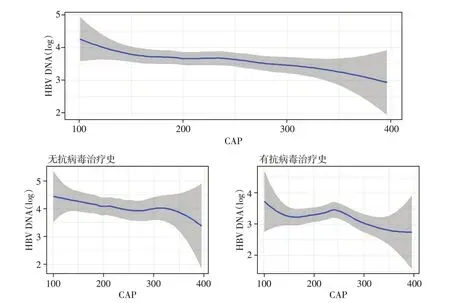
图2 HBV DNA随CAP值增加的变化趋势Figure 2 The change trend of HBV DNA with the CAP value increase
2.3 CHB合并脂肪肝对肝纤维化的影响
与CHB患者相比,合并脂肪肝的CHB患者的肝脏纤维化程度较低(OR=0.79,95%CI:0.67~0.92,P=0.003,图3)。在无抗病毒治疗人群中,重度脂肪肝患者LSM 均值为6.97,高于轻度脂肪肝患者6.04(P=0.308);脂肪肝与肝纤维化的OR=0.78,95%CI:0.58~1.03,P=0.083),边缘阳(数据未展示)。

图3 慢性乙型肝炎发生肝纤维化的危险因素分析Figure 3 Risk factors analysis of CHB with hepatic fibrosis
2.4 CHB合并脂肪肝对ALT的影响
CAP值与ALT呈现U型关联,当CHB不合并脂肪肝(CAP<222 dB/m)时,随着CAP值增加,ALT呈下降趋势;当CHB 合并重度脂肪肝(CAP≥290 dB/m)时,随着CAP值增加,ALT呈上升趋势(图4)。
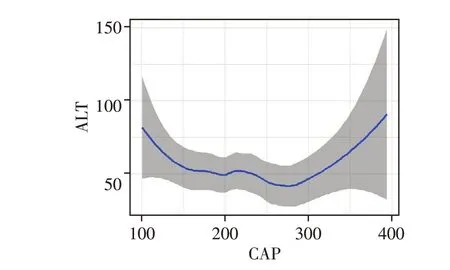
图4 ALT随CAP值增加的变化趋势Figure 4 The change trend of ALT levels with the CAP value increase
3 讨论
本研究基于人群的回顾性队列,探索了CHB合并脂肪肝患者的疾病预后。与CHB患者相比,CHB合并脂肪肝患者病毒载量更低,肝脏纤维化程度更低;ALT与脂肪肝程度呈U型分布,当合并重度脂肪肝时,CHB患者ALT水平更高。
目前HBV 感染与脂肪肝之间的关系并不明确。Zhong等[6]的病例对照研究发现HBV感染和非酒精性脂肪肝发病风险之间呈负相关。韩国一项大型队列研究表明,HBsAg 血清阳性与脂肪肝风险较低相关,这表明HBV感染可能影响脂肪肝的发病机制[7]。此外,香港一项以社区为基础的病例对照研究结果也显示,HBV 感染与脂肪肝、高甘油三酯血症和代谢综合征发病率较低相关,病毒复制可能影响脂质代谢[8]。
HBV 病毒载量是影响HBV 感染人群疾病预后的主要驱动因素。血清病毒载量高的HBV 携带者发展为肝细胞癌的风险增加[9-10]。本研究结果显示,与单纯CHB 患者相比,CHB 合并脂肪肝患者病毒载量更低。Hui 等[11]的研究表明,脂肪变性与HBV病毒载量之间存在独立的负相关关系,随着脂肪变性严重程度的增加,HBV DNA 水平相应降低。台湾一项队列研究也发现,肝脂肪变性与HBsAg血清清除和HBV DNA抑制呈正相关[12]。此外,来自其他病毒学指标研究的证据显示,与无合并脂肪肝患者相比,合并脂肪肝的患者HBsAg清除提前约5年[13]。脂肪肝和HBV 血清标志物之间的负相关也得到动物模型研究的支持。Hu 等[14]成功构建了非酒精性脂肪性肝病⁃CHB 共病小鼠模型,发现与HBV 组相比,HBV 合并非酒精性脂肪性肝病组小鼠的血清HBeAg、HBsAg、乙肝核心抗原和HBV DNA 水平显著降低。对喂食高脂饮食的HBV 转基因小鼠的研究中也获得了类似结果[15]。这些研究再次支持了脂肪肝与CHB预后之间可能的关系。
虽然不能从CHB 患者的观察性研究中得出非酒精性脂肪性肝病和HBV 血清标志物降低之间的因果关系,但它们之间的联系仍然是一个值得注意的临床现象。其潜在机制仍在探索中,可能的途径和机制包括:①代谢应激介导的免疫激活:脂肪肝相关的代谢应激可能通过Toll 样受体(toll⁃like re⁃ceptors,TLR)激活HBV 抑制的先天免疫,从而恢复内源性干扰素和肿瘤坏死因子⁃α(tumor necrosis fac⁃tor⁃α,TNF⁃α)等抗病毒物质的产生,以及激活淋巴细胞,最终加速HBsAg 和HBV DNA 的清除[13,16];②代谢状态的改变:脂肪肝诱导的代谢改变,如抑制过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC⁃1α),可能潜在地阻碍HBV 复制[17-18];③加速HBV感染细胞的凋亡:既往研究在非酒精性脂肪肝炎患者的肝脏样本中观察到HBV 感染细胞自噬抑制和Fas 介导的凋亡增加,推测脂肪肝可通过破坏HBV复制和增加HBV感染细胞的凋亡来加速HBsAg和HBV DNA 清除[11,15,19];④遗传因素:单核苷酸多态性(single nucleotide polymorphism,SNP)与非酒精性脂肪性肝病的严重程度和进展有关,既往研究发现PNPLA3的4个SNP与CHB患者对非酒精性脂肪性肝病的易感性和HBV DNA 负荷的降低相关[16]。同样,TM6SF2 rs58542926 变异体被发现与CHB 患者的肝脂肪变性和高HBV DNA 负荷相关[20]。因此,脂肪肝相关基因的多态性也可能影响CHB患者的HBV复制,尽管其潜在机制需要进一步研究。
尽管CHB 合并脂肪肝与肝纤维化之间的明确关系尚不清楚,但许多因素如肥胖、糖尿病和代谢综合征等被认为会增加HBV 感染患者发生肝纤维化的风险。然而,在本研究中,合并脂肪肝是CHB患者发生肝纤维化的保护因素;与CHB 患者相比,合并脂肪肝的CHB 患者的肝脏纤维化程度更低。一项荟萃分析显示,CHB患者肝脂肪变性与肝纤维化之间无显著相关性(OR=0.69,95%CI:0.35~1.39,P=0.305),且有无脂肪肝的两组间肝纤维化分期无差异[21]。Chen 等[22]通过肝活检对CHB 患者的肝脂肪变性、坏死性炎症等级和纤维化分期进行了全面评估,发现在慢乙肝患者中,重度脂肪变性(P=0.358)或轻中度脂肪变性(P=0.422)与晚期肝纤维化没有统计学差异。沈震等[23]分析了2015—2017年黄石地区CHB 合并非酒精性脂肪性肝病的临床与病理也发现,CHB 患者肝脏脂肪变的程度,并不加重其肝纤维化程度。研究人群的差异以及脂肪变性和纤维化评估的评估方法可能是这些观察结果相互矛盾的原因。此外,在没有明显纤维化的CHB 患者中,中重度脂肪变性可能会通过瞬时弹性成像增加肝硬度值,导致肝纤维化程度被高估。因此,脂肪变性与肝纤维化发展风险之间关系需要进一步研究。
本研究的一个优势是使用CAP 值量化脂肪变性程度,先前对CHB 合并脂肪肝的研究主要采用B超检查,容易受到仪器设备、操作者的技术和经验等因素的限制。本研究也存在一定的局限性:①观察性研究无法解释CHB 合并脂肪肝与HBV 病毒载量和肝纤维化之间的因果关联;②本研究基于医院回顾性数据,结果可能不适用于中国其他地区;③本研究未收集研究对象的饮酒信息,无法区分酒精性与非酒精性脂肪肝对HBV 血清标志物的不同影响;④缺乏肝脏病理检查作为诊断脂肪肝与肝纤维化的金标准。

