泸沽湖浮游生物多样性及垂直变化规律研究
黄 朔,陈远超,李丹洁,李连翔
1.云南省高校极小种群野生动物保育重点实验室/西南林业大学 生物多样性保护与利用学院,云南 昆明 650224
2.泸沽湖省级自然保护区管护局,云南 宁蒗 674300
泸沽湖位于四川省西南部盐源县和云南省西北部宁蒗县交界处 (100°43'36"E—100°54'20"E,27°36'57" N—27°47'02"N),为川滇共管湖泊,泸沽湖系高原断层溶蚀陷落湖,也是中国第三深水湖,水深超过50 m的湖区面积约占全湖的一半,平均水深40.3 m。湖水容量为2.252×109m3,南北长9.5 km,东西宽5.2 km;湖面面积约50.1 km2[1]。泸沽湖气候属低纬高原季风气候,全年日照时长2 100 h,年降雨量925 mm[2],6—10月为雨季,1—5月为旱季[3]。泸沽湖是我国重要的湿地[4]及旅游资源。
浮游生物是湖泊水生生物的重要组成部分[5]。浮游生物包括浮游植物和浮游动物,浮游植物是湖泊中的初级生产者,与生态系统的稳定密切相关[6],浮游动物作为消费者多以浮游植物为食,在水生生物食物链中占有重要地位[7]。迅速发展的旅游业为泸沽湖带来了更多的污水排放等各类人为影响,且湖水寄宿时间长[8],污染易累积。浮游生物作为湖泊生态系统的重要一环以及环境指示生物,对其种类组成、多样性指数以及分布情况进行定期监测十分必要[9]。此外,浮游生物是鱼类生境中的关键生物因子,也是泸沽湖特有的小口裂腹鱼(Schizothorax microstomus) 的重要饵料[10]。了解泸沽湖浮游生物多样性和现存量的年际和季节变化,以及湖中浮游动植物之间的关系,可为泸沽湖渔业资源管理与生境修复提供理论依据。
以往有关泸沽湖的浮游生物报道大多为简单的对某一类群浮游生物的研究[11-13],2010年董云仙等[14]、董云仙和王忠泽[15]分别对泸沽湖敞水区0.5 m水层的浮游生物进行了深入调查,但其研究结果仅代表泸沽湖表层水体,并未涉及深层水体中的浮游生物情况。目前,国内有关内陆湖泊中浮游生物季节性垂直变化规律的研究相对较少,仅有极少数人工水体以及对某单一物种的季节性垂直变化研究[16-17],尚未见有关泸沽湖等高原湖泊的相关研究报道。国外研究认为,在具有一定深度的湖泊中,各季节变化的水体热力分层可能是影响浮游生物垂直分布的最重要途径之一[18]。泸沽湖作为深水湖泊,湖中浮游生物在垂直方向如何受水体热力学分层的影响,以及各季节种群动态等问题,有待深入探讨与分析。基于泸沽湖水体由于热力学产生的季节性分层,本研究首次对泸沽湖浮游动植物以及两者之间关系的季节性变化和垂直变化进行研究,以期为泸沽湖日常渔业管理、珍稀濒危鱼类的生境恢复以及水生生态环境的保护提供科学依据。
1 材料与方法
1.1 研究方法
1.1.1 采样点设置
本研究于2020年1月、5月、9月在泸沽湖湖区采样。采用系统抽样法,将泸沽湖湖岸线 (约48 km) 分为10段,每间隔约5 km设置一条样线(共10条样线);其次,于媳娃娥岛向湖心区80 m深度水域方向设置1条样线,样线为垂直于湖岸的直线 (图1)。
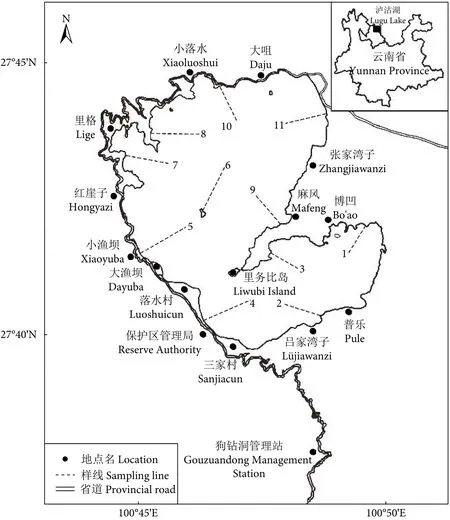
图1 泸沽湖浮游生物样线分布Fig.1 Distribution of sampling line in Lugu Lake
使用水声学设备测量湖水深度,分别于各条样线10、20、30、40 m深度处适宜位置进行采样(表1)。同一深度采集定性、定量样品各1份,即每个采样月份采集定性样品44份,定量样品44份,共88份,3个采样月累计采集水样264份。

表1 泸沽湖浮游生物样点坐标Table 1 Coordinate of plankton samplinig sites in Lugu Lake
1.1.2 采样方法
浮游生物水样采集包括定性采样和定量采样,采样方法参照《水库渔业资源调查规范》(SL 167—2014)。各采样月份采样时间均在上午8:00—10:00进行,采样工具为25号浮游生物网、5 L玻璃采水器和50 mL离心管,用鲁哥氏液固定。
1.1.3 样品鉴定与计数
1) 样品鉴定。将定性样品静置48 h后,用胶头滴管尽可能吸取所有底部沉淀,滴于载玻片,用镊子轻轻将盖玻片盖上后,于100~400倍显微镜下进行全视野观察拍照鉴定,每份样品至少观察3个玻片,浮游动、植物参考相关文献进行鉴定[19-30]。
2) 样品计数。摇匀定量样品,用1 000 μL移液枪迅速吸取0.1 mL水样置于0.1 mL计数框内 (面积20 mm×20 mm),盖上盖玻片。用视野法或全视野法拍照鉴定计数,每个样品计数3片,每片计数100个视野。浮游生物计数单位用细胞个数表示,对不易用细胞数表示的群体或丝状体,求出平均细胞数。
1.1.4 各水层平均温度测量
利用玻璃采水器自带温度计,于各水层对浮游生物采样的同时进行测量,误差±0.5 ℃,重复测量1次,取平均值。
1.2 数据处理
1.2.1 多样性指数计算
浮游生物多样性指数采用Shannon-Wiener指数 (H')、Pielou均匀度指数 (J') 以及物种优势度指数 (Y)[31],计算公式为:

式中:Pi为第i种的个体数与该群落观察到的总个体数N的比值;S为总种数;ni为第i个物种的个体总数;N为采样点中所有物种的个体总数;fi为该物种在各个样点中出现的频率,当Y>0.02时,该物种为群落中的优势种。
1.2.2 密度计算
每升水样中浮游植物数量 (密度) 的计算公式为[32]:
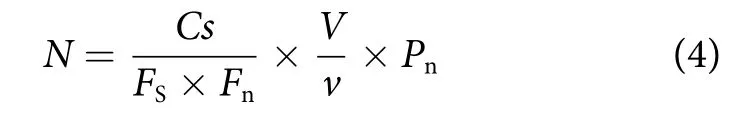
式中:N为每升水中浮游植物的数量 (个·L−1);CS为计数框的面积 (mm2);FS为视野面积 (mm2);Fn为每片计数过的视野数;V为每升水样经浓缩后的体积 (mL);v为计数框的容积 (mL);Pn为计数所得个数。
每升水样中浮游动物数量 (密度) 的计算公式为[32]:

式中:N为每升水样中浮游动物的数量 (个·L−1);V1为样品浓缩后的体积 (mL);V为采样体积 (L);C为计数样品体积 (mL);n为计数所得个数。
1.2.3 生物量计算
浮游植物的比重接近于1,故可以直接由藻类的体积换算为生物量 (湿质量,mg·L−1)[29],生物量=每升水中各种藻类的数量×各自的平均体积。浮游动物原生动物和轮虫生物量的计算采用体积换算法,根据不同种类的体型,按最近似的几何形状测量其体积;枝角类和桡足类生物量的计算采用测量不同种类的体长,用回归方程求得体质量[33]。
1.2.4 各季节浮游动植物密度及生物量相关分析
分别对不同采样月份各采样点浮游动植物各类群的密度以及生物量进行相关分析,其中满足正态分布的数据使用Pearson相关分析,不满足正态分布的数据使用Spearman相关分析。
1.2.5 各季节浮游生物密度垂直变化分析
1) 结合密度公式,计算各采样月份4个水层的浮游生物密度,并分别对不同采样月份的各水层进行差异性分析,对满足正态分布的数据进行ANOVA单因素方差分析,对不满足正态分布的数据进行Kruskal-Wallis H非参数检验。
2) 对各采样点浮游生物密度与平均水温进行相关分析,其中满足正态分布的数据使用Pearson相关分析,不满足正态分布的数据使用Spearman相关分析。
3) 分别对不同采样月份4个水层平均温度进行差异性分析[34],对满足正态分布的数据进行ANOVA单因素方差分析,对不满足正态分布的数据进行Kruskal-Wallis H非参数检验。
1.2.6 各水层浮游动植物密度相关分析
分别对不同采样月份各水层浮游生物密度进行相关分析,其中满足正态分布的数据使用Pearson相关分析,不满足正态分布的数据使用Spearman相关分析,了解浮游生物在各季节不同水层中的关系。
2 结果
2.1 浮游生物物种组成与多样性季节变化
2.1.1 物种组成季节变化
1) 浮游生物。浮游生物种类共计243种。其中1月种数最多 (126种),5月次之 (103种),9月最低 (60 种)。
2) 浮游植物。共鉴定记录浮游植物7门10纲23目41科85属148种 (附录A,详见http://dx.doi.org/10.12131/20210074的资源附件)。其中硅藻门66种,占44.59%;绿藻门60种,占40.54%;蓝藻门11种,占7.43%;甲藻门5种,占3.38%;金藻门3种,占2.03%;隐藻门2种,占1.35%;裸藻门1种,占0.68%。经统计,1月浮游植物种类最多 (76种),5月次之 (55种),9月最低 (35种)。
3) 浮游动物。调查共记录浮游动物12目28科58属95种 (附录B,详见http://dx.doi.org/10.12131/20210074的资源附件)。其中轮虫43种,占45.26%;枝角类21种,占22.11%;原生动物18种,占18.95%;桡足类13种,占13.68%。经统计,1月浮游植物种类最多 (50种),5月次之(48种),9月最低 (25种)。
2.1.2 浮游生物多样性指数
1) 浮游生物。泸沽湖全年浮游生物H' 和J' 的季节变化与物种数量的变化一致,其中1月H' 和J' 均为最高,5月次之,9月最低。
2) 浮游植物。泸沽湖全年浮游植物的H' 和J'在各采样月份之间的波动均保持一致,均为1月最高,5月次之,9月最低(表2)。
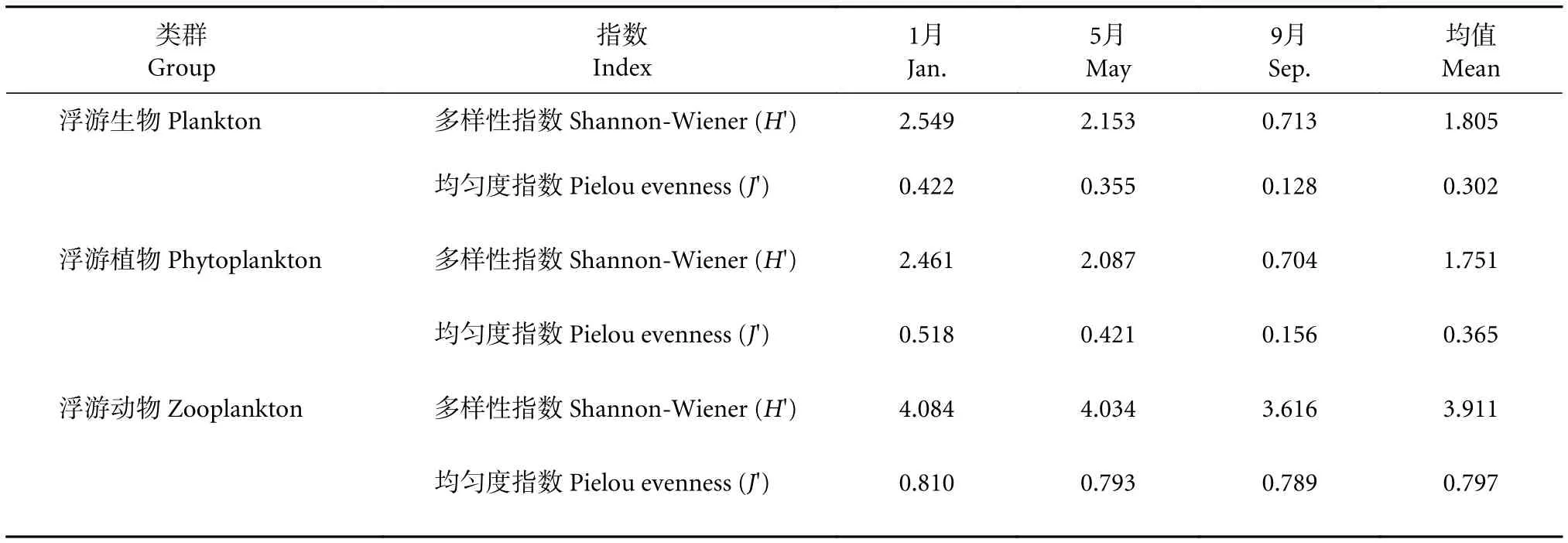
表2 泸沽湖浮游植物多样性指数和均匀度指数Table 2 Shannon-Wiener index and Pielou evenness index of phytoplankton
3) 浮游动物。全年浮游动物H' 和J'在各采样月份之间的波动均保持一致,且两种指数季节变化与浮游植物相同,均为1月最高,5月次之,9月最低 (表2)。
2.2 浮游生物优势种、密度和生物量季节变化
2.2.1 优势种季节变化
1) 浮游植物。小转板藻 (Mougeotia parvula)为1月浮游植物最主要的优势种,优势度为0.443;5月,克洛脆杆藻 (Fragilaria crotonensis) 为主要的优势种,优势度为0.631;克洛脆杆藻也是9月浮游植物优势种,该月优势度为0.871。
2) 浮游动物。方形网纹溞 (Ceriodaphnia quadrangular) 为1月优势度最高的浮游动物,优势度为0.164。5月和9月,透明溞 (Daphnia hyaline)均为最主要优势动物,优势度分别为0.115和0.160。
2.2.2 密度季节变化
1) 浮游生物。结果显示,泸沽湖9月浮游生物密度达到最大值,5月次之,1月最低;全年平均密度约为 24.151 8×104个·L−1。其中,浮游植物密度在9月最高,5月次之,1月最低;全年浮游植物密度均值为 24.148 2×104个·L−1。浮游动物密度在1月达到峰值,9月次之,5月最低;全年浮游动物密度均值为 0.003 6×104个·L−1(表3)。
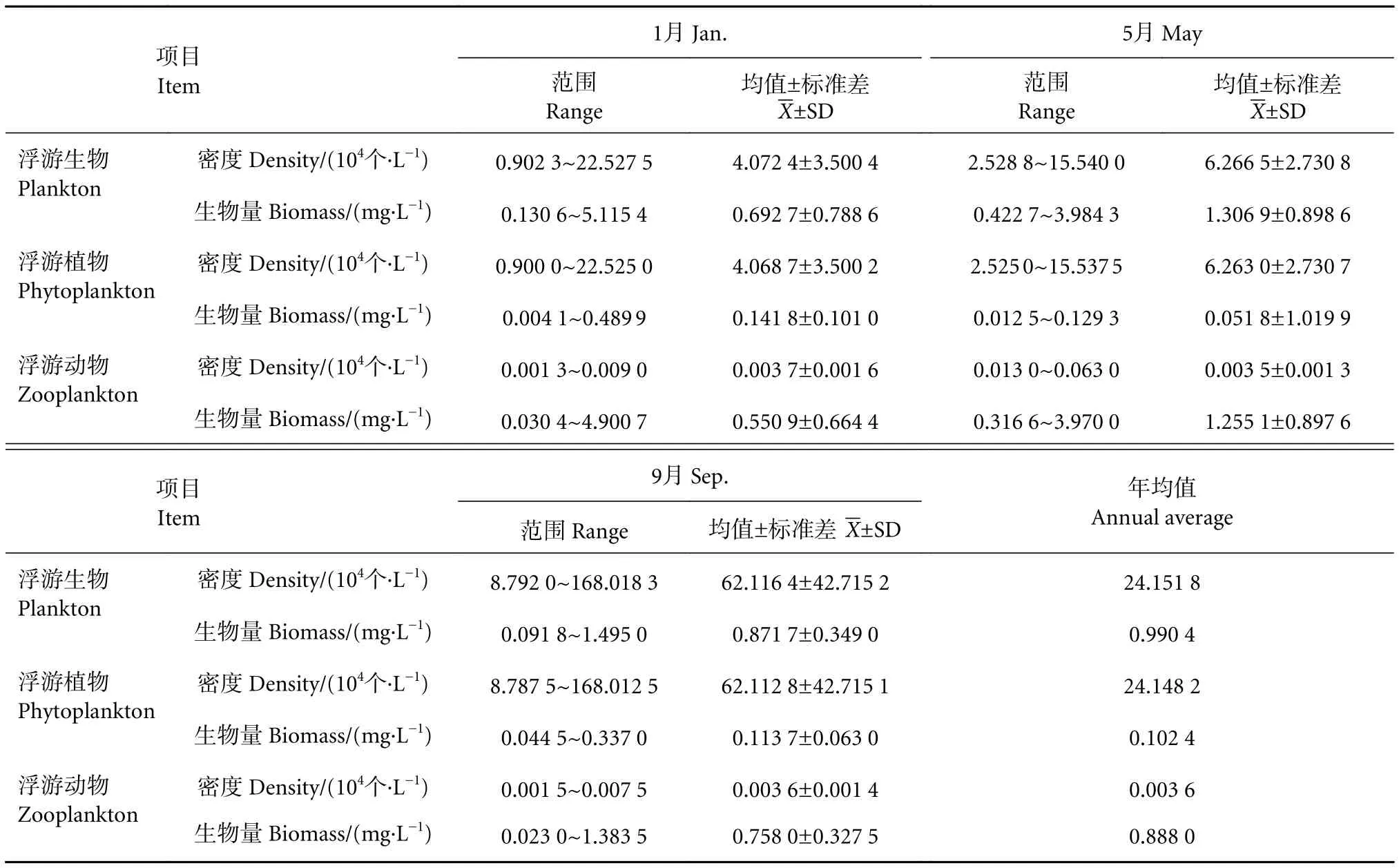
表3 泸沽湖各季节浮游生物密度与生物量Table 3 Seasonal density and biomass of plankton in Lugu Lake
2) 各采样月份浮游动植物密度相关分析。结果显示,1月原生动物密度与硅藻门密度呈显著正相关 (P<0.05),枝角类密度与甲藻门密度呈显著正相关 (P<0.05),桡足类密度与绿藻门密度也呈显著正相关 (P<0.05);5月仅枝角类密度与绿藻门密度呈极显著正相关 (P<0.01);9月原生动物密度与甲藻门密度呈极显著正相关 (P<0.01),桡足类密度与甲藻门密度呈显著正相关 (P<0.05) (表4)。
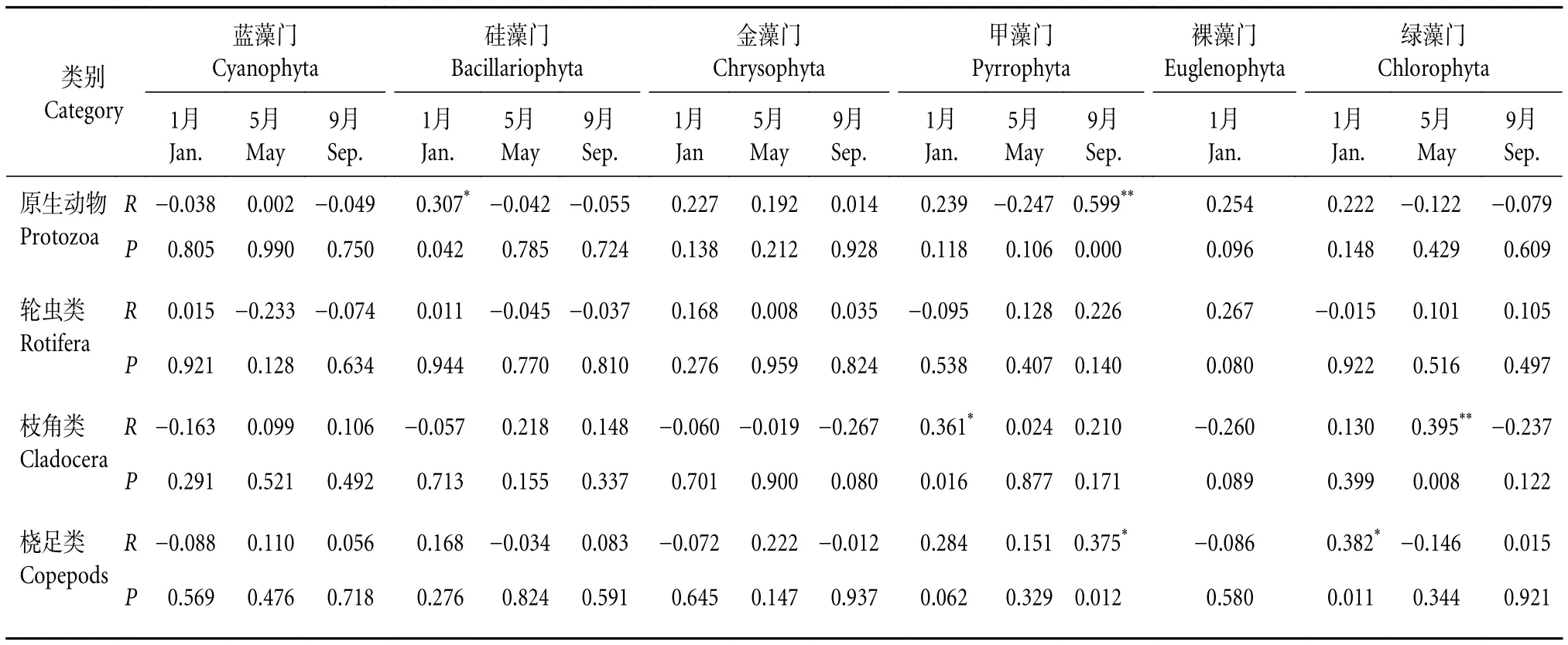
表4 各季节浮游动物-浮游植物密度相关性分析Table 4 Density correlation analysis of zooplankton-phytoplankton in different seasons
2.2.3 生物量季节变化
1) 浮游生物。泸沽湖5月浮游生物生物量达到最大值,9月次之,1月最低;全年生物量约为0.990 4 mg·L−1。其中,浮游植物生物量在1月达到峰值,9月次之,5月最低;全年浮游植物生物量均值为0.102 4 mg·L−1。浮游动物生物量在5月达到最大值,9月次之,1月最低;全年浮游动物生物量均值为 0.888 0 mg·L−1(表3)。
2) 各采样月份浮游动植物生物量相关分析。经检验,1月浮游动植物生物量之间均无显著相关(P>0.05);5月枝角类生物量与绿藻门生物量呈显著正相关 (P<0.05),轮虫生物量与绿藻门生物量之间则呈显著负相关 (P<0.05);9月原生动物生物量与甲藻门生物量呈极显著正相关 (P<0.01),桡足类生物量和甲藻门生物量呈显著正相关 (P<0.05) (表5)。
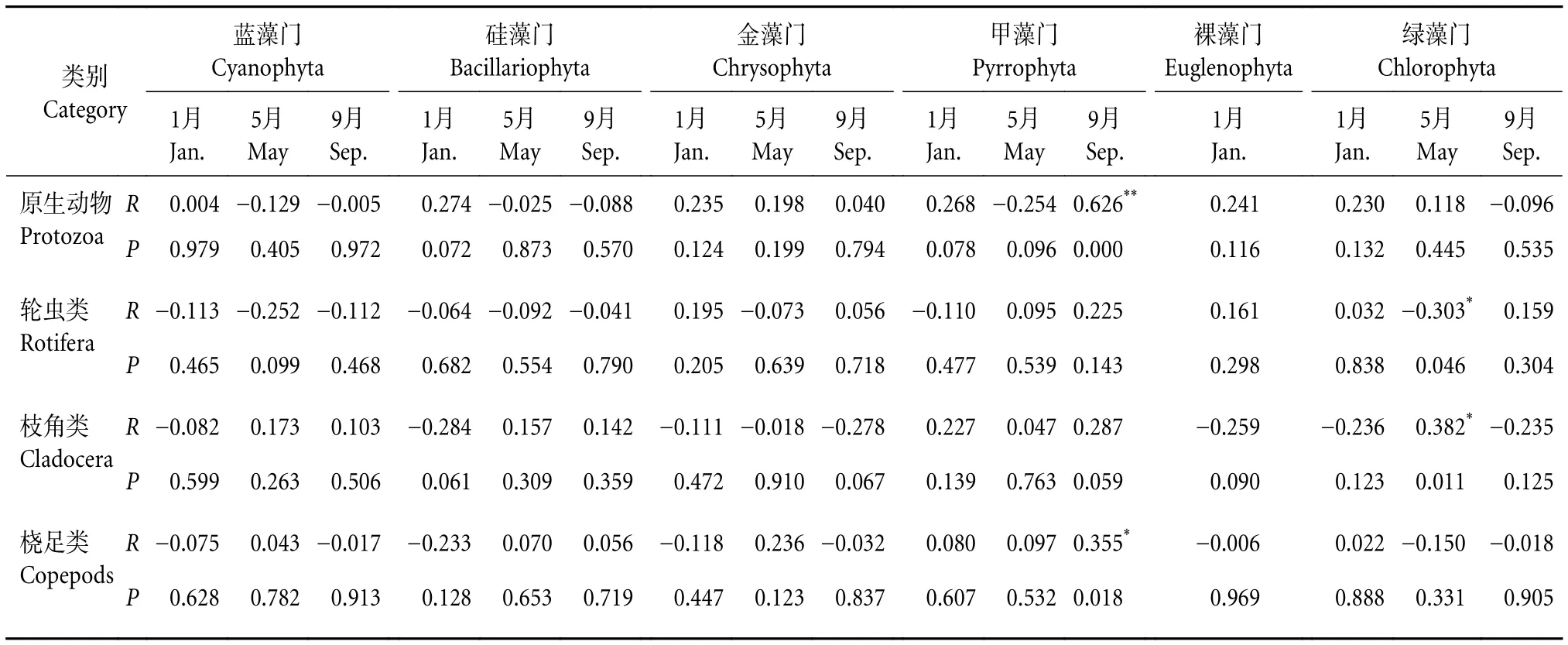
表5 各季节浮游动物-浮游植物生物量相关性分析Table 5 Biomass correlation analysis of zooplankton-phytoplankton in different seasons
2.3 浮游生物垂直变化
2.3.1 密度垂直变化
1) 浮游植物。泸沽湖各水层浮游植物密度变化趋势见图2。其中1月浮游植物密度最大值出现在 10~20 m 水层,均值为 5.423 9×104个·L−1,最小值位于 30~40 m 水层,均值为 3.161 8×104个·L−1;5月密度最大值出现在10~20 m水层,均值为7.386 8×104个·L−1,最小值则出现在 0~10 m 水层,均值为 4.753 4×104个·L−1;9 月密度最大值出现在30~40 m 水层,均值为 75.798 9×104个·L−1,最小值出现在 10~20 m水层,均值为 53.406 8×104个·L−1。
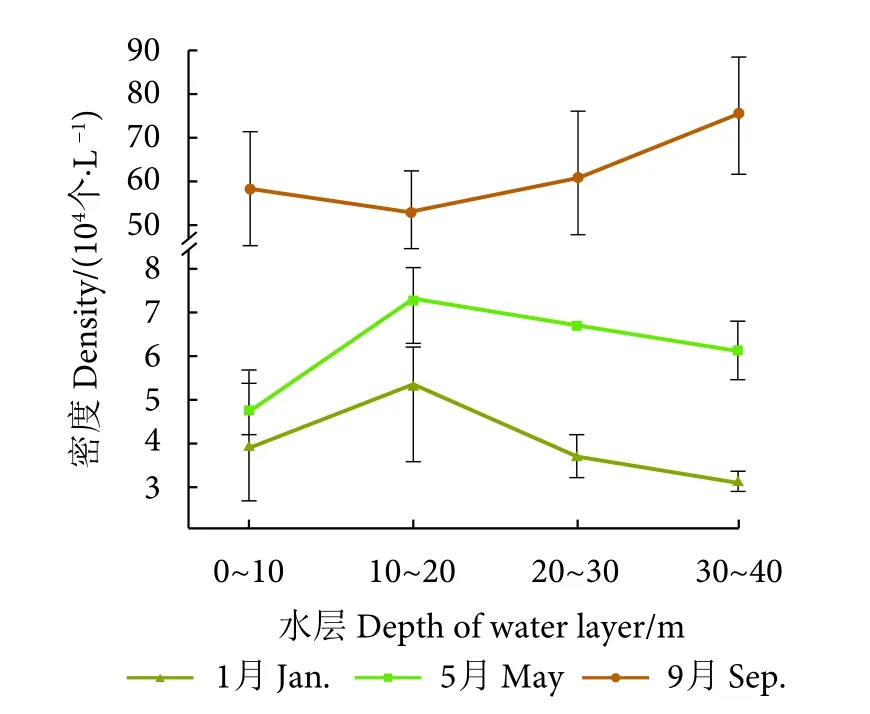
图2 泸沽湖浮游植物密度垂直变化趋势图Fig.2 Vertical variation trend of phytoplankton density in Lugu Lake
2) 浮游动物。泸沽湖浮游动物密度垂直变化趋势见图3。其中,1月浮游动物密度最大值出现在 0~10 m 水层,均值为 0.004 5×104个·L−1,最小值出现在30~40 m水层,均值为0.002 7×104个·L−1;5月密度最大值出现在10~20 m水层,均值为 0.004 0×104个·L−1,最小值则出现在 20~30 m 水层,均值为 0.003 0×104个·L−1;9 月密度最大值出现在 0~10 m 水层,均值为 0.005 1×104个·L−1,而最小值出现在20~30 m水层,均值为0.002 6×104个·L−1(图3)。
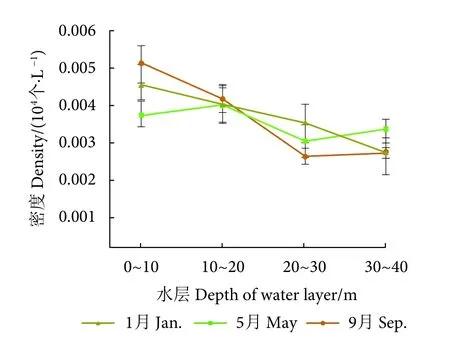
图3 泸沽湖浮游动物密度垂直变化趋势图Fig.3 Vertical variation trend of zooplankton density in Lugu Lake
2.3.2 各水层温度差异及浮游生物密度与水温的关系
1) 各水层温度差异性分析。1月各水层温度较稳定,变化范围介于7.8~9.0 ℃,均值为8.2 ℃,各水层温度之间无显著差异 (χ2=2.224,P=0.527);5月,各水层温度出现相对明显的变化,变化范围介于8.9~15.1 ℃,均值为13.1 ℃,各水层温度存在极显著差异 (χ2=15.011,P=0.002)。经事后各水层的成对比较,其中0~10 m水层温度显著高于20~30 m水层 (P=0.037),极显著高于30~40 m水层 (P=0.002);9月各水层温度变化范围介于14.5~19.8 ℃,均值为18.4 ℃,各水层温度同样存在极显著差异 (χ2=35.010,P<0.001),经事后各水层的成对比较,9月0~10 m水层温度极显著高于20~30 m水层 (P=0.001),且极显著高于30~40 m水层(P<0.001),同时,10~20 m水层也极显著高于30~40 m水层 (P<0.001)。
2) 各水层浮游生物密度与水温相关性分析。5月浮游植物密度与该采样月份采样点平均水温呈显著负相关 (P<0.05),浮游动物密度与该采样月份采样点平均水温呈显著正相关 (P<0.05);9月,浮游植物密度与该采样月份采样点平均水温均呈显著负相关 (P<0.05),浮游动物密度与该采样月份采样点平均水温均呈极显著正相关 (P<0.001) (表6)。
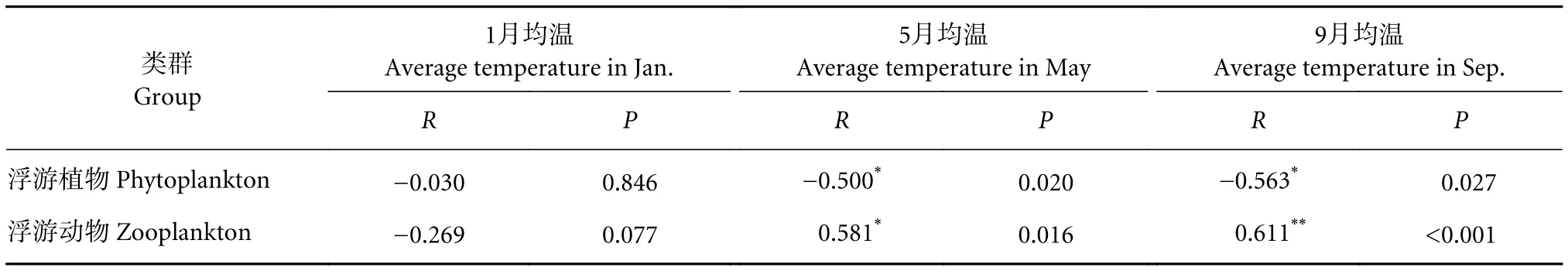
表6 各季节浮游动植物密度与样点平均水温相关分析Table 6 Correlation analysis of phytoplankton and zooplankton density and average water temperature in differrent seasons
2.3.3 各水层浮游植物与浮游动物密度关系
1月泸沽湖20~30 m水层中,浮游动植物密度存在极显著的正相关 (P<0.01);5月各水层浮游动植物密度均无显著的相关性;9月0~10 m水层浮游动植物密度也存在极显著的正相关 (P<0.01)(表7)。
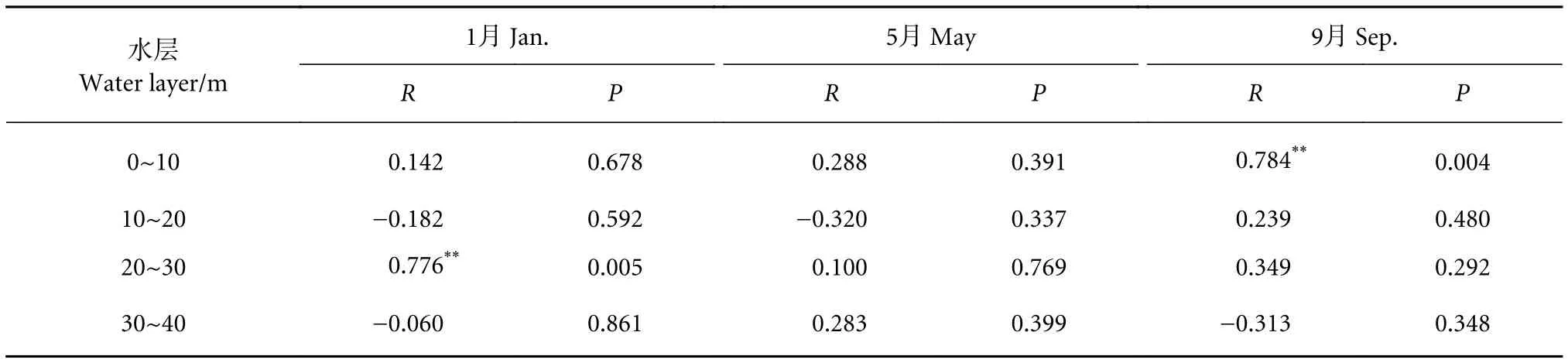
表7 各水层浮游动植物密度相关分析Table 7 Correlation analysis of phytoplankton and zooplankton density at different water layers
3 讨论
3.1 泸沽湖浮游生物组成与变化
历史上有关泸沽湖浮游生物的调查多为针对某一类群的研究,对于整体浮游生物种类缺少详细的统计。直到2010年董云仙等[14]、董云仙和王忠泽[15]相对完整的浮游生物调查,共记录浮游植物146种,浮游动物80种。相比之下,本次调查记录浮游植物148种,浮游动物95种,种类数总体上均有增加,这可能与本研究增加了采样点密度和深水层的采样有关。如本次新增的单角盘星藻 (Pediastrum meyen)、顶棘杜兴藻 (Ducellieria chodatii)、盔形透明溞 (D.galeata)、脆弱象鼻溞(Bosmina fatalis) 等种类,均在较深水样中出现。另外,浮游动植物各类群中物种组成也发生了一定程度的变化,研究表明,由于泸沽湖深藏于横断山区,人为干扰少、自然条件稳定,浮游动植物自20世纪80年代至2010年,在种类组成上变化并不大[14-15]。但近年来,泸沽湖旅游业的发展为当地居民带来巨大经济利益的同时,也增加了泸沽湖生态环境的负担以及对水生生物的干扰。本研究中部分物种组成以及优势种的变化也可能与泸沽湖水质变化有关。例如,浮游植物中蓝藻门微囊藻属(Microcystis) (水华的主要种类)[32],以及浮游动物中叉角拟聚花轮虫 (Conochiloides dossuarius) (中污性水体种类)[24]等物种的出现。此外,相比于2010年的调查,泸沽湖浮游动植物在各季节均出现具有较高优势度的优势种,如浮游植物中的小转板藻及克洛脆杆藻等。虽然硅藻门是贫营养型水体的优势种,但优势种之一的转板藻则更适合在中营养型水体中生存[35]。浮游动物方面,方形网纹溞由2010年调查中的非优势种逐渐变为优势种。方形网纹溞能适应非常宽的pH范围[36],在其他相对敏感的物种由于环境变化而导致数量减少的背景下,适应能力较强的物种可能会逐渐占据优势地位。
3.2 泸沽湖浮游生物季节变化
3.2.1 多样性评价及季节变化
有研究认为,浮游生物多样性评价须综合H'和J'。H'为1.6~2.5时,J'>0.3时,物种多样性较好[37]。泸沽湖全年浮游生物多样性均处于较好及以上水平。但就各采样月份的指数来看,9月泸沽湖浮游生物H'和J'明显偏低。浮游动植物种数以及部分种类的密度季节性变化共同导致了该现象。
浮游植物方面,硅藻门和绿藻门的物种数减少,以及部分物种个体数剧增是导致9月浮游植物H' 和J'下降的关键因素。其中硅藻门物种数急剧减少,同时,9月泸沽湖的平均水温为硅藻门中部分种类最适宜温度[34],例如克洛脆杆藻在所有样方中均形成绝对优势。在硅藻门优势种的排挤下,其他种类的密度甚至物种数也有一定的下降,较为明显的绿藻门从1月的31种经5月逐渐减少至9月的17种。另外,作为初级消费者,浮游动物大多直接捕食浮游植物,因此其种类与密度在一定程度上受浮游植物的上行效应控制[38]。9月浮游植物种类组成由复杂趋于单一,由于湖中绿藻门和甲藻门等单细胞藻类减少,克洛脆杆藻等较大体积的群体占据优势,因此,以小型单细胞藻类为食的浮游动物食物相对匮乏[32],其密度下降,甚至消失。如轮虫类和枝角类中体型较小的种类。相对的,枝角类中较大体型的物种,如透明溞和方形网纹溞在9月种群数量明显上升,优势地位凸显,从而导致浮游动物种类随之减少,两种指数发生一定程度下降。
3.2.2 浮游生物密度、生物量以及浮游动植物关系季节变化
随着季节的更替,泸沽湖浮游植物密度由1月逐渐上升,而浮游动物密度则由5月的最低值逐渐上升,后者相较于前者有季节性的滞后现象。泸沽湖属高原深水湖泊,各季节水温相对较低,生产者到消费者之间的能量传递需要更长的时间来完成,致使两者生长和繁殖产生了时间差异[39],在密度的季节变化上表现为浮游动物相对滞后于浮游植物。生物量方面,浮游动植物生物量与密度的季节变化并不一致,这主要是由于各采样月份浮游动植物不同种类的平均湿质量差异较大。例如浮游植物中,甲藻门飞燕角甲藻(Ceratium hirundinella) 平均湿质量达0.5 mg·10−4个,该藻在各采样月份的数量影响着整体浮游植物生物量。1月浮游植物密度虽然最低,但甲藻门密度最高,其生物量占浮游植物总生物量的95.82%;9月浮游植物总体密度虽最高,但其中硅藻门的脆杆藻属占比最大,其湿质量远不如飞燕角甲藻,因此1月生物量远大于9月和5月。与浮游植物类似,1月平均湿质量较小的原生动物数量占比较大,而平均湿质量较大的枝角类则占比较小;5月枝角类的密度最高,其生物量占91.15%,因此浮游动物密度最小的5月,其生物量却最高。
浮游动植物密度与生物量的关系在一定程度上受上述能量传递速率以及不同类群湿质量差异的影响,但从总体来看,浮游植物受浮游动物捕食的下行控制[40],反之,浮游动物也受到浮游植物资源的上行控制[38]。在部分捕食关系密切的类群之间,密度和生物量上可同时表现出相关性。本研究发现,5月枝角类密度、生物量与绿藻门密度、生物量均呈显著正相关。枝角类主要从水体中摄取细小的单细胞植物[26],而绿藻门中有较多小型单细胞个体和集群,可为枝角类提供食物来源,因此枝角类密度与生物量随绿藻门密度与生物量的增加而增大。9月,泸沽湖中原生动物密度、生物量与甲藻门密度、生物量均呈极显著正相关,湖中原生动物大多属肉足虫类与纤毛虫类,主要摄食单细胞藻类等[32],本研究中常见的甲藻门均属单细胞藻类,是湖中原生动物主要食物来源,湖中甲藻门的密度与生物量的分布影响着原生动物的分布;此外,桡足类密度、生物量与甲藻门密度、生物量也均呈显著正相关,主要原因可能是在甲藻门密度与生物量较高的水域,原生动物的密度与生物量较高,而泸沽湖中桡足类多为剑水蚤目中的广布中剑水蚤(Mesocyclops leuckarti) 和台湾温剑水蚤 (Thermocyclops taihokuensis),两者为掠食性种类[25],均以小型浮游动物为食。在甲藻门密度、生物量较高的水域,桡足类也能获得更多如原生动物等的动物性食物。
3.3 泸沽湖浮游动植物密度及两者关系的垂直变化规律
不同浮游生物生活于不同水层中,从而构成一个群落结构和数量相对稳定的垂直分布模式[41]。一般认为,水温是影响浮游动植物分布的最主要环境因子[34,42]。类似泸沽湖这样较深的湖泊,水温的垂直变化使水体出现热力学分层[43]。对泸沽湖各水层的温度研究发现,5 月和9 月水温的垂直变化与温跃层的变化过程相吻合,即4月泸沽湖水体在21~25 m 深度形成温跃层并开始上移,7 月上移至11~25 m深度,而后下移,10 月下移至20 m深度[44]。各采样月浮游生物密度与采样点水温相关分析表明,浮游动植物密度变化与5月、9月水温变化密切相关。结合上述泸沽湖水体热力分层,进一步讨论各季节浮游生物垂直变化。
各采样月份0~10 m的表层水温受气温直接影响,浮游植物密度随各季节气温而变化。而随着深度的增加,水层中浮游植物密度垂直变化则主要受水体热力学分层,以及不同种类自身体质量差异的影响。对比5月与9月密度转折点 (10~20 m) 以下水层浮游植物的密度变化趋势 (图2),浮游植物密度变化曲线由5月平缓下降逐渐变为9月平缓上升的趋势。这是由于5月在温跃层逐渐形成后,随着气温逐渐升高,太阳直射角度逐渐增大,温跃层由10~20 m下移至20~30 m,温跃层以上的水体厚度逐渐增加,由于缺乏与下层水体中营养物质的混合,上层营养物质的可用性会逐渐降低[45-47],同时,由于重力作用下,上层水体中新生的硅藻逐渐下沉[18],导致深层水体中浮游植物密度逐渐形成上升趋势。
各采样月浮游动物密度总体上与水深成反比(图3)。原因同样也与重力作用有关,湖中体质量较轻、数量较多的原生动物始终在上层水体中占比更大,而体质量较大、数量较少的枝角类和桡足类则有缓慢下沉趋势[48-49]。另外,5月浮游动物密度在10~20 m水层最高,且此后在更深水层中逐渐下降,此时温跃层处于从21~25 m逐渐上移至11~25 m途中。同样,9月浮游动物密度在20~30 m水层处出现转折,此时温跃层正处于向20 m以下水层移动过程的中后期。由此可推断浮游动物密度的变化仍与各水层的温度不均以及温跃层的移动有关。水体的热力学垂直分层影响着水体溶解氧、电导率、pH等指标的垂直变化[50],温跃层所在水层的环境异质性较高,浮游生物密度在这些水层就可能会产生明显波动。
由于各季节水温的垂直变化,导致部分水层温度在该季节可能更加适宜浮游生物生存,这些水层中浮游动植物之间的关系相对更为密切。如1月的20~30 m水层以及9月的0~10 m水层中,浮游动植物密度存在极显著正相关,而在其他季节这些水层浮游动植物密度并无显著的相关性。1月泸沽湖0~40 m水层温度整体较低,而20~30 m水层平均温度相对较高;同样,9月全湖0~10 m水层平均温度高于其他水层。这些水层中,适宜的水温条件促使浮游生物的生命活动相对于其他水层更为活跃,浮游植物为浮游动物提供更多能量来源的同时,浮游动物排泄的营养盐又可以促进浮游藻类的生长[51],在这些水层中两者相互作用,密切相关。

