葡萄VvWDR1 生物信息学分析及其互作蛋白分析
郭建勇,杨波,梁长梅,张鹏飞,温鹏飞*
(1.山西农业大学 园艺学院,山西 太谷 030801;2.山西农业大学 信息科学与工程学院,山西 太谷 030801)
WD40 重复蛋白(WD-repeat),又称WD40 结构域蛋白,核心区域由一个简短的、约40 个氨基酸所构成,N 端从甘氨酸和组氨酸的二肽开始,C 端由色氨酸和天冬氨酸终止[1],作为真核生物中一个重 要 基 因 家 族[2],参 与 细 胞 信 号 转 导[3]、RNA 修饰[4]、细胞凋亡[5]、免疫反应[6]、基因转录[7]和花青苷合成[8]等代谢,具有重要作用。
目前,拟南芥中已经鉴定出230 个WD40 蛋白成员[9],也在其它植物中鉴定出不同类型的WD40蛋白,例如谷子[10]、棉花(陆地棉)[11]、水稻[12],小麦[13]等。前人研究发现,拟南芥中AtTTG1参与调控拟南芥种皮中原花青素、根毛和表皮毛形成以及种子粘液和花青素生物合成[14],且过表达MdTTG1[15]、VcTTG1[16]、VvWDR1[17]的拟南芥植株AtDFR等基因表达上调并促进花青苷积累,过表达MiTTG1促进拟南芥的根生长及非生物胁迫[18]。InWDR1过表达可增强日本牵牛花蓝色花朵、红色茎中的花青素及深棕色种子色素沉积[19]。柿子中DkWD40 蛋白被证实参与柿果实单宁积累和可溶性单宁向不溶性单宁的转化[20]。
原花青素和花青苷是葡萄中含量最丰富的2种类黄酮类化合物[21],其代谢调控受到诸如遗传(如结构基因、调节基因等)和环境(如光照、温度等)的调控。前人证实,WD40 蛋白参与形成MBW(MYB-bHLH-WD40)蛋 白 复 合 体,与DFR、UFGT等花青苷合成关键酶基因的启动子相结合,进而调控花青苷的合成[22-23]。在拟南芥中,TT2-TT8-TTG1 复合体通过调节关键酶基因DFR、LDOX、BAN的表达来调节其原花青素的 合 成[24];在 草 莓 中,FaTTG1 可 与FaMYB9/FaMYB11、FabHLH3 形成一种复合物,该复合物可通过上调ANS和LAR表达从而增加原花色素物 质 积 累[25];Zhao 等[26]发 现VcWDL2 与VcMY⁃BL1 和VcbHLHL1 相互作用进而参与蓝莓果实花青苷积累和颜色发育;Liu 等[27]发现MrWD40-1 与MrMYB1 和MrbHLH1 互作促进杨梅花青苷积累;An 等[28]发现MdTTG1基因与bHLH 转录因子可形成复合物,进而启动下游花青苷合成基因MdDFR和MdUFGT转 录;葡 萄 中[29]WDR1 通 过与MYBA1 的蛋白相互作用,激活VvCHI3、VvOMT和VvGST4的启动子进而正向调节葡萄浆果的颜色。
前人研究表明,VvMYBPA2参与调控葡萄原花色素的积累[30],且VvMYC2参与调控葡萄花青苷的积累和茉莉酸合成[31],VvWDR1异源表达诱导花青苷积累。但葡萄WDR1 蛋白与VvMYB⁃PA2和VvMYC2编码的蛋白是否存在互作,抑或其互作机理尚未见报道。因此,本试验在获得VvWDR1基因CDS 区基础上,首先通过生物信息学分析其特征和预测其功能,进而通过酵母双杂交技术揭示WDR1 与MYBPA2 或MYC2 蛋白的体外相互作用,对于阐明葡萄原花青素与花色苷代谢调控机理具有重要理论意义。
1 材料与方法
1.1 试验材料
生长健壮且无病虫害的7 年生‘早黑宝’葡萄(Vitis viniferaL.cv.Zaoheibao),篱架栽培,株行距1.5 m×2.5 m,常规管理。大肠杆菌(E.coli Trans5α)化学感受态购于北京全式金生物技术有限公司,酵母菌株AH109、载体pGBKT7、pGADT7 保存自本 实验室,SD/-Trp、SD/-Trp-Leu、SD/-Trp-Leu-His-Ade 培养基、X-α-Gal、限制性内切酶、T4DNA 连接酶、pMD-19T 购于北京TaKaRa 公司,DNA marker 购于中科瑞泰(北京)生物科技有限公司,质粒小提试剂盒、琼脂糖凝胶DNA 回收试剂盒购于天根生化科技(北京)公司,所需引物合成和测序均由华大科技有限公司(北京)完成。MYBPA2相关载体由实验室前期构建。
1.2 VvWDR1 生物信息学分析
利用ExPASy 网站在线工具ProtParam(https://web.expasy.org/protparam/)进 行 蛋 白基本理化特性分析,使用Protscale(https://web.expasy.org/protscale/)分析氨基酸序列亲疏水性,利用在线软件SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行信号肽和跨膜结构域预测,利用在线软件SPOMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对其编码氨基酸序列进行二级结构预测,通过SWISS MODEL(https://swiss⁃model.expasy.org/interactive)网站对其三级结构进行预测,利用CDD 数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进 行 蛋 白质保守结构域分析,通过NCBI 官网进行blastp 比对,下载高相似度的序列并结合MEGA 7.0 软件构建系统进化树。
1.3 引物设计及PCR 扩增
根据葡萄已知的WDR1、MYC2核苷酸序列及pGADT7、pGBKT7 多克隆位点,利用Premier 5.0 软件设计合成外挂酶切位点的扩增引物见表1(下划线部分为酶切位点)。

表1 引物序列Table1 Primers Sequence
以‘早黑宝’葡萄叶片cDNA 为模板,加入上、下游引物、2×Taq PCR MasterMix、DEPC-H2O后PCR 扩增目的片段,经1%琼脂糖凝胶电泳分析后送至华大测序。
1.4 酵母载体构建及鉴定
将测序正确的克隆载体与酵母双杂交载体同时双酶切,切胶回收目的片段和载体片段,用T4连接酶进行连接转化至Trans 5α感受态细胞,抗生素筛选培养,从平板中挑取数个菌落在30 ℃、200 r·min-1培养条件下,振荡过夜培养,然后提取质粒进行酶切验证。
1.5 酵母重组质粒的转化
采用PEG/LiAc 法将诱饵载体pGBKT7-WDR1转化酵母感受态细胞中,参照董燕梅[32]的方法,略有修改。
1.6 重组质粒毒性及自激活检测
随机各挑取5 个单克隆于5 mLSD/-Trp 液体培养基30 ℃震荡培养,24 h 后测OD600,选取转化成功的酵母菌阳性单克隆,接种于SD/-Trp/Xα-Gal平板上,倒置培养并观察颜色变化。
1.7 共转化酵母感受态细胞
采用PEG/LiAc法将pGBKT7-53/pGADT7-T(阳性对照)、pGBKT7-Lam/pGADT7-T(阴性对照)、pGBKT7-WDR1/pGBKT7-MYBPA2、pGB⁃KT7-WDR1/pGADT7-MYC2质粒分别共转化酵母感受态细胞中,吸取100 μL 涂布于SD/-Trp-Leu 营养选择性培养基平板上,30 ℃倒置2~4 d,观察菌落生长情况,待菌落长出后接种到SD/-Trp-Leu-His-Ade 选择性培养基上,30 ℃倒置2~4 d,待菌落长出后接种到SD/-Trp-Leu-His-Ade/X-α-Gal平板上,30 ℃倒置并观察颜色变化。
1.8 数据处理
运用MEGA 7.0 软件进行系统发育树分析,利用DNAMAN 6.0 进行序列比对,Photoshop CS6 进行图片处理。
2 结果与分析
2.1 VvWDR1、VvMYC2 扩增
以‘早黑宝’葡萄cDNA 为模板,经PCR 扩增后,用1%琼脂糖凝胶电泳鉴定,结果显示分别扩增出分子大小为1 011 bp,1 827 bp 的条带,与NC⁃BI 公布的序列大小相符(图1)。

图1 WDR1、MYC2 基因扩增结果Fig.1 Amplification results of WDR1 and MYC2
2.2 VvWDR1 序列分析
在NCBI 官网查找VvWDR1基因(GenBank登录号:ABF66625),全长cDNA 序列1011 bp,编码336 个氨基酸。利用ExPASy 网站在线工具ProtParam 对VvWDR1编码蛋白的基本理化特性分析,结果得出该蛋白分子量约为37.8 kD,等电点为5.07,分子式为C1671H2588N458O518S11,不稳定系数为54.60,推测其为不稳定蛋白。该蛋白中丝氨酸最多12.8%,其次亮氨酸8.3%、异亮氨酸7.7%,最少是半胱氨酸1.2%。使用Protscale 分析氨基酸序列亲疏水性,推测该蛋白为疏水性蛋白。利用在线软件SignalP-5.0 和TMHMM 进行信号肽和跨膜结构域预测,显示该蛋白无信号肽且不具有跨膜结构域。通过SPOMA 网站对VvWDR1编码氨基酸序列进行二级结构预测,结果显示该蛋白结构原件比例是无规则卷曲39.29%,β-折叠26.79%,α-螺旋22.02%,β-转角11.90%。SWISS MODEL 对三级结构进行预测(图2)。
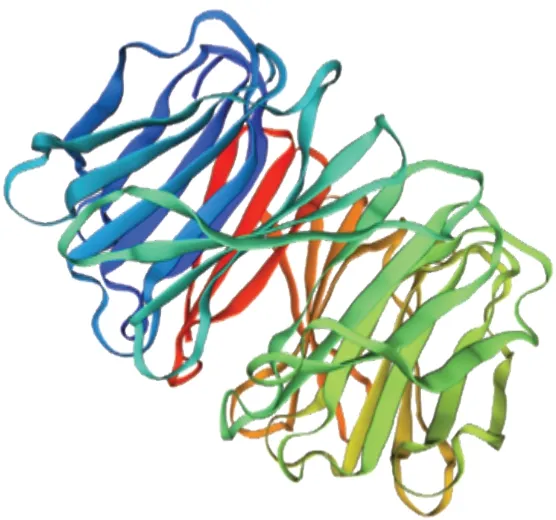
图2 VvWDR1 蛋白三级结构图Fig.2 Tertiary structure of VvWDR1 protein
利用NCBI-CDD 数据库对蛋白质保守结构域分 析 发 现,VvWDR1编 码 的 蛋 白 有5 个WD40 蛋白基序,具有WD40 典型的保守结构域(图3)。
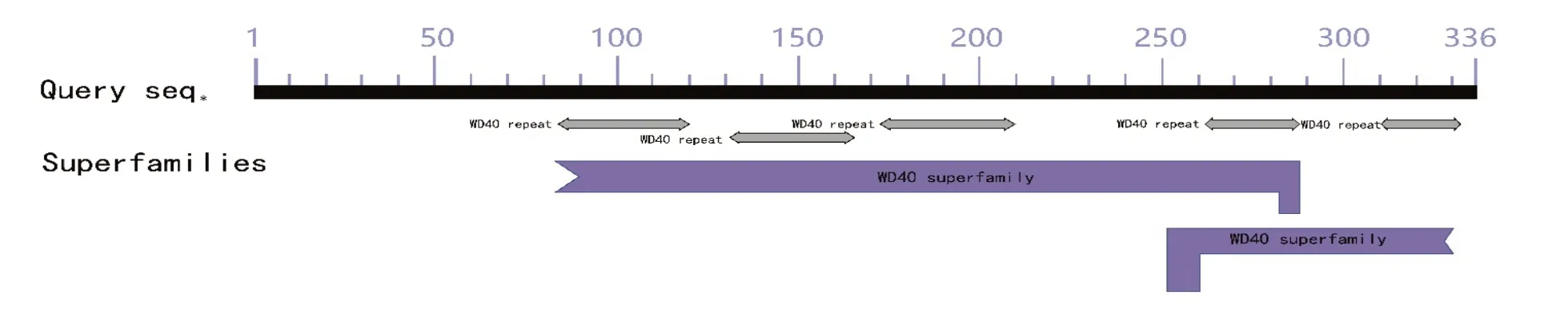
图3 WDR1 蛋白保守结构域分析Fig.3 Conserved domain analysis of WDR1 protein
2.3 VvWDR1 蛋白的系统发育树构建及同源序列比对
对牵牛花、草莓等11 种植物与VvWDR1同源的蛋白序列构建系统发育树(图4),发现:VvW⁃DR1编码的的氨基酸与牵牛花(Pharbitis nil)In⁃WDR1:AB232779、草 莓(Fragaria ananassa)FaTTG1:JQ989287、玉 米(Zea mays)ZmPAC1:AAM76724、陆 地 棉(Gossypium hirsutum)GhTTG1:AAM95641/GhTTG2:AAM95643、越橘(Vaccinium corymbosum)VcTTG1:MH717246、苹果(Malus domestica)MdTTG1:AAF27919、茶树(Camellia sinensis)CsWD40:QLI42590、葡 萄(Vitis vinifera)VvWDR1:ABF66625/VvWDR2:ABF66626、紫 苏(Perilla frutescens)PfWD40:AB059642、拟 南 芥(Arabidopsis thaliana)AtTTG1:NM122360、矮 牵 牛(Petunia hybrida)PhAN11:AAC18941 等相似度较高(图4),其中与PhAN11、AtTTG1的相似度分别高达81.95%、75.95%。
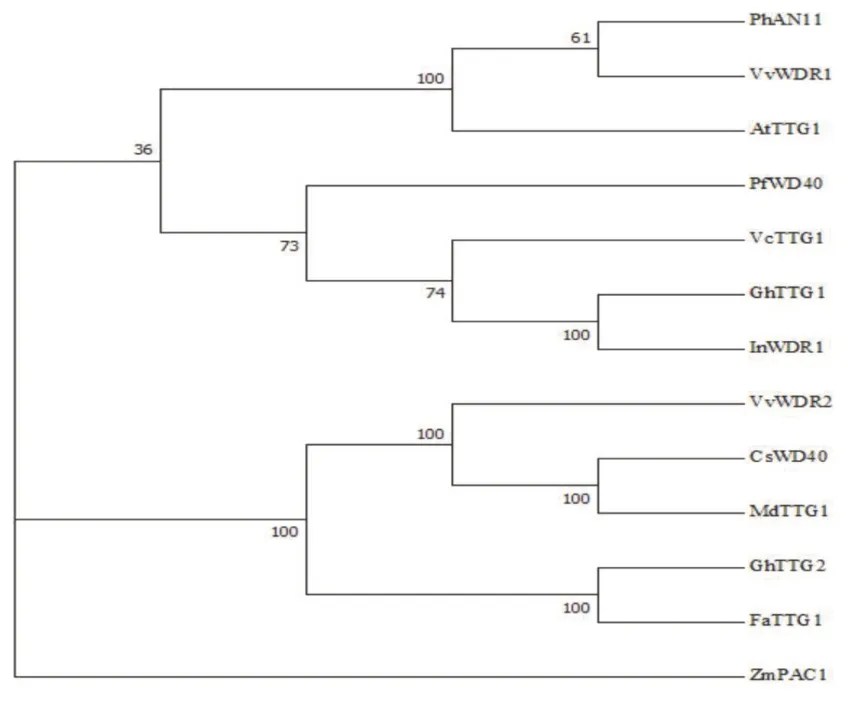
图4 VvWDR1 编码蛋白与其它物种WD40 蛋白系统发育树分析Fig.4 Phylogenetic tree analysis between VvWDR1 encoded pro⁃tein and WD40 protein from other species
2.4 克隆载体构建与鉴定
选取测序成功的pMD-WDR1、pMD-MYC2和空载体pGADT7、pGBKT7 同时用相对应的内切酶进行双酶切。经双酶切验证分别出现1011 bp的WDR1(图5A)、1827 bp 的MYC2(图5B)以及空载体pGBKT7(图5C)、pGADT7(图5D)目的条带,测 序 结 果 显 示WDR1(99.51%)、MYC2(99.34%)均在99%以上,且没有出现移码,编码的蛋白没有改变,可以进行后续实验。

图5 克隆载体及表达空载体双酶切Fig.5 Double digestion of cloning vector and empty expression vector
2.5 酵母重组载体的构建及鉴定
双酶切验证后,分别出现1011 bp 的pGB⁃KT7-WDR1(图6A)、1827 bp 的pGBKT7-MYC2(图6B)和pGADT7-MYC2(图6C)的基因目的条带,且测序结果同源性均在99%以上,表明,酵母重组载体构建成功。
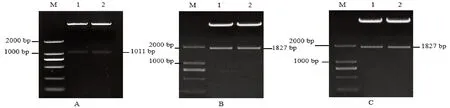
图6 酵母重组载体双酶切验证Fig.6 Double digestion verification of yeast recombinant vector
2.6 诱饵蛋白毒性和自激活检测
将转化的酵母单菌落及pGBKT7 空载体接种到5 mLSD/-Trp 营养选择性培养基后培养24 h 的OD600值均大于0.8(表2),证实:重组质粒均成功转化至酵母AH109 细胞中且对酵母均无毒害作用。

表2 诱饵载体OD600 平均值Table2 The average OD600 of bait plasmid
将上述转化的酵母菌落接种到SD/-Trp/Xα-Gal平板上(图7)。阳性对照及pGBKT7-MYBPA2的转化酵母菌均出现蓝色菌落。而pG⁃BKT7-WDR1、pGBKT7-MYC2的 转 化 子 未 变蓝,表明WDR1、MYC2编码的蛋白不具有酵母自激活功能。
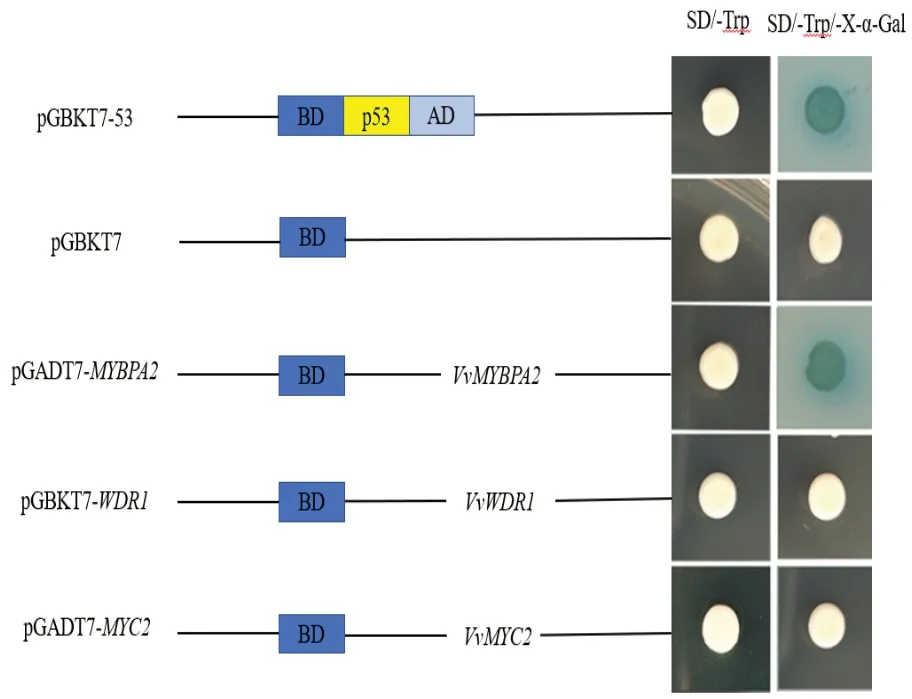
图7 转录自激活活性分析Fig.7 Transcriptional activation activity analysis
2.7 酵母双杂交互作分析
将pGBKT7-WDR1分别与pGADT7-MYB⁃PA2、pGADT7-MYC2共转化酵母细胞作为试验组,将pGBKT7-53 与pGADT7-T 作为阳性对照,pGBKT7-Lam 与pGADT7-T 作为阴性对照,转化酵母细胞后均涂于SD/-Trp-Leu 营养选择性培养基平板上,倒置3 d 观察菌落生长情况。将SD/-Trp-Leu 平板上生长良好的菌落接种于SD/-Trp-Leu-His-Ade 和 SD/-Trp-Leu-His-Ade/X⁃α⁃Gal平板上,二缺平板上菌落均有生长(图8),表明载体已成功转入酵母细胞;阳性对照和试验组均可以在四缺平板上生长,表明在酵母水平WDR1蛋白可以和MYBPA2、MYC2蛋白互作。在SD/-Trp-Leu-His-Ade/X-α-Gal平板上,阳性对照和pGBKT7-WDR1/pGADT7-MYC2共转化酵母变蓝,表明,WDR1蛋白可以和MYB⁃PA2、MYC2蛋白互作,且WDR1 和MYC2 蛋白在酵母中可以结合成稳定的络合物。

图8 酵母双杂交结果Fig.8 Result of yeast two-hybrid
3 讨论
WD40 蛋白序列以N 端11-24 个残基处GH(Gly-His)二肽开始,C 末端以WD(Trp-Asp)氨基酸结尾,因此称为WD40 蛋白。这一类古老的蛋白家族结构高度保守,一般含有4~16 个WD40 重复基序,序列在不同植物中也十分保守。本试验中从‘早黑宝’葡萄中分离的VvWDR1基因所编码的蛋白具有5 个WD40 重复基序,与严莉等[33]的结 果 一 致。Matus[17]于2010 年 首 次 从 葡 萄 中 分 离出WDR1基因,并通过亚细胞定位确定其位于细胞核,异源表达WDR1基因可以促进拟南芥花青素的积累。AtTTG1、PhAN11已被证实可参与植物花青素和原花青素等的生物合成[24],本试验的系统进化树分析表明,葡萄WDR1 与AtTTG1,PhAN11 等聚为一类,这与Matus[17]的结果一致。
本试验中通过构建酵母双杂交诱饵载体pGB⁃KT7-WDR1,且通过试验证明其对酵母AH109 无细胞毒性。通过检测AH109 报告基因MEL1的活性,证明诱饵载体pGBKT7-WDR1在酵母AH109中无自激活作用,该诱饵载体可用于筛选酵母双杂交系统中与WDR1 互作的蛋白,这与王怀琴等[34]的结果相似。
WD40 为MYB-bHLH 相互作用提供了一个对接平台,使MYB-WD40-bHLH 可以形成三元复合物从而调节花青苷等的生物合成[22]。前人研究证实拟南芥中的WD40 蛋白AtTTG1 可与TT2(MYB)、TT8(bHLH)相互作用从而调控其原花色素积累[28]。而对于葡萄中的WDR1 蛋白,在拟南芥中的异源表达研究证实了其可以调控拟南芥花青素的合成[23],并通过互作研究证明了WDR1可与一些MYB 和bHLH 蛋白互作从而调控花青素的合成,例如Xie 等[29]研究发现WDR1 蛋白可与MYBA1 蛋白互作正向调控葡萄浆果的颜色。酵母双杂交结果表明,阳性对照pGBKT7-53与pGADT7-T和试验组pGBKT7-WDR1/pGADT7-MYC2、pGBKT7-WDR1/pGADT7-MYBPA2共转化酵母在SD/-Trp-Leu-His-Ade 四缺平板上均正常生长,证实了葡萄WDR1 蛋白与MYB⁃PA2、MYC2 蛋白之间存在互作。这与前人在拟南芥[24]、草莓[25]、苹果[28]中研究结果相似。此外,研究 表 明 :DkMYB2-DkMYC1-DkWDR1[20]、AtTT2-AtTT8-AtTTG1[24]复 合 体 调 控 下 游 类 黄酮生物合成关键基因ANR、DFR等表达,进而调控原花色素合成;VcWDL2-VcMYBC1-Vcb⁃HLH[26]、MrWD40-1-MrMYB1-MrbHLH1[27]复 合体正向调控花青苷合成。因而,WD40 蛋白参与形成MBW 复合体,进而调控类黄酮代谢。本试验中发现葡萄WDR1 与MYBPA2、MYC2 蛋白存在互作,推测葡萄WDR1 蛋白可能与MYBPA2、MYC2蛋白互作进而调控原花色素和花青苷的积累。
4 结论
本试验克隆得到葡萄WDR1基因,对其序列进行了生物信息学分析;并在构建酵母双杂交表达载体pGBKT7-WDR1、pGADT7-MYC2、pGB⁃KT7-MYC2的基础上,证实了VvWDR1在酵母体系中不具有转录自激活功能,且葡萄WDR1 与VvMYBPA2、VvMYC2编码的蛋白存在互作。

