低浓度茉莉酸甲酯对烟草长柄腺毛发生发育的影响
段史江,陈小龙,吴飞跃,王占伟,程小强,张子颖,李亚纯,谢天琪,韩助君,杨永锋*
低浓度茉莉酸甲酯对烟草长柄腺毛发生发育的影响
段史江1,陈小龙2,吴飞跃3,王占伟2,程小强1,张子颖2,李亚纯1,谢天琪2,韩助君1,杨永锋2*
(1.江西省烟草公司吉安市公司,江西 吉安 343009;2.河南中烟工业有限责任公司,郑州 450016;3.福建中烟工业有限责任公司,厦门 361000)
茉莉酸甲酯(MeJA)对烟草长柄腺毛的发生具有强烈的诱导作用,但浓度过高时会抑制烟苗发育。本文以云烟87幼苗为材料,研究低浓度MeJA对腺毛发育和腺毛分泌物的影响,并利用qRT-PCR技术研究腺毛发生发育调控基因对MeJA的应答模式。结果表明,随着MeJA喷施浓度的升高,长柄腺毛的密度和腺头直径逐渐增加;喷施300 μmol/L MeJA对长柄腺毛发生和发育有显著的诱导作用,且对叶片发育无明显影响;当MeJA喷施浓度达到600 μmol/L时,叶片发育受到抑制。叶面化学成分分析发现,与未喷施MeJA的对照相比,喷施300 μmol/L MeJA后西柏烷二萜、烷烃和蔗糖酯含量增加约一倍。基因应答模式研究发现,西柏烷二萜合成基因和,以及酯转运蛋白基因受MeJA诱导表达;烟草腺毛发生调控基因、、、和对MeJA处理均具有应答反应,其中和的表达受到MeJA诱导,而、和的表达受到MeJA抑制。综上,300 μmol/L MeJA可以调控腺毛发育相关基因的表达,安全、有效地促进长柄腺毛发生发育以及腺毛分泌物的合成。
烟草;腺毛;茉莉酸甲酯;西柏烷二萜;蔗糖酯;基因表达
植物表皮毛作为植物与环境间的天然屏障,可减少水分及热量散失,缓冲日光直射,抵抗病原菌和昆虫等的侵害,在应对各种生物胁迫及非生物胁迫中发挥重要作用[1-3]。植物表皮毛的结构和形态多样,依据分泌腺的有无,可分为保护毛(非腺体毛)和腺毛。栽培烟草(L.)的表皮毛包括3种类型:保护毛、长柄腺毛和短柄腺毛;长柄腺毛和短柄腺毛形态差异较大,其中长柄腺毛由4~6个柄细胞和1~6个头细胞组成,可以特异地合成和分泌西柏烷二萜化合物和蔗糖酯,而短柄腺毛由1个柄细胞和8~16个头细胞组成,可以外泌烟碱物质[4-5]。
烟草腺毛分泌能力旺盛,分泌物占烟草叶面化学物总量的85%,其中,长柄腺毛特异合成的西柏烷二萜和蔗糖酯是烟草叶面化学的主要成分,也是重要的致香前体物质[6-7],对于烟株抗性和烟叶香气品质具有重要意义。研究发现,西柏烷二萜具有抗真菌和抗蚜虫活性[8-9],蔗糖酯可以调节种子萌发和植物发育过程、同时具有很高的杀虫活性[10-11]。
茉莉酸甲酯(methyl jasmonate, MeJA)是茉莉酸(JA)的衍生物,常用来替代JA进行外施,以增强植物对生物和非生物胁迫的抗性。例如,在开花期喷施MeJA可以有效地促进水稻和小麦的颖花开放,提高制种产量[12-13]。在姜黄生育中期喷施800 μmol/L MeJA可以显著增加姜黄产量和姜黄素含量[14]。对百合花朵喷施50~60 μmol/L MeJA可以增加萜烯类、醇类和酮类等花香挥发物的释放量[15]。对烟草幼苗喷施MeJA可以提高烟草的耐冷性和抗虫性[16-17]。对栽培烟草体外喷施茉莉酸甲酯对长柄腺毛发生具有强烈的诱导作用,但是,喷施高浓度MeJA会严重抑制烟苗的发育[18-20]。
本文以云烟87幼苗为试验材料,喷施不同浓度的MeJA后进行烟苗和腺毛形态的比较观察,明确能够促进长柄腺毛发生且不影响叶片发育的MeJA喷施浓度,以及MeJA对腺毛分泌物的诱导效果,同时探索MeJA诱导腺毛发生、发育可能的分子机制。
1 材料与方法
1.1 烟草材料和培育条件
云烟87进行漂浮育苗,4周后进行盆栽,每盆1株,幼苗在光强2000 Lx,16 h/8 h明/暗光周期,26 ℃的光照培养室用霍格兰营养液培养。
1.2 试验处理
选择生长一致的三叶期云烟87幼苗,分别喷施浓度为0、300、600 和900 μmol/L MeJA溶液,保证所有叶片充分湿润(每株2 mL溶液),每周喷施1次,喷施3次,最后1次喷施1周后观察腺毛形态。每个处理5株烟苗,试验重复3次。
1.3 腺毛形态观察
对照和处理组分别取叶龄21 d的叶片,置于0.2%(/)罗丹明B水溶液中浸染30 min,然后用蒸馏水漂洗3次。利用超景深显微镜对叶片表面进行表皮毛形态观察和密度统计。
1.4 叶面化学成分分析
对照和处理组分别取叶龄21 d的叶片,取直径为10 cm的叶圆片20片,在二氯甲烷中依次浸提2 s,重复8次,在浸提液中加入1 mL内标{2.02 mg/mL蔗糖八乙酸酯(C28H38O19)和2.47 mg/mL正十七烷醇[CH3(CH2)15CH2OH]的混合液},旋转蒸发仪浓缩后用氮吹仪吹干。加入500 μL的1∶1 (∶)N,N-二甲基甲酰胺和N,O-双三甲硅基三氟乙酰胺,置于75 ℃水浴中反应1 h,加入N,O-双乙酰胺和吡啶各125 μL,获得检测液。利用GC/MS(色谱仪型号HP-5890,质谱仪型号vc-70SE,美国Agilent公司)进行化学成分的定性和定量分析[21]。
1.5 基因表达量分析
对照和处理组分别取叶龄21 d的叶片,撕取叶表皮按照Trizol法提取总RNA,并反转录为cDNA。将已报道的植物腺毛发育基因()[22]、[23]、()[24]、()[25]、()[26]和()[27]序列提交至NCBI,通过同源比对下载对应的烟草直系同源基因序列,使用Premier Prime 5.0软件设计特异引物(表1)。按照LightCycler® 480 SYBR Green I Master qPCR试剂盒说明书在LightCycler® 480 Ⅱ型荧光定量PCR 仪上进行qRT-PCR反应。以作为内参基因,按照2−ΔΔCT公式[28]计算各基因的相对表达量。
1.6 数据处理和统计方法
采用Excel 2007软件绘图制表,利用SPSS 22软件进行数据统计分析,用新复极差法分析均值差异的显著性,显著性水平<0.05。

表1 qRT-PCR引物序列
2 结 果
2.1 叶面喷施不同浓度MeJA对幼苗和腺毛发育的影响
云烟87幼苗分别喷施浓度为0、300、600和900 μmol/L的MeJA溶液,3周后观察其腺毛形态。结果显示,未喷施MeJA的云烟87幼苗(对照)叶片具有长柄腺毛、短柄腺毛和保护毛3种表皮毛类型,其中长柄腺毛比例最高,短柄腺毛次之,保护毛含量最少。随着MeJA喷施浓度的升高,长柄腺毛的密度和头部直径呈增加趋势,保护毛密度逐渐降低,而短柄腺毛的密度和形态无显著变化(图1-3)。喷施300 μmol/L MeJA后幼苗的生长发育没有受到明显影响;当MeJA浓度增至600 μmol/L时,叶片出现内卷现象;当MeJA浓度达到900 μmol/L时,叶片发黄和内卷现象严重。可见,喷施300 μmol/L MeJA可以显著诱导长柄腺毛发生,促进其腺头发育,且对叶片发育无明显影响。

注:Bar = 100 μm。
图1 MeJA喷施浓度对烟苗和腺毛发育的影响
Fig. 1 Effects of MeJA concentrations on the development of tobacco seedlings and glandular trichomes

注:n = 20±SE,不同字母表示处理之间存在显著差异(p<0.05),下同。

图3 MeJA喷施浓度对长柄腺毛腺头直径的影响
2.2 喷施 MeJA处理对腺毛分泌物的影响
选择长势一致的三叶期烟苗进行300 μmol/L MeJA溶液喷施试验,每周喷施1次,喷施3次。为观察腺毛糖酯含量的变化,对叶片进行糖酯染色后观察腺毛形态。表型观察结果(图4)与前期喷施结果相似,与对照相比,喷施300 μmol/L MeJA溶液后烟苗的生长发育没有受到抑制;总表皮毛密度明显增加,尤其是长柄腺毛密度急剧增加;腺毛糖酯染色的着色强度增加,腺毛分泌的糖酯外泌至腺毛柄部。
利用二氯甲烷萃取叶面化学成分,进行GC/MS检测,分析喷施300 μmol/L MeJA溶液对西柏烷二萜和蔗糖酯含量的影响(图5)。分析结果显示,喷施300 μmol/L MeJA后叶面分泌物总量增加近一倍其中西柏烷二萜含量由9.56 μg/cm2增至16.56 μg/cm2;烷烃类含量由1.46 μg/cm2增至2.69 μg/cm2;糖酯类含量由3.07 μg/cm2增至6.44 μg/cm2。进一步分析西柏烷二萜和蔗糖酯成分的变化发现,喷施300 μmol/L MeJA溶液后西柏三烯一醇、西柏三烯二醇、以及Ⅰ型和Ⅱ型蔗糖酯的含量均高于对照(图6)。综上,叶片喷施300 μmol/L MeJA可以显著增加长柄腺毛的分泌物含量。

图4 喷施300 μmol/L MeJA后腺毛糖酯染色

注:**,p<0.01。
2.3 烟草腺毛西柏烷二萜合成和酯转运蛋白基因对MeJA的应答
由图7可见,叶面喷施MeJA 溶液后,西柏烷二萜合成关键基因()和()的表达水平持续增加,在喷施后6 h达到峰值,相对表达量为对照(0 h)的2.3~2.5倍,随后表达量逐渐降低至对照的1.5~1.7倍。表达量变化模式呈现先升高再降低的趋势,其表达量在喷施后12 h达到峰值,相对表达量为对照的5.3倍,随后表达量逐渐降低至对照的2.5倍。,和的表达水平不受MeJA诱导。
2.4 烟草腺毛发生调控基因对MeJA的应答
由图8可见,6个烟草腺毛发生调控基因主要呈现4种表达模式:在叶面喷施MeJA溶液后,的表达水平逐渐升高,在喷施后24 h达到峰值,相对表达量为对照(0 h)的2.1倍,喷施后72 h表达量降低为对照的1.5倍;的表达水平不受MeJA诱导;的表达水平在叶面喷施MeJA 溶液后1 h即达到峰值,表达量为对照的2.1倍,随后表达水平逐渐降低,喷施后72 h的表达量为对照的1.3倍;、和对MeJA的应答模式相似,在叶面喷施MeJA溶液后,3个基因的表达水平呈现下调模式,喷施MeJA前的基因表达量约为MeJA喷施后72 h的2.3~2.6倍。
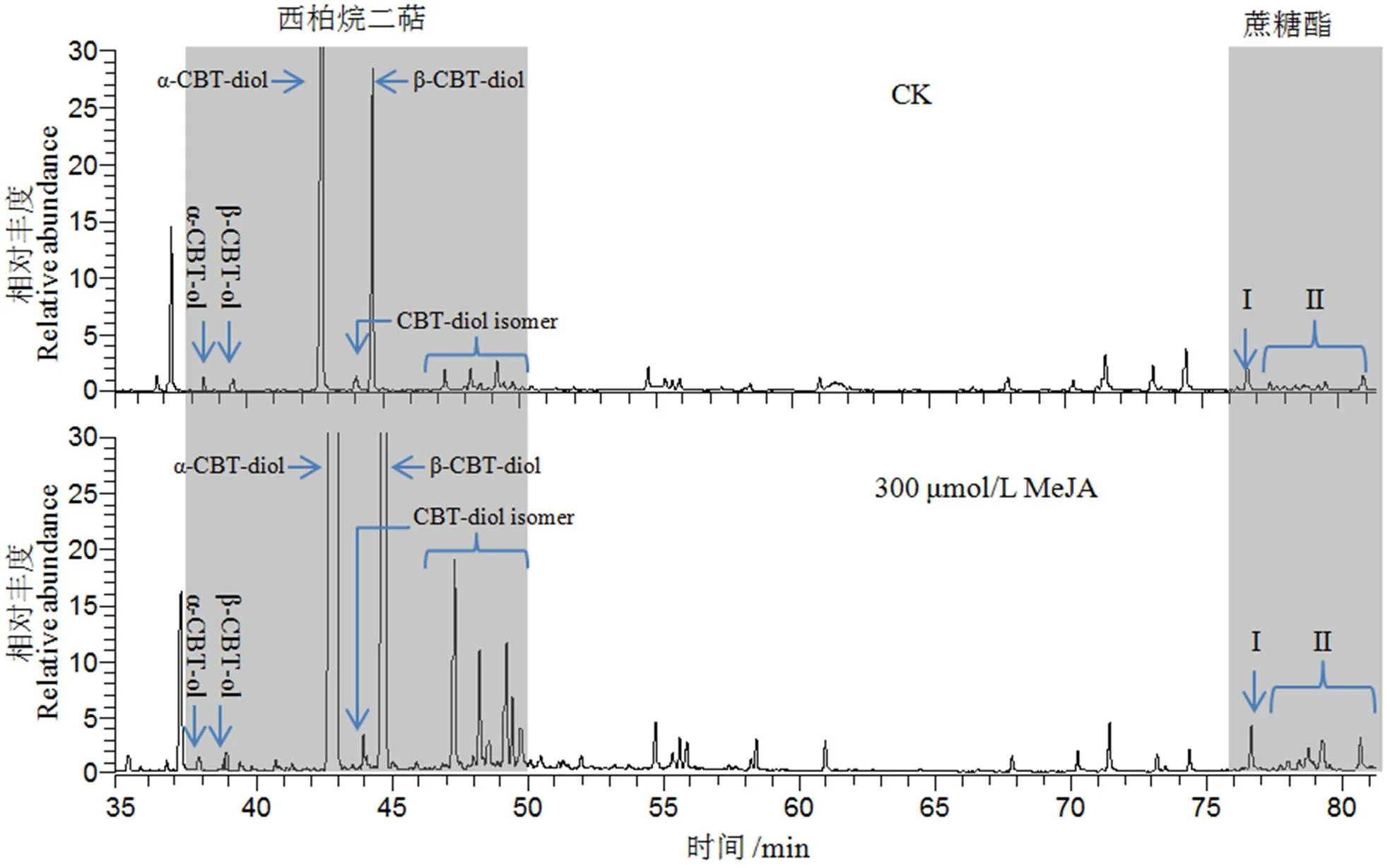
图6 西柏烷二萜和蔗糖酯含量分析

图7 西柏烷二萜合成和酯转运蛋白基因对MeJA的应答模式
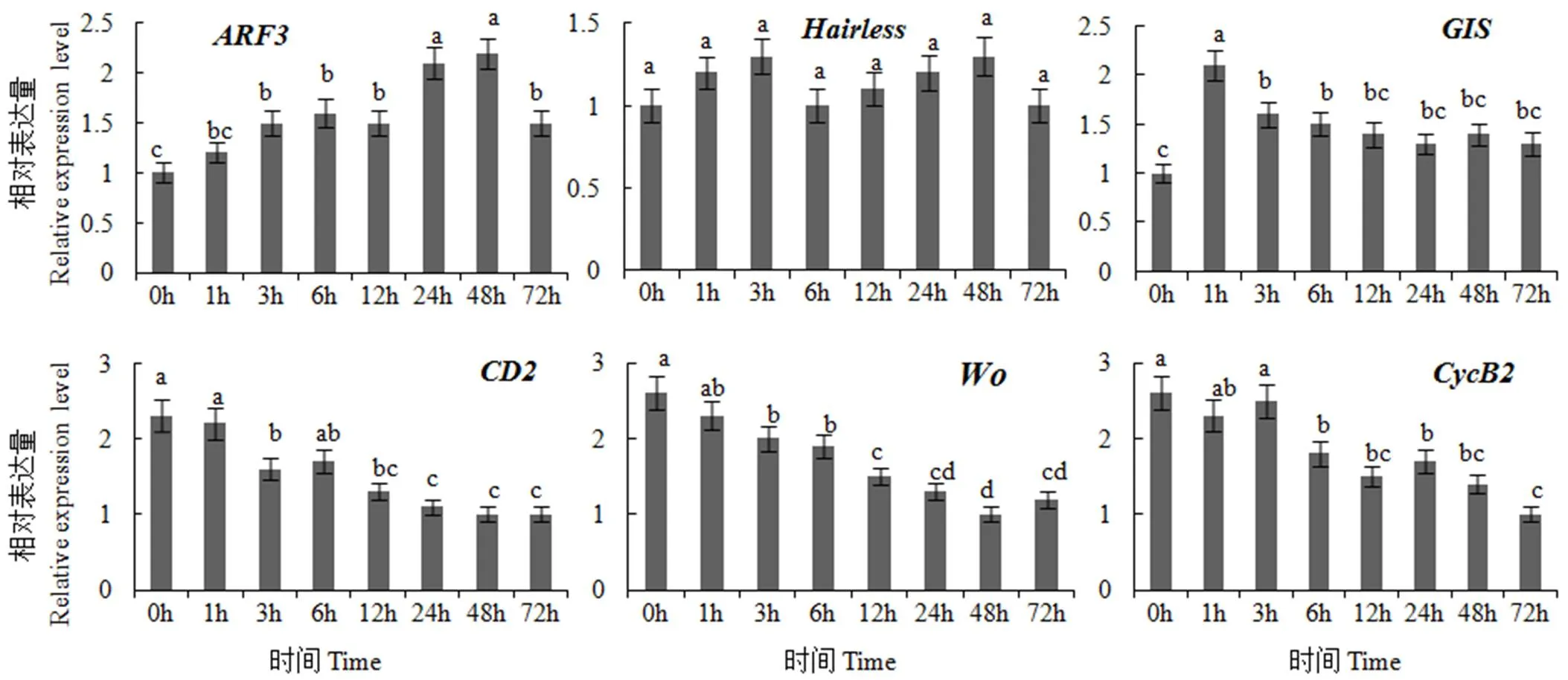
图8 烟草腺毛发生调控基因对MeJA的应答模式
3 讨 论
茉莉酸(JA)及其挥发性衍生物茉莉酸甲酯(MeJA)和氨基酸衍生物统称为茉莉素类物质,广泛参与调节植物生长发育,如根系生长、植物育性以及衰老过程等。大量研究表明,对栽培烟草体外喷施高浓度MeJA能显著提高长柄腺毛的密度,这些研究主要集中在MeJA诱导长柄腺毛的发生方面。但是,上述试验所用MeJA浓度较大,对叶片发育造成抑制作用[18-20]。例如,娄亚楠等[19]的研究发现在烟草幼苗的叶面喷施1~5 mmol/L的MeJA对烟草长柄分泌型腺毛发生具有强烈的诱导作用,腺毛的形态变化随着MeJA处理浓度的提高而更加明显,当喷施浓度达到5 mmol/L MeJA时,腺毛密度和腺头体积达到最大值,但随着MeJA浓度的增加会出现叶片变黄和早衰现象[19]。本文主要研究低浓度MeJA对长柄腺毛发生的诱导效果,结果发现喷施MeJA浓度达到600 μmol/L时会抑制烟苗的生长发育,当降低MeJA的喷施浓度至300 μmol/L时,烟苗的生长不仅没有受到明显的影响,还能够显著增加长柄腺毛的密度和腺头体积。
烟草叶面的主要化学成分西柏烷二萜和蔗糖酯均由长柄腺毛特异合成,目前未见关于JA诱导腺毛分泌物合成的报道。烟草西柏烷二萜的生物合成是以焦磷酸香叶基香叶酯(geranylgeranyl-PP,GGPP)为起始物分两步进行[29]:第一步,GGPP被CBTS催化合成西柏三烯一醇;第二步,西柏三烯一醇被CYP71D16催化形成西柏三烯二醇。本研究发现和基因均受MeJA诱导表达,叶面喷施300 μmol/L MeJA后西柏烷二萜含量增加了73.22%。前人从烟草腺毛文库中鉴定出4个糖酯转运蛋白编码基因(),其中仅在长柄腺毛中表达[30]。本研究发现叶片喷施MeJA后腺毛中蔗糖酯含量增加约1倍,进一步分析4个基因对MeJA 的应答模式发现,仅受MeJA激活诱导表达,推测可能是调控长柄腺毛中蔗糖脂转运的重要基因。
近年来,关于JA调控烟草长柄腺毛发生的分子机制已经取得一些成果,发现烟草Wo和B型细胞周期蛋白CycB2可以形成复合体,响应植物体内的JA水平,协同调控长柄腺毛的发生[26-27,31]。其中,在烟草长柄腺毛发生过程中起负调节作用[26]。[27]和[25]属于家族基因,均可正向调控腺毛发育。本文研究普通烟草、和对MeJA的应答模式发现,3个基因的表达量均受到外源MeJA抑制。可见,应用qRT-PCR技术可以初步研究基因对于激素和环境等外源因子的应答模式,但不能实际反映该基因在植物体内的作用方式。
除JA外,生长素和赤霉素可能同时参与腺毛的发生。在番茄中对生长素应答基因进行RNA干扰后,表皮细胞及其上附着的保护毛和腺毛的形成均受到抑制,推测是表皮毛起始的重要基因[22]。烟草基因可能通过赤霉素信号通路正向调控腺毛的发生[24]。本研究发现普通烟草和基因均受外源MeJA诱导表达,推测植物腺毛的发生可能同时受到多种激素的协同调控,这些信号通路之间存在交叉调控。
综上分析,推测烟草叶面喷施MeJA后长柄腺毛的密度和腺头显著增加的原因是MeJA调控腺毛发育调控基因、、、和的表达,进而促进长柄腺毛的发生和发育。此外,西柏烷二萜合成基因和,以及长柄腺毛酯转运蛋白基因均受MeJA诱导表达,从而增加腺毛分泌物的含量。
4 结 论
研究表明,喷施300 μmol/L MeJA对长柄腺毛发生和发育有显著的诱导作用,且对叶片发育无明显影响。喷施300 μmol/L MeJA后长柄腺毛分泌物西柏烷二萜、烷烃和蔗糖酯的含量增加约1倍。基因表达模式研究发现MeJA可以调控、、、、、、和的表达。
[1] MAURICIO R, RAUSHER M D. Experimental manipulation of putative selective agents provides evidence for the role of natural enemies in the evolution of plant defense[J]. Evolution, 1997, 51(5): 1435-1444.
[2] LI S, TOSENS T, HARLEY P C, et al. Glandular trichomes as a barrier against atmospheric oxidative stress: relationships with ozone uptake, leaf damage and emission of lox products across a diverse set of species[J]. Plant Cell & Environment, 2018, 41(6): 1263-1277.
[3] YAN A, PAN J, AN L, et al. The responses of trichome mutants to enhanced ultraviolet-B radiation in[J]. J Photochem Photobiol B, 2012, 113: 29-35.
[4] ROBERTO B, WRENSMAN E A. Trichome type, density and distribution on the leaves of certain tobacco varieties and hybrids[J]. Tobacco Science, 1966, 10: 157-161.
[5] MEYBERG M, KROHN S, BRCIMMER B, et al. Ultrastructure and secretion of glandular trichomes of tobacco leaves[J]. Flora, 1991, 185(5): 357-363.
[6] CHANG S Y, GRUNWALD C. Duvatrienediol, alkanes, and fatty acids in cuticular wax of tobacco leaf of various physiological maturity[J]. Phytochemistry, 1976, 15(6): 961-963.
[7] JOHNSON A W, SEVERSON R F, HUDSON J, et al. Tobacco leaf trichomes and their exudates[J]. Tobacco Science, 1985, 29: 67-72.
[8] WANG E M, WANG R, DEPARASIS J, et al. Suppression of a p450 hydroxylase gene in plant trichome glands enhances natural-product-based aphid resistance[J]. Nature Biotechnology, 2001, 19(4): 371-374.
[9] ZHANG H Y, ZHANG S T, YANG Y X, et al. Metabolic flux engineering of cembratrien-ol production in both the glandular trichome and leaf mesophyll in[J]. Plant & Cell Physiology, 2018, 59(3): 566-574.
[10] BUTA G J, LUSBY W R, NEAL J W J, et al.Sucrose ester fromactive against the greenhouse whitefly[J]. Phytochemistry, 1993, 32(4): 859-864.
[11] SHINOZAKI Y, MATUSUZAKI T, SUHARA S, et a1. New types of glycolipids from the surface lipids of[J]. Agricultural and Biological Chemistry, 1991, 55(3): 751-756.
[12] 杨宇尘,杜志敏,张小鹏,等. 抽穗开花期喷施MeJA对粳稻产量和品质的影响[J]. 作物杂志,2021,6(2):71-76.
YANG Y C, DU Z M, ZHANG X P, et al. Effects of spraying methyl jasmonate on yield and grain quality of japonica rice during heading and flowering stage[J]. Crops, 2021, 6(2): 71-76.
[13] 王大伟,高庆荣,张爱民,等. 茉莉酸甲酯(MeJA)对小麦开颖的诱导效应[J]. 麦类作物学报,2007,27(2):293-297.
WANG D W, GAO Q R, ZHANG A M, et al. Effect of methyl jasmonate on the induction of spikelets opening in wheat[J]. Journal of Triticeae Crops, 2007, 27(2): 293-297.
[14] 晏小霞,任保兰,王茂媛,等. 外源茉莉酸甲酯对姜黄产量和姜黄素含量的影响[J]. 时珍国医国药,2020,31(11):2735-2737.
YAN X X, REN B L, WANG M Y, et al. Effect of exogenous MeJA on turmeric yield and curcumin content[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(11): 2735-2737.
[15] 吴琦,付宇辰,闫子飞,等. 喷施茉莉酸甲酯对百合花香的影响[J]. 江苏农业科学,2018,46(6):100-104.
WU Q, FU Y C, YAN Z F, et al. Effect of methyl jasmonate (MeJA) on floral scent of Lilium “Siberia”[J]. Jiangsu Agricultural Sciences, 2018, 46(6): 100-104.
[16] 马晓寒,张杰,张环纬,等. 通过外源MeJA抑制H2O2积累提高烟草的耐冷性[J]. 作物学报,2019,45(3):411-418.
MA X H, ZHANG J, ZHANG H W, et al. Exogenous MeJA improves cold tolerance of tobacco by inhibiting H2O2accumulation[J]. Acta Agronomica Sinica, 2019, 45(3): 411-418.
[17] 张林娜,游秀峰,刘向阳,等. 茉莉酸甲酯诱导烟草抗虫的有效浓度和持效期[J]. 中国烟草学报,2017,23(4):64-69.
ZHANG L N, YOU X F, LIU X Y, et al. Effective concentration and period of methyl jasmonate for inducing tobacco resistance to insect pests[J]. Acta Tabacaria Sinica, 2017, 23(4): 64-69.
[18] 冯琦,王永,武东玲等. 外源MeJA诱导烟草叶面防御反应[J]. 中国烟草科学,2013,34(5):83-88.
FENG Q, WANG Y, WU D L, et al. Defense response of tobacco leaf surface to exogenous methyl jasmonate[J]. Chinese Tobacco Science, 2013, 34(5): 83-88.
[19] 娄亚楠,王召军,杨欣玲,等. 茉莉酸甲酯对烟草分泌型和非分泌型腺毛形态发生的影响[J]. 中国烟草学报,2018,24(2):24-29.
LOU Y N, WANG Z J, YANG X L, et al. Effects of exogenous methyl jasmonic acid on the morphogenesis of tobacco glandular and non-glandular trichome[J]. Acta Tabacaria Sinica, 2018, 24(2): 24-29.
[20] ZHANG H Y, LI W J, NIU D X, et al. Tobacco transcription repressors NtJAZ: potential involvement in abiotic stress response and glandular trichome induction[J]. Plant Physiology and Biochemistry, 2019, 141: 388-397.
[21] 王霄龙,杨永霞,张松涛,等. 中间香型烤烟叶面腺毛形态及分泌特性研[J]. 中国烟草学报,2013,19(3):45-48.
WANG X L, YANG Y X, ZHANG S T, et al. Trichome morphology and secreting feature in neutral flavor type flue-cured tobacco leaf[J]. Acta Tabacaria Sinica, 2013, 19(3): 45-48.
[22] ZHANG X, YAN F, TANG Y, et a1. Auxin response geneplays multiple roles in tomato development and is involved in the formation of epidermal cells and trichomes[J]. Plant & Cell Physiology, 2015, 56(11): 2110-2124.
[23] KANG J H, CAMPOS M L, ZEMELIS-DURFEE S, et a1. Molecular cloning of the tomato Hairless gene implicates actin dynamics in trichome-mediated defense and mechanical properties of stem tissue[J]. Journal of Experimental Botany, 2016, 67(18): 5313-5324.
[24] LIU Y, LIU D, KANG A R, et al.regulates glandular trichome initiation through GA signaling in tobacco[J]. Plant Molecular Biology, 2018, 98: 153-167.
[25] Nadakuduti S S, Pollard M, KOSMA D K, et a1. Pleiotropic phenotypes of the sticky peel mutant provide new insight into the role ofin epidermal cell function in tomato[J]. Plant Physiology, 2012, 159(3): 945-960.
[26] WANG Z J, YAN X X, ZHANG H Y, et a1.negatively regulates tobacco glandular trichome formation, exudate accumulation, and aphid resistance[J]. Plant Molecular Biology, 2022, 108(1): 65-76.
[27] WU M L, CUI Y C, GE L, et al.represses Nbwo activity via a negative feedback loop in tobacco trichome development[J]. Journal of Experimental Botany, 2020, 71(6): 1815-1827.
[28] LIVAKA K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25: 402-408.
[29] YAN N, DU Y, LIU X, et al. Chemical structures, biosynthesis, bioactivities, biocatalysis and semisynthesis of tobacco cembranoids: an overview[J]. Industrial Crops and Products, 2016, 83: 66-80.
[30] CHOI Y E, LIM S, KIM H J, et al. Tobacco, a glandular-specifific lipid transfer protein, is required for lipid secretion from glandular trichomes[J]. Plant Journal, 2012, 70: 480-491.
[31] YAN X X, CUI L P, LIU X Y, et al.is required for jasminate-meditated glandular trichomes development in[J]. Physiologia Plantarum, 2021, 174(2): e13666.
Effects of Low Concentration Methyl Jasmonate on Initiation and Development of Long-stalk Glandular Trichomes in Tobacco
DUAN Shijiang1, CHEN Xiaolong2, WU Feiyue3, WANG Zhanwei2, CHENG Xiaoqiang1, ZHANG Ziying2, LI Yachun1, XIE Tianqi2, HAN Zhujun1, YANG Yongfeng2*
(1. Jiangxi Province Ji’an Branch Company, China National Tobacco Corporation, Ji’an, Fujian 343009, China; 2. China Tobacco Henan Industrial Co., Ltd., Zhengzhou 450016, China; 3. China Tobacco Fujian Industrial Co., Ltd., Xiamen 361000, China)
Methyl jasmonate (MeJA) has a strong induction effect on the initiation of long-stalk glandular trichomes in tobacco, but the development of tobacco seedlings can be inhibited by high concentration MeJA. To study the effects of low concentration MeJA on the development of glandular trichomes and trichome secretions, and to explore the responsive patterns of related genes,cv. Yunyan 87 seedlings at three-leaf stage were separately sprayed with MeJA at different concentrations. The results showed that the density and glandular head of long-stalk glandular trichomes increased gradually with the increase of MeJA concentrations. Among them, 300 μmol/L MeJA had a significant effect on induction of long-stalk glandular trichomes, and had no effect on leaf development. When treated with high concentration MeJA (600 μmol/L MeJA), the growth and development of leaves were inhibited. Analysis of the chemical components on leaf surface showed that the contents of cembranoids, alkanes and sucrose esters were nearly doubled after sprayed with 300 μmol/L MeJA. qRT-PCR was used to study the gene expression pattern after MeJA treatments. It was found that the key genes related to cembranoid biosynthesisand, as well as the lipid transporter gene, were activated by MeJA treatments. The expressions of,,and, which may regulate the initiation of glandular trichomes, were responsive to MeJA treatments. Among them,andwere induced by MeJA, while,andwere repressed by MeJA. These results indicated that 300 μmol/L MeJA can regulate the expression of genes related to glandular trichome development, and thus safely and effectively promote the initiation and development of long-stalk glandular trichomes and trichome secretion synthesis.
tobacco; glandular trichome; methyl jasmonate; cembranoid; sucrose ester; gene expression
10.13496/j.issn.1007-5119.2022.06.003
S572.01
A
1007-5119(2022)06-0017-08
江西省烟草公司吉安市公司资助项目(202136080027195)
段史江(1986-),硕士,高级农艺师,主要从事烟草生产技术研发与推广工作。E-mail:574227118@qq.com
,E-mail:yangyf@hatic.com
2022-07-28
2022-10-13

