替米沙坦抑制Mtdh表达激活自噬在改善腹膜纤维化中的作用
王育娴 李淑婷 陈斯佳 罗丛伟 龙海波 彭芬芬
腹膜透析因其具有保护残余肾功能等优点,广泛应用于终末期肾病患者[1]。腹膜纤维化是导致腹膜超滤衰竭的主要原因之一[2],目前认为,腹膜纤维化的核心机制是腹膜间皮细胞间充质转分化(MMT)[2]。最初在人胚胎初级星形胶质细胞中发现的异黏蛋白metadherin(Mtdh),又名星形细胞上调基因1(AEG-1)与肿瘤进展和迁移关系密切[3]。研究发现Mtdh在糖尿病肾病模型[4-5]、单侧输尿管梗阻模型[6]的肾脏中高表达,参与肾脏纤维化[6]。也有研究发现Mtdh参与调控肿瘤细胞的自噬水平[7-10]。因此,我们推测Mtdh有可能通过调控自噬参与腹膜纤维化的发生发展。
血管紧张素Ⅱ受体拮抗剂(ARB) 通过竞争性抑制血管紧张素Ⅱ与血管紧张素受体Ⅰ结合,阻断肾素-血管紧张素-醛固酮系统(RAAS)[11]。已证实ARB可缓解肾脏纤维化[12-13]、肝纤维化[14]和腹膜纤维化[15],但其对Mtdh的影响以及与自噬的关系尚不明确。因此,我们采用4.25%葡萄糖腹膜透析液小鼠腹膜纤维化模型和转化生长因子β1(TGF-β1)诱导的细胞MMT模型,探究替米沙坦对Mtdh表达和自噬的影响,为腹膜纤维化的防治提供新依据。
材料和方法
主要材料
试剂 4.25%葡萄糖腹膜透析液(中国百特);抗小鼠β-actin抗体(EarthOx)、抗兔纤维连接蛋白(Fib)抗体、抗兔Mtdh抗体(Abcam)、抗小鼠E-钙黏蛋白(E-cadherin)抗体(BD)、抗兔Ⅰ型胶原蛋白(ColⅠ)(博士德)、抗兔微管相关蛋白轻链3 (LC3A/B)抗体(CST);抗兔TGF-β1抗体(abcam);重组人TGF-β1细胞因子(R&D);鼠兔通用免疫组化试剂盒(DAKO);Masson染色试剂盒(广州浩码生物); lipofectamineTM2000(Invitrogen);胎牛血清和细胞培养基DMEM/F12(Gibco),Mtdh siRNA序列由吉玛公司合成:(正义链5'-GCUCUUCCAACUGGGAAAUTT-3', 反义链5'-AUUUCCCAGUUGGAAGAGCTT-3')。
小鼠腹膜纤维化动物模型建立 SPF级8~10周龄C57BL/6J同窝小鼠18只(南方医科大学动物中心),按随机分为3组(n=6,雌雄各3只),即对照组,模型组(采用4.25 %葡萄糖腹膜透析液腹腔注射,3 ml/只)和替米沙坦干预组[4.25 %葡萄糖腹膜透析液腹腔注射,然后予替米沙坦10 mg/(kg·d)灌胃]),于28d后收集壁层腹膜和脏层腹膜。
标本收集实验结束后处死小鼠,沿正中开腹,将壁层腹膜沿正中十字剪开,分为4小块,每块约1 cm×1 cm,用冷PBS清洗后,立刻放入碘酸钠-赖氨酸-多聚甲醛固定液固定,常规脱水、石蜡包埋,切成3μm的石蜡切片,进行Masson染色和免疫组织化学染色。脏层腹膜取出后立刻置于液氮里保存备用,用于Western Blot检测。
WesternBlot检测提取动物组织总蛋白,采用BCA法进行蛋白定量。蛋白98℃变性10 min,行SDS-PAGE电泳,转膜,5%脱脂奶粉常温封闭1h,分别加入一抗抗体,β-actin(1∶5 000)、ColⅠ(1∶400)、Fib(1∶5 000)、E-cadherin(1∶2 500)、Mtdh(1∶5 000)、TGF-β1(1∶1 000)、LC3A/B(1∶1 000),4℃孵育过夜,次日TBST洗3次,每次5 min,加入对应HRP抗兔或小鼠二抗(1∶5 000)室温孵育1h,TBST洗3次,每次5 min,化学发光仪发光并摄像。以上实验进行了3次平行实验。
细胞培养及干预人腹膜间皮细胞(HMrSV5)使用含10%胎牛血清的 DMEM/F12 培养基,在37℃、5%培养箱里培养。Lipofectamine 2000细胞转染实验按照说明书进行,首先分别将阴性对照(siNC)和下调Mtdh的siRNA(siMtdh)转染至细胞里,转染6h后换液,换液时按照实验分组给予或者不给予TGF-β1(5 ng/ml)干预。干预48h提取细胞总蛋白并行Western Blot检测LC3A/B、ColⅠ、Mtdh的表达。以上实验进行了三次平行实验。
统计学方法采用《SPSS 20.0》统计软件进行数据统计分析,统计数据以均数±标准差表示,多组间比较采用One-way ANOVA分析法,进一步组间多重比较用LSD(假定方差齐性时)或 Dunnett(未假定方差齐时),P<0.05为差异有统计学意义。
结 果
小鼠壁层腹膜厚度变化Masson染色结果显示,对照组小鼠壁层腹膜厚度为13.497 6±2.239 9 μm,模型组腹膜厚度为55.266 4±9.446 84 μm,两组统计学差异显著(P=0.026);替米沙坦组腹膜厚度为17.521 8±1.793 16 μm,明显低于模型组(P=0.038),腹膜纤维化改善(图1A)。
小鼠腹膜纤维化的变化免疫组织化学染色结果显示,模型组Fib和ColⅠ的染色强度明显高于对照组;替米沙坦干预组Fib和ColⅠ的染色强度明显低于模型组(图1B)。Western Blot检测发现,模型组Fib(P=0.048)、ColⅠ(P<0.001)、TGF-β1(P=0.002)的蛋白水平明显高于正常组,E-cadherin的表达水平明显低于正常组(P=0.031);与模型组对比,替米沙坦干预组Fib(P=0.046)、ColⅠ(P<0.001)、TGF-β1(P=0.009)的蛋白水平降低,E-cadherin(P=0.015)的表达水平升高 (图2)。
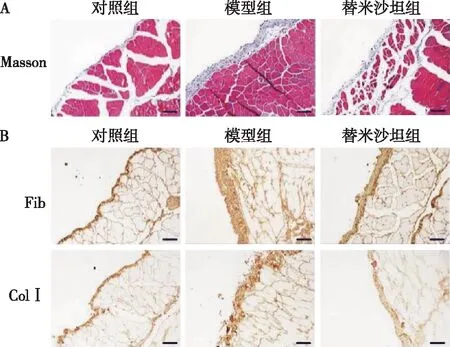
图1 替米沙坦减少小鼠壁层腹膜厚度及细胞外基质的沉积Fib:纤维连接蛋白;ColⅠ:Ⅰ型胶原蛋白;A:各组小鼠壁层腹膜变化(Masson,×200);与对照组对比,模型组小鼠壁层腹膜厚度明显增厚,替米沙坦可减轻小鼠壁层腹膜增厚;标尺:50 μM。B:各组小鼠壁层腹膜免疫组化染色(IH,×200);与对照组对比,模型组Fib、Col Ⅰ表达明显升高,替米沙坦可下调Fib、Col Ⅰ表达;标尺:50 μM
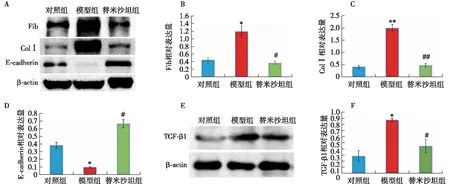
图2 替米沙坦减轻腹膜纤维化Fib:纤维连接蛋白;ColⅠ:Ⅰ型胶原蛋白;E-cadherin:E-钙黏蛋白;TGF-β1:转化生长因子β1;A: Western Blot结果显示各组Fib, ColⅠ和E-cadherin的表达水平;B~D:对应的灰度统计图;E: Western Blot结果显示各组TGF-β1的表达水平;F:对应的灰度统计图;与对照组对比,*P<0.05,**P<0.01;与模型组对比,#P<0.05,##P<0.01
腹膜Mtdh的变化Western Blot结果显示,模型组Mtdh的表达水平明显高于对照组(P=0.015);替米沙坦干预组可下调Mtdh的表达水平(P=0.037)(图3)。
自噬水平的变化LC3A/B-Ⅱ的表达升高是自噬水平上调的一个关键现象[16]。Western Blot结果显示,模型组LC3A/B-Ⅱ的表达水平低于对照组(P=0.007),提示腹膜纤维化中自噬受到抑制;替米沙坦干预组可上调LC3A/B-Ⅱ的表达(P=0.001)(图3)。

图3 替米沙坦抑制Mtdh表达和促进自噬水平A:Western Blot结果显示各组Mtdh的表达水平;B:对应的灰度统计图;C:Western Blot结果显示各组LC3A/B-Ⅱ的表达水平;D:对应的灰度统计图;与对照组对比,*P<0.05, **P<0.01;与模型组对比, #P<0.05,##P<0.01
Mtdh抑制自噬和促进细胞外基质沉积Western Blot结果显示,使用siRNA下调Mtdh后,Mtdh表达水平明显降低(P=0.001),与此同时,Col Ⅰ的表达水平降低(P<0.001),LC3A/B-Ⅱ表达水平升高(P<0.001)(图4)。
讨 论
本实验发现,在4.25%葡萄糖腹膜透析液诱导的小鼠腹膜纤维化模型中,Mtdh的表达水平明显上调;而替米沙坦可下调Mtdh的表达水平,并同时改善腹膜纤维化。Mtdh是位于8q22染色体上的原癌基因,目前认为它能够和PI3K/AKT、Wnt/β-catenin、NF-κB、TLR、MAPK等多个信号通路相互作用介导肿瘤细胞发生EMT,介导肿瘤转移、侵袭过程[17-22]。Mtdh通过促进恶性胶质瘤细胞自噬,增加恶性胶质瘤细胞对TGF-β诱导EMT的敏感性[7],提示Mtdh可能与自噬存在密切的关系。Mtdh高表达于肾脏组织,与肾脏疾病发生发展或存在重要联系[4-6,12]。本实验研究发现Mtdh在腹膜中高表达,与腹膜纤维化的发生发展关系密切,替米沙坦可能通过影响Mtdh的表达缓解小鼠腹膜纤维化的发生。

图4 siMtdh促进自噬和抑制TGF-β1诱导的细胞外基质沉积TGF-β1:转化生长因子β1;ColⅠ:Ⅰ型胶原蛋白;A: Western Blot结果显示各组Mtdh的表达水平;B: 对应的灰度统计图;C: Western Blot结果显示各组LC3A/B、Col Ⅰ的表达水平;D、E:对应的灰度统计图;*:siNC+TGF-β1组与siNC组比较,P<0.05,#:siMtdh+TGF-β组与siNC+TGF-β1组比较,P<0.05
自噬通过对清除胞内错误折叠的蛋白质和受损衰老的细胞器,在细胞的内部稳态起着十分重要的作用[23-26]。根据本课题组已发表的文章的结果[27],在腹膜纤维化小鼠模型中,自噬水平明显下调,使用自噬诱导剂雷帕霉素干预后,小鼠腹膜厚度得到明显减轻,细胞外基质沉积减少,腹膜纤维化明显改善,证明促进自噬对腹膜纤维化起保护作用。类似地,在小鼠单侧输尿管梗阻术模型中,Kim等[28]研究发现,应用自噬抑制剂干预后,自噬活性被抑制,促进肾脏纤维化的进展;Li等[29]发现下调自噬相关基因ATG5加重肾脏纤维化;Ding等[30]发现通过上调自噬可降解在肾小管上皮细胞中调节成熟的TGF-β1蛋白水平,从而抑制肾纤维化。而本实验研究发现,Mtdh可影响自噬的水平,表现为抑制Mtdh表达可上调自噬的水平,提示替米沙坦抑制Mtdh的表达改善腹膜纤维化的机制与Mtdh参与调控自噬水平关系密切。
在腹膜纤维化发生发展中,TGF-β1是重要的细胞因子[2, 31-32]。TGF-β1以自分泌和旁分泌方式使成纤维细胞增长,从多个环节导致细胞外基质过度沉积。TGF-β1在肾脏、腹膜上明显表达。肾素-血管紧张素系统(RAS)阻断剂血管紧张素转换酶抑制剂(ACEI)和ARB不但能阻断RAS通过血流动力学对肾脏的损伤作用,还能阻断 RAS的非血流动力学作用,即减少TGF-β1的生成以防止肾脏纤维化、腹膜纤维化的发生[11,33-34]。本实验研究的替米沙坦,是一类通过竞争性抑制血管紧张素Ⅱ与血管紧张素受体Ⅰ结合,从而阻断RAAS,改善肾损伤的一种重要药物。既往很多动物实验表明,ACEI或ARB类药物在慢性肾衰动物模型中起到肾保护作用,能更有效的抑制肾脏局部RAS的活性,改善蛋白尿和肾功能[33-34]。本实验发现替米沙坦可降低小鼠腹膜厚度,减少细胞外基质的沉积,改善腹膜纤维化;此外,替米沙坦可下调Mtdh的表达和促进自噬水平,且下调Mtdh可促进自噬和减少TGF-β1诱导的细胞外基质沉积,提示替米沙坦可能通过抑制Mtdh表达激活自噬而改善小鼠腹膜纤维化,具体机制有待进一步探究。本实验为ARB类药物防治腹膜纤维化提供新的分子机制。
小结:本实验旨在探究替米沙坦对腹膜纤维化的作用,以及其对Mtdh表达和自噬的影响,为腹膜纤维化的防治提供新的依据。我们发现,替米沙坦不仅可减少细胞外基质沉积,改善腹膜纤维化,还可以抑制Mtdh的表达和上调细胞自噬的水平,且下调Mtdh可上调TGF-β1诱导的细胞自噬水平和减少细胞外基质的沉积。因此,我们推测替米沙坦可能通过抑制Mtdh表达、激活自噬,进而改善腹膜纤维化。

