基于PI-RADS V2.1 评分构建诺莫图预测PSA“灰区”前列腺癌的价值研究
张晶 李陇超 折霞 张沥
前列腺癌是欧美国家男性最常见的恶性肿瘤[1]。在我国发病率位于男性恶性肿瘤第六位,但呈快速增长趋势,尤其是经济发达地区[2,3]。在临床实践中,前列腺特异性抗原(prostate-specific antigen,PSA)是筛查前列腺癌的主要指标,但当PSA 处于4~10 ng/ml 之间,也就是所谓的“灰区”时,直接穿刺阳性率仅约18%~25%,约75%~82%的患者接受了不必要的穿刺,且穿刺为有创检查,可引起如出血、感染、尿潴留等并发症[4,5]。因此,如何无创地检出PSA 处于“灰区”的前列腺癌,避免过度穿刺活检,对前列腺癌的早期诊断具有重要意义。
基于多参数MRI 的前列腺影像报告和数据系统版本2.1(ProstateImagingReportingandDataSystem,Version 2.1,PI-RADS V2.1)对前列腺癌的早期诊断和分期具有较大价值[6],但鲜有研究针对PSA“灰区”前列腺癌诊断准确性的报道[7,8]。此外,目前缺乏适合于我国男性的PSA“灰区”前列腺癌诊断预测模型,因此本研究的目的是基于PI-RADS V2.1 评分联合其他常见的临床指标如总PSA(total PSA,tPSA)、PSA 密度(PSA density,PSAD)、游 离/总PSA(free/total PSA,f/tPSA)、年龄、体积等建立预测PSA“灰区”前列腺癌的诺莫图模型,指导临床进一步选择合适的患者进行穿刺检查。
资料与方法
1.研究对象
回顾性分析陕西省人民医院2016 年10 月~2021 年10 月之间行多参数MRI 检查,临床怀疑为前列腺癌的患者,共计873 例,本次研究的纳入标准:(1)血清PSA 水平4~10 ng/ml;(2)前列腺穿刺活检术前行多参数MRI 检查;(3)临床资料完整。排除标准:(1)3 个月内使用5-α 还原酶抑制剂药物史或内分泌治疗的患者;(2)曾接受过前列腺相关手术治疗的患者。
2.临床指标
本次研究纳入的临床指标主要包括tPSA 值、fPSA 值、f/tPSA 值、年龄、PI-RADS V2.1 评分、直肠指诊(digital rectal examination,DRE)、前列腺体积:最大前后径(cm)×最大左右径(cm)×最大上下径(cm)×0.52(单位为ml)、PSAD=tPSA/体积(单位为ng/ml2)、体质指数(BMI)=体重(kg)/身高2(m),(单位为kg/m2)。
3.扫描方案
所有患者在前列腺穿刺前两周内行多参数MRI 检查,145 例患者采用Philips Ingenia 3.0 T MRI 扫描,59 例采用Philips Ingenia 3.0 T CX MRI设备扫描,扫描序列包括T2加权序列(T2-weighted imaging,T2WI)、扩 散 加 权 成 像(diffusion-weighted imaging,DWI)序列,其中b 值包括0、1000、2000s/mm2,图像后处理软件自动重组表观扩散系数(apparent diffusion coefficient,ADC)图;动态增强扫描(dynamic contrast-enhanced,DCE)序列使用高压注射器经肘静脉注对比剂(钆布醇或钆喷酸葡胺)0.1 mmol/kg体质量,流率2.5 ml/s,采用18 期动态扫描。扫描参数按照PI-RADS 标准设定。
4.图像分析
由两名对PI-RADS 评分系统有丰富经验的影像科医生按照2019 年PI-RADS V2.1 版本5 分制评分标准进行共同阅片,如遇分歧时通过讨论解决,最终达成一致结果。对于移行带病变,以T2WI 为主导序列,DWI 为次要序列;对于外周带病变,以DWI 为主导序列,DCE 为次要序列。当前列腺存在多个病变时,记录最高评分。
5.病理标准
由1 名具有丰富穿刺经验的泌尿外科副主任医师行经直肠超声引导的12 针系统性穿刺(视具体情况,可在异常部位加穿1~2 针)。符合手术指征的患者行前列腺根治性切除术,两名经验丰富的泌尿生殖系统病理医生记录病变的位置和Gleason 评分。
6.统计学方法
采用R 4.1.2 软件进行统计学分析。计量资料采用均数±标准差表示,两组间比较采用t 检验;计数资料采用率或百分比表示,组间比较采用卡方检验。使用二分类Logistic 回归分析确定预测“灰区”前列腺癌的独立指标,应用R 软件建立诺莫图模型,采用Bootstrap 自抽样方法对该模型进行内部验证,通过一致性指数(C 指数)和校准曲线评价该模型的预测准确度和一致率。诺莫图模型的诊断效能通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)评估,并比较诺莫图模型与其他独立预测因素的诊断效能。应用Delong检验评价以上指标AUC 值是否存在差异,以P<0.05 为差异有统计学意义。
结果
1.一般资料
本研究最终纳入204 例患者,其中前列腺癌72 例,良性病变132 例。所有前列腺癌患者中,35例Gleason 评分为3+3 分,37 例Gleason 评分为3+4 分及以上。与良性病变组的患者相比,前列腺癌组的患者具有以下特征:年龄更大(P=0.004),tPSA 值更高(P=0.006),PSAD 值更高(P<0.001),前列腺体积更小(P<0.001),PI-RADS V2.1 得分越高(P<0.001)(表1)。
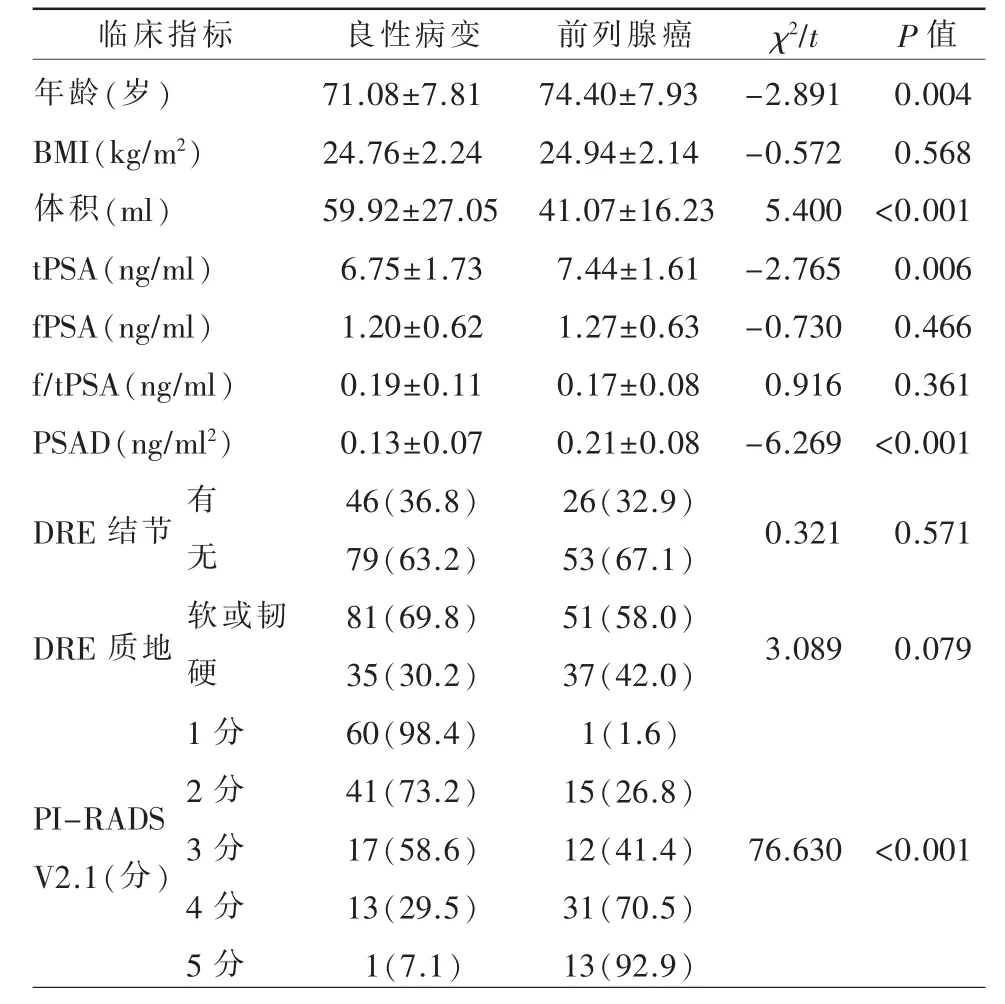
表1 204 例患者临床指标的单因素分析
2.多因素Logistic 回归
应用Logistic 回归法确定独立预测指标(P<0.05),结果显示PSAD、体积、PI-RADS V2.1、年龄和tPSA 是独立预测因素。而fPSA、f/tPSA、DRE 和BMI 参数的差异不具有统计学意义,被除外。表2示PI-RADS V2.1 评分和临床指标多因素Logistic回归分析,PI-RADS V2.1 评分的OR 值最大。

表2 各指标的多因素Logistic 回归分析结果
3.建立诺莫图预测模型与举例说明
根据多因素Logistic 回归分析确定的独立预测指标,应用R 软件建立预测“灰区”前列腺癌风险的诺莫图模型,纳入5 项临床变量(PSAD、体积、PI-RADS V2.1、年龄、tPSA)如图1 所示。

图1 预测PSA“灰区”前列腺癌诺莫图模型
经过Bootstrap 自抽样方法重复抽样100 次后进行模型的内部验证,该诺莫图模型的C 指数为0.896,具有良好的预测准确度。校准曲线显示诺莫图模型对预测“灰区”前列腺癌的发生风险具有良好的一致性和稳定性(图2)。
诺莫图跟据图中线段可得出各预测变量所对应的分值,各项分值相加后记为总分,总分对应的预测风险值,即病理结果为前列腺癌的概率。举例:病例1(图3):88 岁患者,PSA 9.48 ng/ml,前列腺体积44.43 ml,PSAD 0.21,PI-RADS V2.1 评分3 分,则其对应的积分分别为28、8、10、25、60,总分131,对应的病理结果为前列腺癌的概率为75%。病例2(图4):69 岁患者,PSA 4.48 ng/ml,前列腺体积37.342 ml,PSAD 0.12,PI-RADS V2.1 评分3分,则其对应的积分分别为13、1、11、12、60,总分97 分,预测结果为前列腺癌的概率为27%。病例3(图5):65 岁患者,PSA 5.1 ng/ml,前列腺体积41.44 ml,PSAD 0.12,PI-RADS V2.1 评分3 分,则对应的积分分别为11、1、11、12、60,总分95 分,预测结果为前列腺癌的概率为25%。病例4(图6):81 岁患者,PSA 9.32 ng/ml,前列腺体积52.45 ml,PSAD 0.18,PI-RADS V2.1 评分4 分,则其对应的积分分别为23、8、9、22、76,总分138,对应的病理结果为前列腺癌的概率为85%。
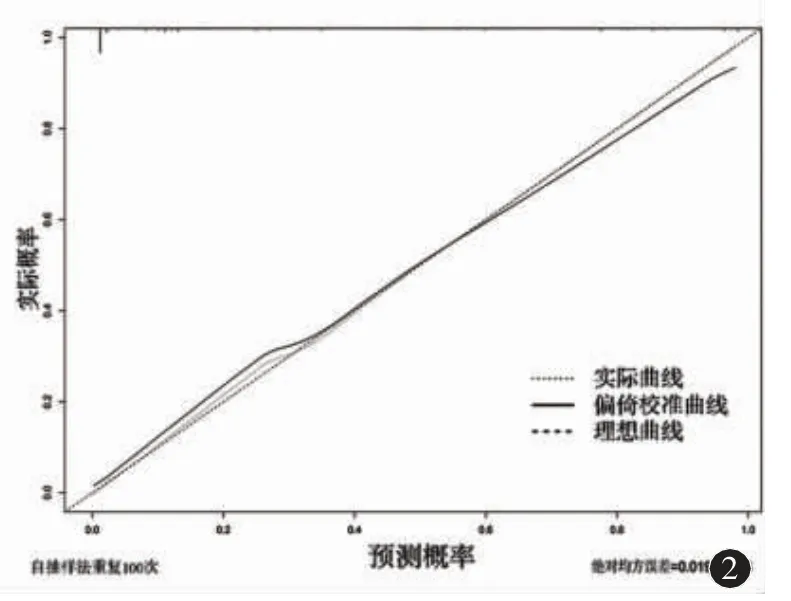
图2 诺莫图模型校准曲线
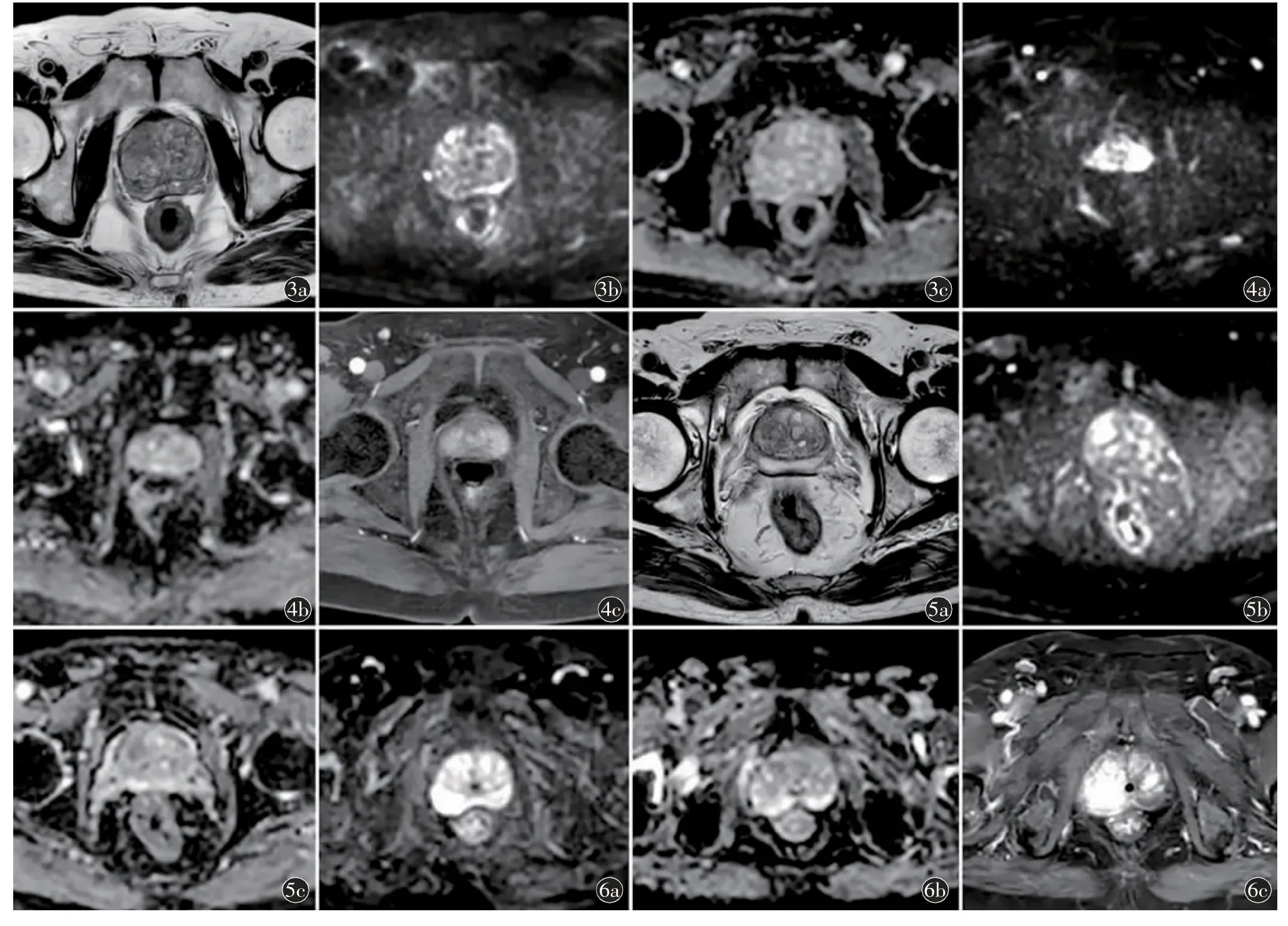
图3 男,88 岁,前列腺癌(Gleason 评分3+3=6 分)。a)T2WI 轴位,右侧体部移行带边界不清低信号灶;b)DWI 轴位,右侧移行带病灶呈等信号,内见点状高信号;c)ADC 图病灶呈稍低信号。PI-RADS V2.1 评分为3 分 图4 男,69 岁,前列腺慢性炎症。a)DWI 轴位,左侧外周带局灶性高信号;b)ADC 图病变呈等信号;c)T1 增强扫描第2 期轴位示病变均匀轻度强化。PI-RADS V2.1 评分为3 分 图5 男,65 岁,前列腺增生。a)T2WI 轴位,右侧移行带斑片状稍低信号;b)DWI 轴位,病变呈局灶性高信号;c)ADC 图,病变呈稍低信号。PI-RADS V2.1评分为3 分 图6 男,81 岁,前列腺癌(Gleason 评分3+4=7 分)。a)DWI 轴位,右侧外周带斑片状高信号;b)ADC 图病变呈稍低信号;c)T1 增强扫描第2 期轴位示病变不均匀轻度强化。PI-RADS V2.1 评分为4 分
4.评估PSA“灰区”前列腺癌的预测效能
对诺莫图模型和各独立临床指标进行ROC曲线分析,研究结果显示诺莫图模型AUC 值最高,其他临床独立指标中,PI-RADS V2.1 评分(AUC 值=0.854)比 年 龄、PSAD、体 积、tPSA,AUC值更高(表3、图7)。

图7 诺莫图模型及各临床指标预测PSA “灰区” 前列腺癌的ROC 曲线
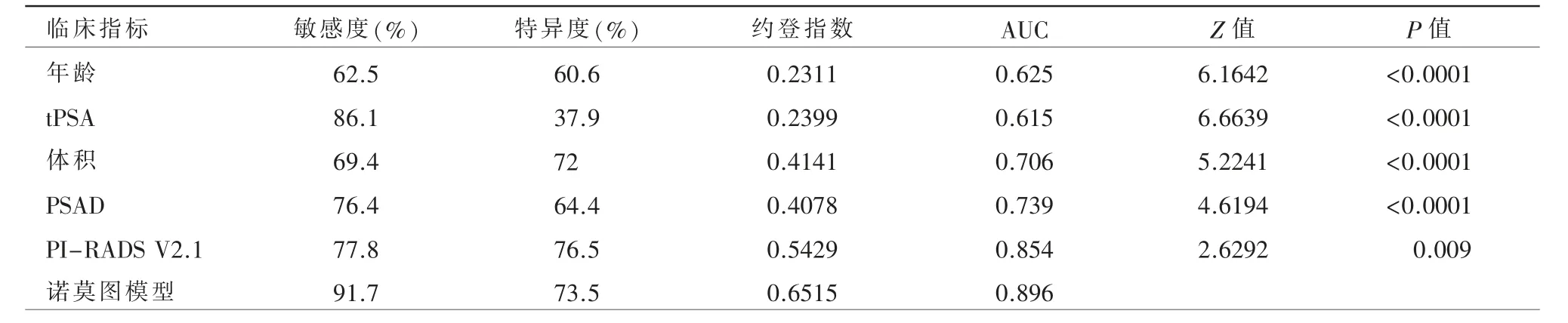
表3 诺莫图模型及各临床指标预测PSA“灰区”前列腺癌的诊断效能
讨 论
1.PSA 和PI-RADS V2.1 诊断“灰区”前 列腺癌的特点和不足
血清PSA 是目前筛查前列腺癌的重要手段,国内外指南均认为PSA 大于4 ng/ml 为指标异常[9,10]。然而,PSA 值受多种因素的影响,包括前列腺按摩、良性前列腺增生、结石、前列腺炎、尿潴留或留置导尿等[11,12]。此外,前列腺体积、BMI 等也是影响PSA 的主要因素,因此单纯靠PSA 一项指标难以满足对前列腺癌的早期筛査及评估,尤其对于PSA 处“灰区”的患者来说误诊率较高[13,14]。
2019 年PI-RADS V2.1 发布,细化了评分指标,旨在提高阅片者一致性和移行带前列腺癌的诊断准确性,但当评分为3 分时仍不确定是否需进行穿刺活检。同时,PI-RADS 评分主观性强,与阅片者的经验有很大关系,因此单纯依靠PI-RADS诊断“灰区”前列腺癌仍有一定局限性[15]。
2.诺莫图诊断“灰区”前列腺癌的优势
近年来,国内外已有多个联合PSA 的诺莫图模型被用于预测前列腺癌[16-20]。与其他预测方法相比,诺莫图的优势是将多个预测指标进行整合,然后采用带有刻度的线段,按照一定的比例绘制在同一平面上,从而用以表达预测模型中各个变量之间的相互关系,简单易懂,能够针对每位患者提供个体化风险预测。孙嘉乐等[16]报道基于PIRADS V2.1 评分系统联合临床指标构建列线图模型,可以为PSA 小于10 ng/ml 且首次接受前列腺穿刺患者了解患病风险,预测前列腺癌的AUC 值为0.876。Tang 等[17]基 于4 个 独 立 临 床 指 标(年龄、PSA、体积、DRE)建立预测前列腺癌风险的诺莫图模型,其诊断AUC 为0.848。Huang 等[18]基于6 个独立临床指标(年龄、PSA、体积、f/tPSA、前列腺超声结果及DRE)建立的预测前列腺癌风险的诺莫图模型,其AUC 为0.853。杨志明等[19]构建的Logistic 多因素回归分析模型预测PSA“灰区”前列腺癌,其AUC 可达0.918。南力宾等[20]报道前列腺癌列线图预测模型对前列腺癌具有较高的预测价值,预测模型AUC 为0.810。
本研究是根据5 个独立预测指标建立相应的诺莫图模型来预测“灰区”前列腺癌的发生风险。经单因素和多因素Logistic 回归分析发现年龄、体积、PSA、PSAD 和PI-RADS V2.1 评分是前列腺癌发生的危险因素,这与上述既往研究结果类似[18,19]。基于上述5 个临床变量构建诺莫图预测模型结果显示,AUC 为0.896,敏感度和特异度分别为91.7%和73.5%,模型诊断效能与其他研究相仿,显著高于单独应用PI-RADS 评分与其他临床变量。该结果提示联合应用PI-RADS V2.1 评分、年龄、体积及血清学检查明显优于单独应用PI-RADS V2.1评分,联合模型将明显提升“灰区”前列腺癌的预测精度与效能。
然而,与上述研究不同之处在于,本研究只针对“灰区”前列腺癌,且模型纳入了最新版的PIRADS V2.1 评分。此外,本研究诺莫图模型纳入的均为常见临床变量,在不增加额外医疗费用的前提下可进一步提高PSA “灰区” 前列腺癌的准确性,减少不必要的穿刺活检。
本研究结果亦发现基于多参数MRI 的最新版本的PI-RADS V2.1 评分系统,其预测前列腺癌的AUC 值高达0.854,诊断效能与先前研究[21]类似,显著高于体积、年龄、PSA、PSAD。但仅使用PIRADS V2.1 评分3 分为诊断阈值时,敏感度为77.8%,可导致约22.2%的“灰区”前列腺癌漏诊。因此,将PI-RADS V2.1 评分作为纳入模型的临床变量之一比单独考虑更合理。
3.本研究的局限性及未来的研究方向
局限性:(1)属于回顾性研究,纳入样本可能存在选择偏倚;并且纳入的样本数量较小,因此可能存在抽样误差。(2)研究为单中心研究,需进一步行多中心联合研究对数据的有效性进行验证。(3)本次研究仅对该模型进行了内部验证,后续研究需要进行外部验证来确认本模型的有效性。
综上所述,基于PI-RADS V2.1 联合临床指标建立的个体化诺莫图预测模型,可用于预测血清PSA 处于“灰区”的前列腺癌,有助于早期识别和筛查前列腺癌患者并提供个体化的风险计算以减少不必要的穿刺活检。诺莫图模型与PSAD、PSA、PI-RADS V2.1 评分、年龄、体积相比,对于预测“灰区”前列腺癌价值更高。

