冠周脂肪影像组学鉴别冠状动脉狭窄程度初探
查昕仪 陶青 胡粟 陈灿 陈蒙 胡春洪
目前心血管病居城乡居民死亡原因的首位[1]。及时、准确地诊断和恰当的治疗对于改善冠状动脉粥样硬化性心脏病(coronary artery disease,CAD)患者的预后非常重要[2]。冠状动脉CT 血管造影(coronary computed tomography angiography,CCTA)已逐步成为无CAD 病史的心绞痛患者的首选检查[3]。既往研究表明,冠状动脉周围脂肪(pericoronary adipose tissue,PCAT)通过与冠状动脉的相互作用,在CAD 的发生和发展过程中起着重要的作用[4]。血管周围脂肪衰减指数(fat attenuation index,FAI)已被证明与冠状动脉事件、斑块类型以及CAD 患者的预后存在相关性[5]。影像组学可以高通量地从放射影像中提取大量的图像特征,从而实现影像数据的定量分析[6]。由于钙化斑块的影响,常常会夸大所在冠状动脉狭窄的程度,故钙化斑块的狭窄程度评估不准确。部分非钙化斑块由于位于冠状动脉分叉处,难以准确评估狭窄程度,非钙化斑块密度和脂肪密度肉眼不易准确区分。冠周脂肪由于受到斑块炎症的影响,炎性斑块向周围释放多种炎症介质,导致周围脂肪密度发生改变,可帮助判断。目前已有基于PCAT 的影像组学对CAD进行评估的文献报道[7-9],但尚未见PCAT 的影像组学与冠脉狭窄程度相关性的探讨。本文探讨基于CCTA 图像上PCAT 的影像组学模型鉴别冠状动脉狭窄程度的价值。
资料与方法
1.一般资料
回顾性分析2018 年1 月~2020 年6 月于苏州大学附属第一医院就诊且行CCTA 检查的患者资料。纳入标准为:(1)冠状动脉内对比剂充盈良好,图像清晰;(2)临床资料齐全;(3)同期进行了数字减影血管造影(digital subtraction angiography,DSA)检查。排除标准如下:(1)病变斑块位于左回旋支;(2)图像上存在明显呼吸运动伪影或心脏搏动伪影;(3)曾行支架植入、心脏起搏器置入或人工金属瓣膜置换等;(4)斑块位于心肌桥位置;(5)大量心包积液;(6)冠状动脉先天畸形。根据冠状动脉有无病变及狭窄程度,分为正常组和病变组,后者又分为轻中度狭窄组(狭窄率<70%)和重度狭窄组(狭窄率≥70%)。最终正常组共纳入101 例202 支冠状动脉,轻中度狭窄组共纳入74例74 支冠状动脉,重度狭窄组共纳入144 例144支冠状动脉。本研究通过苏州大学附属第一医院伦理委员会审批(2021212)。
2.仪器与方法
CCTA扫描方案:采用GE Revolution CT 行CCTA 容积扫描。扫描参数为:管电压100 kV,管电流350~600 mA,重组厚度0.625 mm。扫描范围:气管隆突至心尖下2 cm。以4.5~5 ml/s 流率经肘静脉注入50~60 ml 非离子对比剂碘克沙醇(320 mg I/ml,江苏恒瑞医药),之后追加40~50 ml 生理盐水。
PCAT 勾画分割:以DSA 的结果为参考,在CCTA 的曲面重组(curved planar reformation,CPR)图像上观察病变组的冠状动脉病变情况,确定病变冠状动脉最狭窄处斑块所在的位置及长度,然后使用Perivascular Fat Analysis Tool 软件(北京数坤科技)逐层勾画CCTA 横断位薄层图像上的整个斑块。斑块特异性分析时PCAT 的纵向长度主要由病变范围所决定,需从邻近病变部位的一段(通常是近端5 mm)开始一直延伸到病变部位的下游[10]。本研究所统计的冠状动脉最狭窄处,除一例最狭窄处位于左回旋支,余均位于左前降支及右冠状动脉,且由于走行迂曲并且周围脂肪较少[5,9],本研究中未予评估,故统计所有病变组(左前降支及右冠状动脉)的斑块位置和斑块长度之后取平均值及标准差,作为正常组勾画的位置及长度。勾画完毕后,病变组及正常组均使用Perivascular Fat Analysis Tool 软件的Fat Segmentation 功能,自动选取PCAT(CT 值范围:-190~-30 HU)。
影像组学特征提取:在勾画、分割PCAT 的兴趣区(region of interest,ROI)后,使用Perivascular Fat Analysis Tool 软件保存ROI,随后使用软件中的Calculate Radiomics(影像组学计算)功能导出PCAT的影像组学参数。
影像组学分析:首先使用单因素相关分析进行组学特征筛选,然后用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)选择进一步筛选,将筛选出的最优子集构建最终的影像组学模型。
3.统计学分析
所有统计分析均用R 3.5.1 和Python 3.5.6 进行。仅年龄符合正态分布,以表示,采用单因素方差分析进行三组间比较。计量资料以中位数(范围)表示,采用Kruskal-Waliis H 检验进行比较。计数资料以百分比(%)表示,采用卡方检验进行分析。使用受试者工作特征曲线(receiver operating characteristic curve,ROC)评估模型的诊断效能(双侧检验,检验水准α=0.05)。
结果
1.基线资料比较
正常组、轻中度狭窄组及重度狭窄组患者各临床特征之间,除性别、甘油三酯、身体质量指数外,其余指标三组组间差异均具有统计学意义(表1)。

表1 正常组、轻中度狭窄组及重度狭窄组的临床特征比较
2.影像组学模型建立与评估
正常组勾画的位置参考病变组的平均位置与平均长度(表2)。对冠脉进行勾画、图像分割之后,共提取出1692 个特征。经单因素相关性分析、LASSO等降维处理,正常-病变模型以及轻中度-重度模型分别得到16 个以及9 个最优特征参数,其中两个模型共有的特征参数为LogarithmGLCM_logarithm_ClusterShade。使用Logistic 机器学习方法建立预测模型(图1)。正常与病变组影像组学模型在训练组的AUC 值和准确度分别为0.964 和90.8%,在测试组AUC 值和准确度分别为0.935 和87.3%(图2,表3)。轻中度与重度组影像组学模型在训练组的AUC 值和准确度分别为0.69 和69.1%,而在测试组AUC 值和准确度分别为0.644 和60.6%(图2,表3)。图3、4 为轻中度与重度组影像组学模型中两组中的典型病例展示。
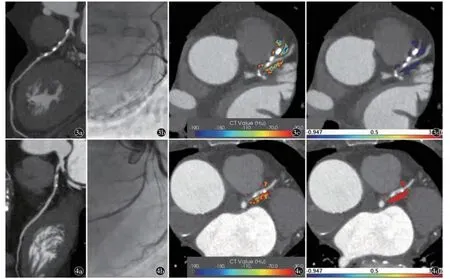
图3 男,67 岁,CAD。a)CPR 重组图,CCTA 上狭窄率为60%;b)DSA 验证狭窄率为60%;c)斑块周围脂肪的CT 值分布图;d)使用建立的影像组学模型参数运算之后得到的Radscore 值,通过整个患者群体的Radscore 范围所得到的冠周脂肪代表颜色 图4 女,85 岁,CAD。a)CPR重组图,CCTA 上狭窄率为80%;b)DSA 验证狭窄率为90%;c)斑块周围脂肪的CT 值分布图;d)使用建立的影像组学模型参数运算之后得到的Radscore 值,通过整个患者群体的Radscore 范围所得到的冠周脂肪代表颜色(见封面彩图)
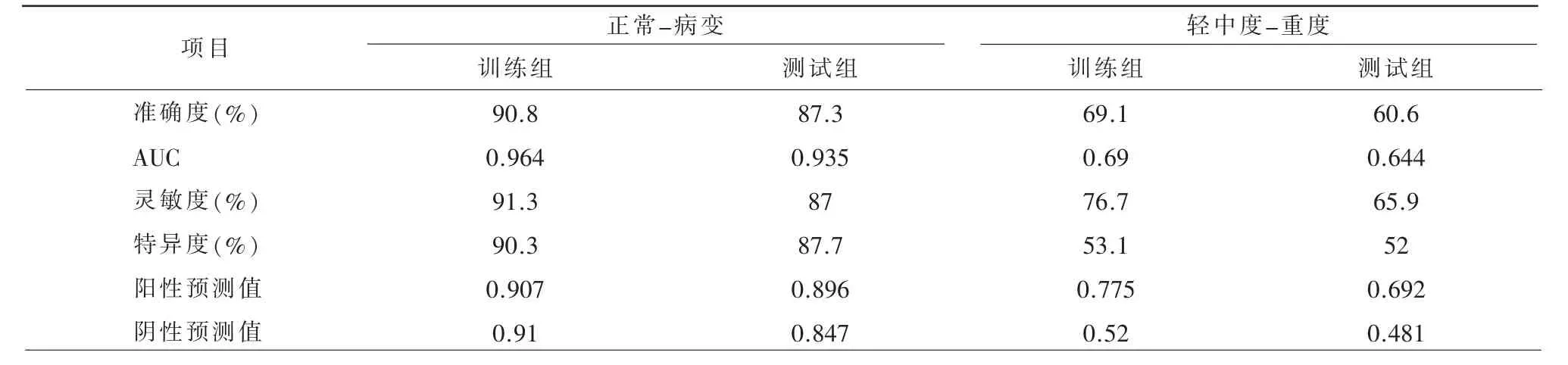
表3 两个影像组学模型测试组的诊断效能
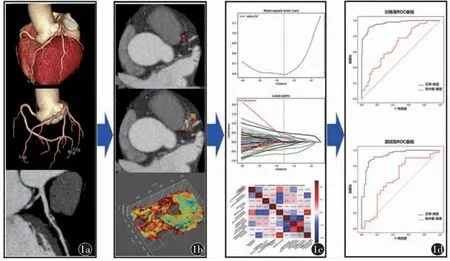
图1 影像组学研究流程图。a)冠脉病变组病例筛选;b)病变勾画及病变周围冠周脂肪ROI 生成;c)影像组学特征筛选及模型建立;d)影像组学模型效能ROC 曲线
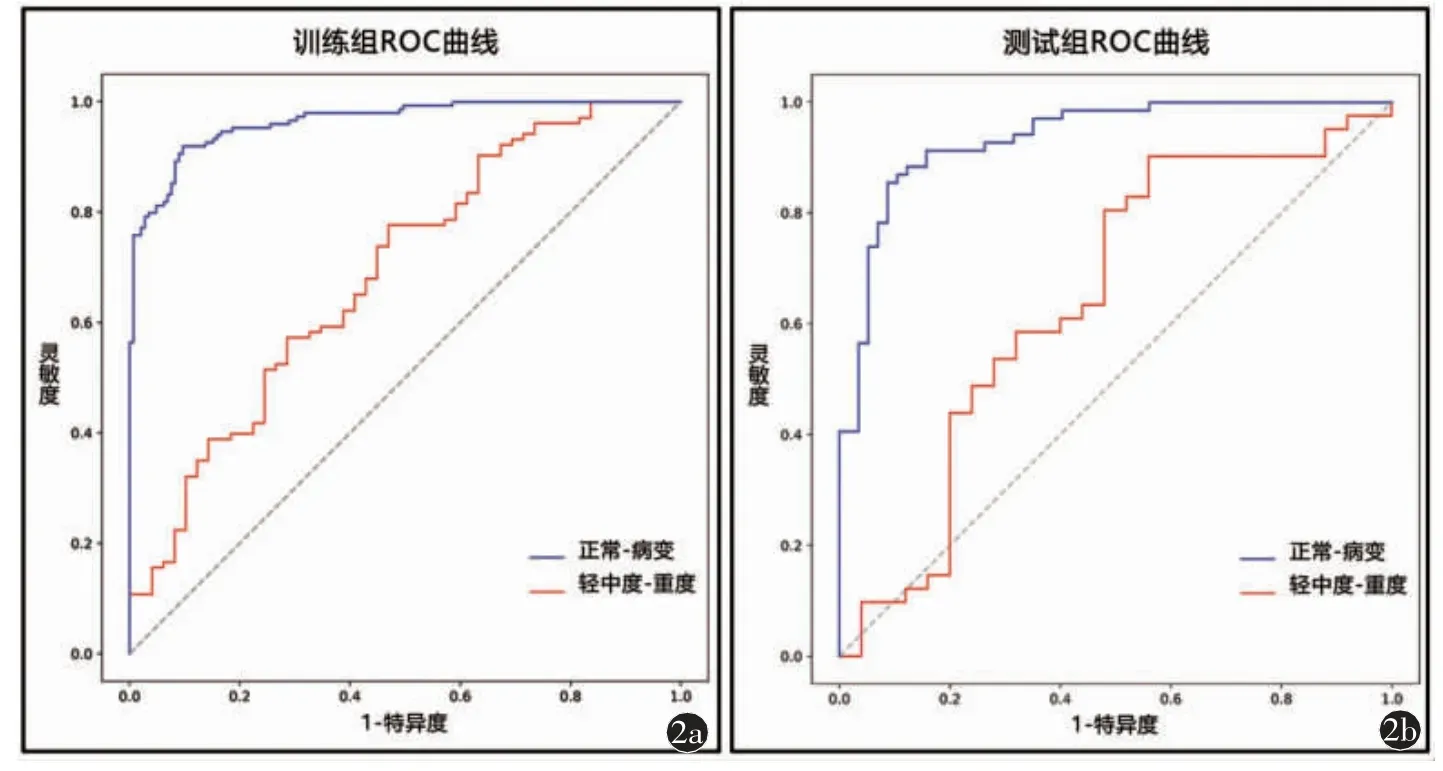
图2 a)训练组的ROC 曲线分析。训练组冠周脂肪正常-病变组的ROC曲线AUC 为0.964;训练组冠周脂肪轻中度-重度组的ROC 曲线AUC 为0.69;b)测试组的ROC 曲线分析。测试组冠周脂肪正常-病变组的ROC曲线AUC 为0.935;测试组冠周脂肪轻中度-重度组的ROC 曲线AUC 为0.644

表2 病变组斑块位置与长度平均参数
讨 论
血管炎症被认为是动脉粥样硬化斑块形成和导致急性冠脉综合征的关键因素之一[11]。C 反应蛋白和促炎细胞因子与冠状动脉炎症、动脉粥样硬化形成有一定相关性,但缺乏特异性[12]。Antonopoulos 等[5]研究认为冠状动脉管壁炎症和PCAT 之间以“双向”的方式相互作用,PCAT 内部特征变化与冠状动脉的炎症息息相关,并通过活检证实了PCAT 炎症与CT 衰减指数之间存在关系。冠状动脉的炎症是心血管疾病早期的发病表现,处于炎症状态的血管释放炎症因子扩散到PCAT 中,通过一系列过程导致局部抑制了脂肪的形成和促进局部脂肪的分解,导致微血管通透性增高,使冠状动脉周围脂肪从“脂相”偏向“水相”[5]。当血管存在炎症时,炎症病变通过旁分泌作用于PCAT,从而影响PCAT 在CCTA 图像上的CT 值[13]。目前,PCAT 已被证明可用于预测冠状动脉的斑块进展,并可区分CAD 的类型[14-17]。影像组学可以从给定的兴趣区内提取大量图像特征,远超出人眼所能表征的参数[18]。本研究拟通过影像组学挖掘冠周脂肪兴趣区内更多肉眼无法识别的参数,基于冠周脂肪的影像组学模型进一步诊断CAD。
在本文所使用的数坤公司所开发的软件是在横断位原始图像的基础上直接进行测量,而非在重组后的CPR 图像测量,直接按照冠状动脉管壁的距离定量地定义为与该血管直径相等的周围脂肪组织标准[5]进行勾画,可准确反映所勾画脂肪的内部参数。该软件已在与PCAT 有关的多个研究中[19,20]使用过,具有可靠的准确性。
由于CCTA 对管腔狭窄的判断偶可出现误差[21],如钙化斑块夸大狭窄程度、分叉处的狭窄程度判断不准确,冠脉造影(invasive coronary angiography,ICA)则可作为“金标准”,来判断狭窄部位及范围。本研究通过对围绕冠状动脉管壁的距离为与该血管直径的周围脂肪组织进行研究[5]。冠脉最狭窄处的PCAT 的纵向长度主要由病变范围所决定[16],从勾画的PCAT 内提取众多影像组学特征,建立影像组学模型,从而区分冠状动脉狭窄程度。
本研究应用影像组学对不同狭窄程度的冠状动脉PCAT 进行分析,发现基于CCTA 图像的影像组学可较好鉴别正常组和冠脉病变组(AUC 达0.90 以上)。然而,本研究中,影像组学模型诊断轻中度狭窄组与重度狭窄组的AUC 值在训练组和测试组均不超过0.70。这一定程度上说明了PCAT所反映的冠脉炎症与冠脉斑块狭窄率之间相关性不强,说明冠脉的炎症与冠脉狭窄率并非成正比,部分重度狭窄的患者可能斑块已经纤维化,局部无炎症。有证据表明,大约一半的急性冠脉综合征事件发生时并无明显的冠状动脉粥样硬化,而是由于轻微但有炎症的动脉粥样硬化斑块破裂所致[22]。
两个模型分别得到的16 个以及9 个最优特征参数子集用来构建影像组学模型。其中,参数LogarithmGLCM_logarithm_ClusterShade 是两个模型所共有的,该参数的机器学习定义为聚类阴影是对灰度共生矩阵(gray-level co-occurrence matrix,GLCM)的偏度和均匀性的一种衡量。较高的集群阴影意味着对平均值的不对称性较大。冠脉炎症会引起PCAT 的体积和脂质含量发生改变,导致局部密度增高,与未受影响的脂肪相比会导致不对称性提高[5]。PCAT是一个CT值范围-190~-30 HU 之间的组织,CT 阅片时此范围内的PCAT肉眼看来均为黑色,基本无法分辨,因此也无法进行组学与人眼对于PCAT 的诊断对比。但是通过组学加工之后,给脂肪赋予颜色,则可以看到比较明显的对比。
影像组学对于ROI 内的CT 值变化非常敏感。本文仅评估了不同狭窄程度间的相关关系,如果ROI 涉及到斑块,非钙化斑块与钙化斑块之间的组学差异性远大于狭窄率间的关系,会导致严重偏倚。而脂肪相对CT 值而言分布较为平均,故本文暂且仅研究冠周脂肪对狭窄程度的影响,斑块的影像组学有待进一步研究。
本研究还存在不足之处:(1)单中心、较小样本的回顾性研究;(2)在病例纳入时,正常组无DSA 检查结果作为金标准。此外,经DSA 证实的轻中度狭窄病例相对较少,因而未将轻中度组分为轻度组、中度组;(3)只评估了左前降支与右冠状动脉,左回旋支由于走行迂曲且周围脂肪较少[23],本研究中未予评估。
综上所述,本研究初步证实了基于CCTA 图像上PCAT 的影像组学模型在鉴别冠状动脉狭窄与正常有较好的诊断效能。

