枯草芽孢杆菌菌株ZT4-2电击转化体系的建立
蔡 露,秦艳秋,高坦坦,王旭东,任争光,赵晓燕
(北京农学院生物与资源环境学院/农业农村部华北都市农业重点实验室,北京102206)
植物病害是影响中国农业生产的重要因素,为保护生态环境,保障粮食和食品安全,生物防治是目前被优先考虑的植物病害防治方法之一。
枯草芽孢杆菌(Bacillussubtilis)被认为是一种理想的生防细菌,广泛分布于自然界中,抗逆性较强,耐热、耐旱、抗紫外线,对人畜无毒无害,且具有广谱抗菌活性[1-2],能够抑制植物根部、枝干、花叶及果实的病原菌,可用于防治水稻纹枯病、小麦纹枯病、棉花枯萎病、棉花立枯病、番茄叶霉病、豆类根腐病等多种病害[3-4]。同时,枯草芽孢杆菌(Bacillussubtilis)也是继大肠杆菌之后又一个在分子生物学、遗传学研究中广泛使用的菌株,枯草芽孢杆菌菌株的遗传改造可以有助于更好的研究其生防机理,或者建造工程菌株,进一步提高其防治效果、扩大其应用范围,从而更好的发挥其生防作用。通过转入绿色荧光蛋白(green fluorescent protein,GFP)等标记基因对枯草芽孢杆菌进行荧光标记以确定其定殖位点也是热点研究的内容[5]。
将目的基因引入细胞是遗传改造的方法之一,其途径主要有电击转化、原生质体转化和化学转化[6]。对于枯草芽孢杆菌而言,电击转化是三种转化途径中操作较为简单、变量易控制且转化效率较高的一种[7-8],而化学转化与原生质体转化耗时长、影响因素较多且转化效率较低[9]。电击转化即电穿孔,被广泛应用于细菌、酵母、动植物细胞的基因转导技术中,通过高强度的电场作用,在细胞膜上形成暂时性的可复性穿孔,将外源目的DNA导入细胞,插入细胞基因组内,使DNA在细胞内表达[10]。不同细菌、甚至不同菌株的电击转化条件有较大差别[11],一些菌株甚至无法进行转化[12]。就枯草芽孢杆菌而言,枯草芽孢杆菌菌株NCD-2在37 ℃、150 r/min培养 3.5 h、电阻200 Ω和电场强度14.0 kV的条件下能达到较高的电击转化效率[9];而枯草芽孢杆菌菌株WB600在OD600 nm=0.7、质粒体积80 ng、电阻200 Ω和转化电压21 kV时转化效率较高[7]。
枯草芽孢杆菌菌株ZT4-2是北京农学院植物保护专业实验室保存的一株具有自主知识产权的生防菌株[13],该试验从菌株不同培养阶段、不同感受态细胞浓度、不同感受态细胞量、不同质粒体积、不同转化电压等电击转化条件对电击转化效率的影响进行探索,为建立该菌株的高效遗传转化体系及后续分子遗传学研究及工程菌株改造奠定基础。
1 材料与方法
1.1 材 料
1.1.1 供试菌株及质粒 枯草芽孢杆菌菌株ZT4-2由北京农学院植物保护专业实验室保存;带有GFP标记的穿梭质粒pGFP78(四环素抗性)由中国农业大学植物病理系王琦教授惠赠。
1.1.2 供试试剂及培养基 抗生素(10 μg/mL):四环素(10 μg/mL)。LB液体培养基:每升培养基加入酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g。LB固体培养基:每升培养基加入酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g、琼脂15 g。抗性培养基:使用时,在LB液体或固体培养基的基础上加入对应浓度抗生素。
1.2 试验方法
1.2.1 质粒pGFP78的提取及质粒浓度测定 质粒pGFP78的提取使用北京博迈德基因技术有限公司的高纯度质粒小量快速提取试剂盒,具体操作参考试剂盒所附说明书。质粒浓度测定使用Thermo Fisher Scientific的超微量核酸蛋白测定仪。
1.2.2 枯草芽孢杆菌菌株ZT4-2感受态细胞的制备 依据参考文献[14-17]进行前期试验,最后确定制备感受态细胞的流程如下:将保存的枯草芽孢杆菌菌株ZT4-2在LB固体培养基上活化,挑取单菌落于5 mL LB液体培养基中过夜培养(≤16 h);在装有100 mL的LB液体培养基的锥形瓶中加入1 mL过夜培养的菌液,在摇床中37 ℃、220 r/min震荡培养至指定OD600 nm值;冰浴菌液30 min使其停止生长,4 ℃、8 000 r/min离心10 min,弃上清收集菌体;用预冷的超纯水洗涤菌体5次,加入40% PEG6000悬浮沉淀,分装备用。
1.2.3 枯草芽孢杆菌菌株ZT4-2的电击转化及转化子的验证 在分装的感受态细胞中加入质粒,混匀后转移至预冷好的电击杯中,擦干电击杯表面的水,立即电击;电击完毕立刻加入800 μL的LB液体培养基,混匀后将其转移至空试管中,37 ℃、150 r/min震荡培养3 h;将孵化好的菌液转移至1.5 mL离心管中,12 000 r/min离心3 min,弃上清,加入100 μL超纯水重悬菌体,将重悬后的菌液涂布于相应抗性平板上,37 ℃过夜培养;记录菌落数,计算电击转化效率:电击转化效率(CFU/μg)=菌落数/质粒质量。随机挑取单菌落,制成玻片,置于荧光显微镜下观察,由于质粒pGFP78均带有荧光蛋白标记,因此若菌体在荧光显微镜下能观察到荧光,则说明电击转化成功。
1.2.4 不同转化电压对电击转化效率的影响 电击转化时分别用1.8、2.2和2.5 kV的转化电压进行电击,测定转化电压大小对电击转化效率的影响。质粒选择pGFP78,感受态细胞量200 μL,质粒体积10 μL,电击杯宽度0.2 cm,电击转化方法及转化效率计算同“1.2.3”。
1.2.5 对数生长期不同阶段对电击转化效率的影响 按照“1.2.2”的方法,将枯草芽孢杆菌菌株ZT4-2培养至OD600 nm值分别为0.3、0.4、0.5、0.6、0.8和1.0,参照“1.2.2”制备感受态细胞,测定菌株对数生长期不同阶段对枯草芽孢杆菌菌株ZT4-2电击转化效率的影响。质粒选择pGFP78,质粒体积10 μL,感受态细胞量200 μL,电场强度2.5 kV,电击杯宽度0.2 cm,电击转化方法及转化效率计算同“1.2.3”。
1.2.6 不同感受态细胞浓度对电击转化效率的影响 制作枯草芽孢杆菌菌株ZT4-2感受态细胞步骤中最后悬浮沉淀时按起始菌液每100 mL分别加入600 μL或1 200 μL的40% PEG6000,测定不同感受态细胞浓度对电击转化效率的影响。质粒选择pGFP78,质粒体积10 μL,感受态细胞量200 μL,电场强度2.5 kV,电击杯宽度0.2 cm,电击转化方法及转化效率计算同“1.2.3”。
1.2.7 不同感受态细胞量对电击转化效率的影响 电击转化时分别加入200 μL及100 μL的感受态细胞,以测定不同感受态细胞量对电击转化效率的影响。质粒选择pGFP78,质粒体积10 μL,电场强度2.5 kV,电击杯宽度0.2 cm,电击转化方法及转化效率计算同“1.2.3”。
1.2.8 不同质粒体积对电击转化效率的影响 电击转化时分别加入10 μL及5 μL的质粒,测定不同质粒体积对电击转化效率的影响。质粒选择pGFP78,感受态细胞量200 μL,电场强度2.5 kV,电击杯宽度0.2 cm,电击转化方法及转化效率计算同“1.2.3”。
1.3 显著性差异分析
利用SPSS软件进行差异性分析。自变量为2个时进行独立样本T检验,自变量≥3时进行单因素ANOVA检验。
2 结果与分析
2.1 不同转化电压对电击转化效率的影响
采用电击转化方法测试不同转化电压对枯草芽孢杆菌菌株ZT4-2电击转化效率的影响,结果如图1。当转化电压2.5 kV时,平均电击转化效率最高,为411.80 CFU/μg;转化电压2.2 kV时,平均电击转化效率最低,仅有91.20 CFU/μg;转化电压1.8 kV时,平均电击转化效率位于二者之间,为101.20 CFU/μg。利用SPSS进行差异性分析,可知2.5 kV时的转化效率与1.8 kV及2.2 kV时的电击转化效率有显著性差异(P<0.05)。在后续试验中都采用转化电压2.5 kV进行转化。
2.2 枯草芽孢杆菌菌株ZT4-2对数生长期不同阶段对电击转化效率的影响
采用电击转化方法测试枯草芽孢杆菌菌株ZT4-2培养时对数生长期不同阶段对菌株电击转化效率的影响(图2)。随着培养液OD600 nm值的升高,电击转化效率逐渐升高。当OD600 nm=1.0时电击转化效率最高可达到6 823.67 CFU/μg;其次是OD600 nm=0.8时,平均电击转化效率达到4 884.67 CFU/μg;OD600 nm=0.6时,转化效率大幅下降,平均电击转化效率仅411.77 CFU/μg;当OD600 nm<0.6时,转化效率明显过低。利用SPSS进行差异性分析,可知OD600 nm=1.0与其他OD600 nm值时的电击转化效率均存在着显著性差异(P<0.05),因此在后续试验中采用培养到OD600 nm=1.0的细菌进行转化。

图1 转化电压对电击转化效率的影响Fig.1 The effect of electric shock voltage on transformation efficiency

图2 对数生长期不同阶段对电击转化效率的影响Fig.2 The effect of logarithmic growth periods on transformation efficiency
2.3 不同感受态细胞浓度对电击转化效率的影响
在制作感受态细胞的最后阶段加入的40%PEG6000的量会影响感受态细胞的浓度,测试两种不同感受态细胞浓度(每100 mL起始菌液加入600 μL的40% PEG6000或1 200 μL 的40% PEG6000)对枯草芽孢杆菌菌株ZT4-2电击转化效率的影响见图3。40% PEG6000加入量600 μL时,平均电击转化效率达到656.00 CFU/μg;40% PEG6000加入量1 200 μL时,平均电击转化效率为186.10 CFU/μg。40% PEG6000加入量600 μL时的电击转化效率显著高于40% PEG6000加入量1 200 μL时的转化效率(P<0.05),因此在制作感受态细胞的最后阶段加入600 μL 40% PEG6000得到的感受态浓度更利于电击转化效率的提高。

图3 感受态细胞浓度对电击转化效率的影响Fig.3 The effect of competent cell concentration on transformation efficiency
2.4 不同感受态细胞量对电击转化效率的影响
采用电击转化方法测试不同感受态细胞量对枯草芽孢杆菌菌株ZT4-2电击转化效率的影响,结果如图4。在一个转化体系中,感受态细胞量200 μL时,平均电击转化效率186.10 CFU/μg;感受态细胞100 μL时,平均电击转化效率42.60 CFU/μg。利用SPSS进行差异性分析,可知感受态细胞量200 μL与感受态细胞量100 μL时的转化效率存在显著性差异(P<0.05)。感受态细胞量200 μL时的平均电击转化效率是感受态细胞量100 μL时的3倍多,因此电击转化时感受态细胞量200 μL会获得更好的电击转化效率。

图4 感受态细胞量对电击转化效率的影响Fig.4 The effect of competent cell amount on transformation efficiency
2.5 不同质粒体积对电击转化效率的影响
采用电击转化方法测试电击转化体系中加入不同质粒体积对枯草芽孢杆菌菌株ZT4-2电击转化效率的影响,结果如图5。当感受态细胞浓度较高(40% PEG6000加入600 μL)时:质粒体积10 μL时,平均电击转化效率785.90 CFU/μg;质粒体积5 μL时,平均电击转化效率656.00 CFU/μg,二者之间不存在显著性差异。当感受态细胞浓度较低(40% PEG6000加入1 200 μL)时:质粒体积10 μL时,平均电击转化效率242.30 CFU/μg;质粒体积5 μL时,平均电击转化效率142.60 CFU/μg,二者之间存在显著性差异(P<0.05)。此现象可能表明,在感受态细胞浓度较低的情况下电击转化效率与加入的质粒体积成正比,但在感受态细胞浓度较大的情况下加入不同的质粒体积对电击转化效率的影响较小。
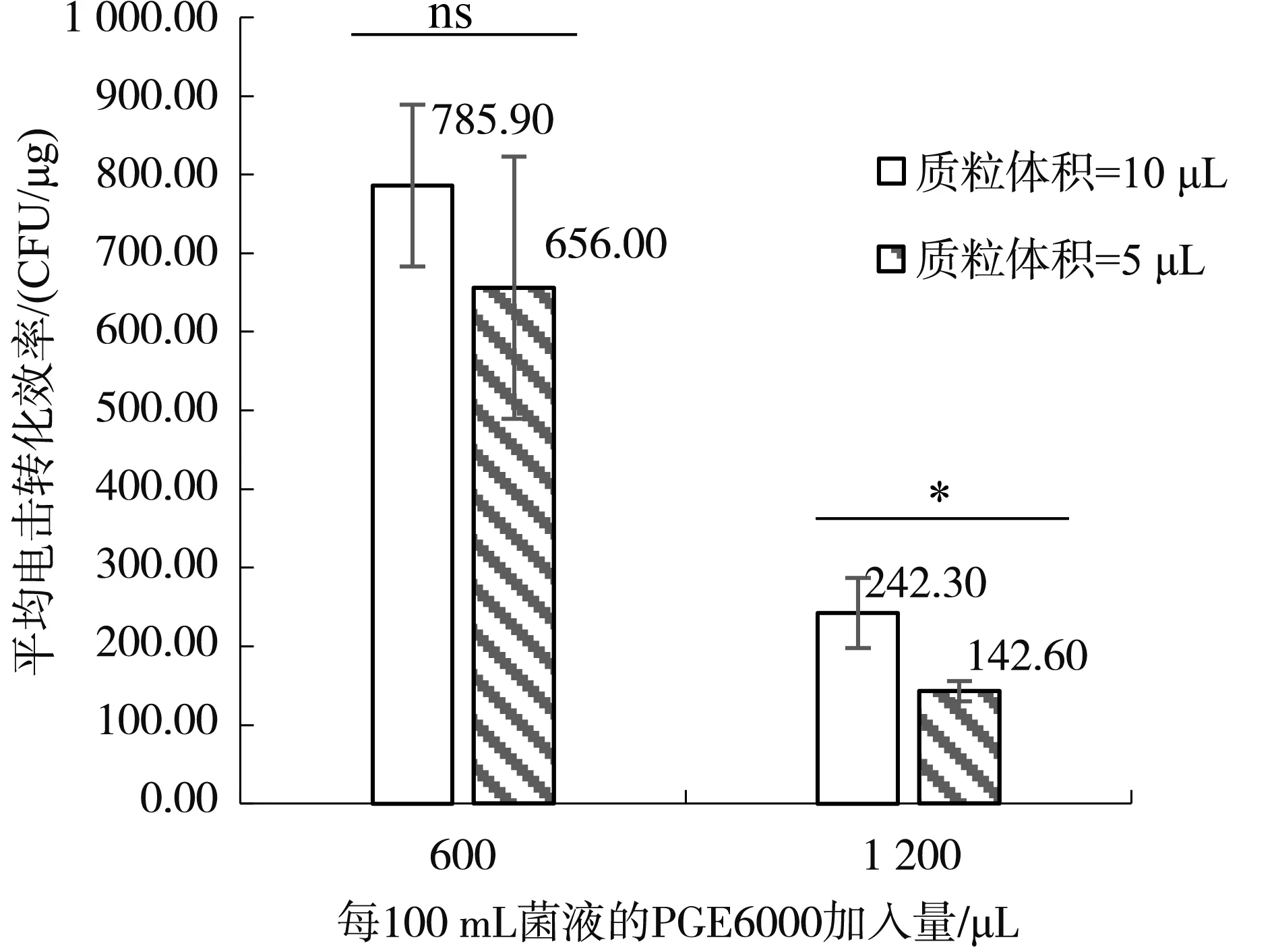
图5 质粒体积对电击转化效率的影响Fig.5 The effect of plasmid volume on transformation efficiency
2.6 枯草芽孢杆菌菌株ZT4-2转化子的验证
挑取“2.2”的抗生素抗性转化子进行荧光标记的检查,阳性转化子的菌体在荧光显微镜下能产生荧光,说明电击转化成功(图6)。

注;A是明场;B是暗场。Note: A is bright field; B is dark field.图6 枯草芽孢杆菌菌株ZT4-2转化子的验证Fig.6 Verification of transformants of Bacillus subtilis ZT4-2 strain
3 讨 论
通过该试验建立了枯草芽孢杆菌菌株ZT4-2的电击转化体系。相关重要环节的条件:制备感受态细胞时,菌液培养至OD600 nm值为1.0;最后重悬菌体时加入40% PEG6000的体积600 μL/100 mL 起始菌液;电击转化体系中,感受态细胞量200 μL,质粒体积10 μL,转化电压2.5 kV。在该体系中,电击转化效率最高可达6 823.67 CFU/μg。
电击转化是一种简单高效的基因转导方法,但对于不同的菌株电击转化的条件及效率差别较大,枯草芽孢杆菌是一种革兰氏阳性菌,由于革兰氏阳性菌细胞壁较厚且致密,其电击转化效率比革兰氏阴性菌低[18],因此探索不同电击转化条件对电击转化效率的影响,建立枯草芽孢杆菌的高效电击转化体系,就能更好利用目的基因对枯草芽孢杆菌进行遗传改造,从而进行更进一步的研究。利用PEG6000的电转化方法鲜有报道,在经过不断试验和方法改善后,选择该方法进行枯草芽孢杆菌菌株ZT4-2的电击转化体系的建立,转化效率较为稳定,为今后对枯草芽孢杆菌菌株ZT4-2进行基因工程研究提供支持。
一般来说,菌株对电击转化时的电场强度非常敏感,提高转化电压可以增加目的基因进入细胞的几率,同时也会增加细胞的死亡概率,为了获得更高的电击转化效率,必须同时兼顾细胞的死亡率和转化率来选择合适的转化电压。不同菌株对电场强度的敏感性不同,如贝莱斯芽孢杆菌菌株3A3-15在电击转化电压1.75 kV时效率最高[18],枯草芽孢杆菌菌株WB600在电击转化电压21 kv时的转化效率最高[7],枯草芽孢杆菌菌株NCD-2的最优电击转化电压14.0 kV[9]。该试验证明,转化电压2.5 kV时枯草芽孢杆菌菌株ZT4-2的电击转化效率最高。
通常认为对数生长初期进行电击转化的转化效率高于对数生长中后期的效率[19],并且不同菌株想要达到较高电击转化效率所需的阶段不一定相同,如枯草芽孢杆菌菌株WB600在菌液培养至OD600 nm=0.7时转化效率最高[7],而枯草芽孢杆菌菌株NCD-2在菌液培养至OD600 nm=1.2时转化效率最高[9]。该试验探究枯草芽孢杆菌菌株ZT4-2处于对数生长初期最适合进行电击转化的OD600 nm值, OD600 nm值在0.3~1.0时随着OD600 nm值的升高,电击转化效率逐渐升高,当OD600 nm=1.0时,电击转化效率最高。
PEG是用于细胞融合的最常用的化学融合剂,最后一次重悬细胞沉淀选择加入40% PEG6000是为了促进细胞膜的变化[20],从而获得更好的电击转化效率。PEG6000的促进作用取决于其浓度、加入量及作用时间,但增加其加入量也相当于对感受态细胞浓度进行稀释。每100 mL起始菌液加入600 μL 40% PEG6000时的电击转化效率显著高于加入1 200 μL 40%PEG6000时的电击转化效率,并且不受转化时质粒体积的影响,而在低浓度下,质粒体积加入较多时电击转化效率会高于质粒体积较少时的转化效率。

