碳酸氢钠和碳酸钠热稳定性对比实验装置的改进
谭会敏 旦增 李伟 倪海凤 孟德安
摘要:实验是中学化学教学中的重要内容,为使碳酸氢钠与碳酸钠热稳定性对比实验更好地适应课堂教学,让学生更直观地理解碳酸氢钠热分解的产物,更高效地完成碳酸钠和碳酸氢钠热稳定性对比,本文设计了碳酸氢钠和碳酸钠热稳定性对比实验的两组改进装置。通过实验验证,发现直形管类装置实验现象明显、对比效果显著、产物明确、用时短、可操作性强;用U型管类装置在实验时,只要U型管大小规格合适亦能在实验现象、热稳定性对比等方面取得良好的效果。
关键词:碳酸氢钠;碳酸钠;热稳定性比较;实验改进
文章编号:1008-0546(2022)03x-0070-04 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.03x.017
一、研究背景
1.课标要求
碳酸氢钠的热稳定性实验是高中化学实验之一,在普通高中化学课程标准课程内容中要求了解钠及其重要化合物的性质;学习活动建议中要求进行碳酸钠及碳酸氢钠性质的比较的实验;学业质量要求能用化学方程式、离子方程式表示典型物质的主要化学性质[1]。
2.教材实验
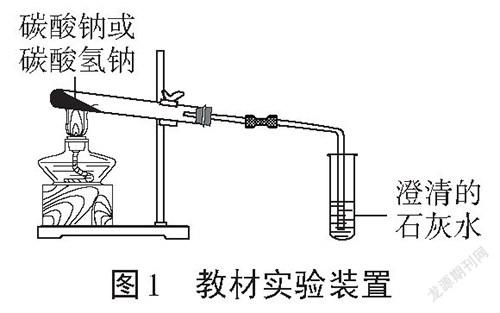
在人民教育出版社(2019版)高中化学教材中,碳酸氢钠的热稳定性实验位于必修1第一册第二章第一节。教材实验如下所示:
实验要求[2]:分别加热碳酸钠和碳酸氢钠,观察现象,比较碳酸钠和碳酸氢钠的热稳定性。
实验装置如图1所示:
该实验装置有以下几点不足:
(1)在进行对比实验时,需要进行两次实验,两次实验将会耗费大量的时间,且不能同时對比碳酸钠和碳酸氢钠的热稳定性。
(2)只能观察到碳酸氢钠发生了分解,有二氧化碳产生,但是不能观察到产物水及碳酸钠,也不能证明碳酸钠在一定的温度下未发生热分解。
3.已有的实验改进装置
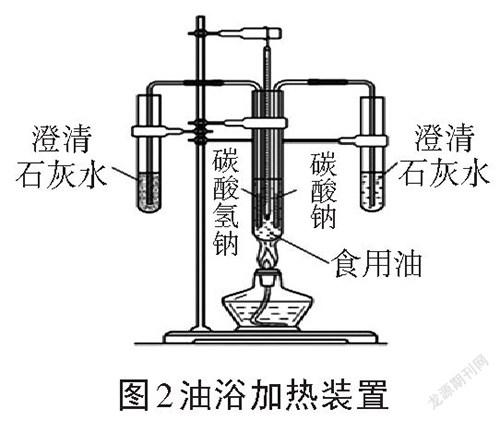
伍强[3]为了使碳酸钠、碳酸氢钠固体的热稳定实验具有更好的对比性、探究性、直观性,设计了油浴加热碳酸钠和碳酸氢钠的对比试验,装置如图2所示。该装置解决了不能同时加热两种物质的现状,能在一个实验中完成对比,并可以测定碳酸氢钠分解的温度。但是增加了实验的危险性,耗时较长,实验装置也很复杂。且实验只能检测出是否有二氧化碳产生,不能检验其他产物。不利于课堂实验演示或者进行学生操作实验。
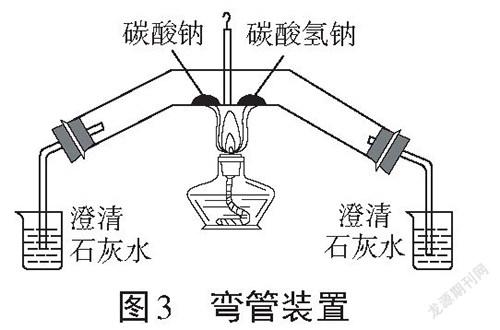
周汉芳[4]曾对实验装置进行了改进,装置图如图3所示,实验装置很好地解决了耗时的问题,可以一次性加热两种物质,亦可进行现象对比,但实验装置需要定制,且实验装置没有对产物(水、碳酸钠)进行验证。
徐建菊[5]等人在对碳酸氢钠及碳酸钠的对比实验中,通过二氧化碳传感器测试生成的二氧化碳的量得到结论:在用酒精灯加热时,碳酸氢钠不稳定易分解,由于碳酸钠分解的温度至少需要1300℃,所以碳酸钠稳定不易分解。
黄金泉[6]等人用尼龙绳将两只硬质试管绑在一起,分别加入碳酸钠和碳酸氢钠进行加热分解,实验装置如图4所示,实验装置适用性强,也能很好地完成对比实验,但是不能保证两种物质均良好受热。
高中阶段的学生具有高度的好奇心,可视化地验证产物并对比两者热稳定性的差别,不但能提高学生探究问题的兴趣和科学态度的严谨性,而且能明确碳酸氢钠热分解的产物,使学生正确的用化学方程式表示。为了使学生明显观察到碳酸氢钠分解的产物,高效安全地完成碳酸钠和碳酸氢钠热稳定性对比实验,使装置安全性更强,本文对碳酸氢钠热稳定性实验设计了两组改进装置。
二、实验装置
1.实验仪器及实验用品
实验仪器:中间隔开的U型管(8mm*80mm和13mm*130mm)、中间隔开的玻璃管(13mm*8cm)、直形玻璃管(13mm*20cm)、橡胶塞、橡胶管、玻璃管、烧杯、酒精灯。
实验药品:碳酸氢钠、无水碳酸钠、无水硫酸铜、澄清石灰水、氯化钙溶液。
对碳酸钠的处理:在实验过程中,我们发现碳酸钠加热时会产生水,从元素守恒的角度来看碳酸钠中不含有氢元素,加热不会产生水,那水又是从哪里来的呢?碳酸钠易与空气中的水蒸气结合形成Na2CO3·xH2O,碳酸钠的结晶水和物热分解产生水和碳酸钠。若温度达到1227℃或者1203℃时会变成氧化钠和二氧化碳,这是酒精灯加热不能达到的温度[7]。故水为Na2CO3·xH2O热分解产物。对基础一般的学生,为使实验现象明显,学生不产生认知混乱,在做实验时应尽量使用无水碳酸钠,若没有无水碳酸钠可以在实验之前先将碳酸钠在酒精灯上加热除去碳酸钠的结晶水。对于基础较好,好奇心强的学生,可以在实验之后让学生分析探索水的来源。
2.实验原理
(1)碳酸氢钠加热分解:
(2)将二氧化碳通入澄清石灰水中产生白色沉淀,实现对二氧化碳的检验:
CO2+Ca(OH)2=CaCO3↓+H2O
(3)向碳酸钠中加入氯化钙溶液产生白色沉淀,此现象可用于检验碳酸钠:
Na2CO3+CaCl2=CaCO3↓+2NaCl
(4)水能使无水硫酸铜变蓝,此反应用于水的检验:
CuSO4+5H2O=CuSO4·5H2O
3.实验装置
(1)U型管类装置
U型管类两个实验装置图如图5所示,具体实验操作及实验现象如下:
①向U型管的两侧分别加入一定量的碳酸钠和碳酸氢钠粉末,连接固定好装置。
②用酒精灯加热U型管下侧。
③移出导管,停止加热。待U型管冷却后,向U型管中加蒸馏水溶解碳酸纳和碳酸氢钠热分解产物,形成饱和溶液。取出饱和溶液再加入氯化钙溶液。
U型管类装置实验现象如表1所示:
U型管类装置进行实验时,只要调节好U型管的規格大小,便可以观察到明显的实验现象。通过实验现象可以清楚地检验产物并比较两者的热稳定性。装置a若使用型号较小的隔开的U型管时,可以观察到明显的实验现象,但换用规格较大的U型管进行实验时,不能观察到无水硫酸铜变蓝,且U型管有冷凝水回流,易引起试管炸裂。装置b将裹有无水硫酸铜的棉花放在U型管的上侧,去掉装有无水硫酸铜的玻璃管。不仅可以很好地解决冷凝水回流的问题而且还能观察到裹有无水硫酸铜的棉花变蓝的实验现象。但若采用装置b进行实验时,U型管不宜过小,否则高温会导致棉花燃烧。
(2)直形管类装置
直形管类装置如图6所示,实验步骤如下:
①向20cm长的玻璃管的中间位置塞入橡胶塞(如装置6b所示)。
②向导管两侧的中间位置分别加入一定量的碳酸钠和碳酸氢钠粉末,连接固定好装置。
③加热直形管两侧的碳酸钠和碳酸氢钠(酒精灯位置如装置图6所示)。
④移出导管,停止加热。分别取出两侧的产物,加入蒸馏水溶解,往饱和溶液中加入氯化钙溶液。
实验现象见表2。
结果表明,直形管类装置实验现象明显,用时较短,学生可以通过实验明了碳酸钠和碳酸氢钠的热稳定性。装置6a实验现象明显,但装置需要定制或者用酒精喷灯烧制,这增大了实验的复杂程度。装置6b选择了橡胶塞代替中间的玻璃隔板,在实验过程中橡胶塞不但有效起到了隔离的作用,也未燃烧。使得装置不仅更加简单而且装置可操作性也很好。
两组装置均实验现象明显,能很好地对两物质的热稳定性进行对比,并明确碳酸氢钠的产物,但是U型管类装置为获得明显的实验现象,必须对U型管的规格大小进行调节,且装置需要定制。直形管类装置6b则可以直接进行组装,装置更加简单。
三、实验改进的优点
(1)装置实验现象明显,能高效的对比碳酸钠和碳酸氢钠的热稳定性。实验对所有的产物都进行了验证能使学生更加直观地理解碳酸氢钠的热分解产物,促使学生更好的掌握碳酸氢钠热分解的化学反应方程式,增强学生对科学研究的严谨性。
(2)物质受热更加均匀,一次实验完成对两物质的热稳定性探究,耗时更短,提高了实验完成的效率。
(3)巧用了橡胶塞、脱脂棉花使得实验装置不仅更加简单,不需要定制,便于推广,且可以提高学生学习化学的兴趣。
(4)对碳酸钠的处理可以减少实验现象对基础较弱学生的干扰性,也可以培养基础较好的学生的科学探究能力。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书(化学必修第一册)[M].北京:人民教育出版社,2019(04):36.
[3]伍强.碳酸钠和碳酸氢钠性质对比实研究[J].化学教学,2015(12):48-50.
[4]周汉芳.碳酸钠、碳酸氢钠热稳定性比较实验的改进[J]. 化学教学,1988(02):30.
[5]徐建菊,吴晓红.借助传感器探究碳酸钠与碳酸氢钠的热稳定性[J].化学教学,2019(04):63-66.
[6]黄金泉,杨晓东.再议碳酸钠、碳酸氢钠热稳定性比较实验的改进[J].化学教学,2021(01):77-79.
[7]王文英.碳酸钠与碳酸氢钠分解温度的热力学估算[J].化学教育,2016,37(15):71-72.

