辛酰基类氨基酸锌配合物的制备及光学性能测试
韩家康,石奕峰,那仁格日乐,2,张 颖
(1.内蒙古师范大学 物理与电子信息学院,内蒙古 呼和浩特 010022;2.内蒙古自治区功能材料物理与化学重点实验室,内蒙古 呼和浩特 010022)
近年来,氨基酸金属配合物应用的研究范围日益广泛,如用于农业、医学及轻纺等领域[1-5],并取得良好效果。其中,辛酰基类氨基酸是一种对环境无污染、纯溶剂中溶解性良好的有机配体化合物,将金属离子与这些氨基酸配体离子结合形成金属氨基酸配合物并研究其在药学及农业方面的应用,对促进药物学和农业学发展具有重大意义。目前研究发现,常用辛酰基类氨基酸配合物具有良好的光吸收能力[6],与稀土离子键合形成的配合物具有良好光学性能,形成的配合物可明显提高配体的光物理性能并具有良好发光性能[7-9]。但大多数氨基酸金属配合物材料在有机纯溶剂中的溶解度较差,而辛酰基类氨基酸金属配合物具有较好的溶解性。此外,锌元素作为过渡元素具有良好的配位性[10],易与氨基酸类配体化合物结合形成金属配合物,且有些氨基酸类锌配合物在医药业、农业、畜牧业等领域已被广泛应用[11-14]。因此,本文选用功能特性优越的辛酰基丙氨酸、辛酰基丝氨酸及辛酰基苯丙氨酸配体,使这些配体与氯化锌在甲醇溶剂中进行反应,制备出辛酰基类氨基酸锌配合物,并研究其光学等性能,以期得到对环境无污染、光学性能优越的多功能性氨基酸系列锌配合物。
1 实验部分
1.1 主要仪器及试剂
主要仪器有Perkin Elmer Spectrum Two 型红外光谱仪、BRUKERNMR 600 核磁共振仪、Hitachi S-3400N型扫描电子显微镜、Philips PW-1830 型X 射线散射仪、Perkin Elmer Lambda 35 型紫外-可见光谱仪、OLYMPUS CX31 型偏光熔点仪等。
所用试剂:DL-丝氨酸(aladdin,99%)、DL-丙氨酸(aladdin,99%)、DL-苯丙氨酸(aladdin,99%)、氯化锌等。
1.2 配合物合成
根据文献[7]的合成方法制备辛酰基丙氨酸、辛酰基丝氨酸及辛酰基苯丙氨酸三种辛酰基类氨基酸配体化合物。采用溶液化学反应法[15],取一定量的辛酰基类氨基酸配体溶于甲醇中,滴加氢氧化钾溶液调节pH≈7,之后缓慢加入氯化锌甲醇溶液制备出目的配合物,后经过滤、提纯的方法处理杂质,再采用旋蒸法得到高纯度的固体粉末配合物。
2 结果分析
2.1 元素分析
通过卡尔-费舍尔滴定法来确定配合物中的结合水(表1)。由表1 可知,配合物元素含量分析结果的测量值与理论值相差小,可推断配合物成功合成,并且所得配合物十分纯净。
2.2 1H NMR 分析
核磁共振氢谱得到的辛酰基类氨基酸锌配合物的氢原子化学位移如下式和图1 所示,核磁共振氢谱图如图2 所示。Zn(oct-ala)2:1H NMR(600 MHz,DMSO-d6)δ 7.82~7.65(m,1H),4.36(s,4H),4.21~4.12(m,1H),2.17~1.99(m,2H),1.52~1.44(m,2H),1.29~1.21(m,11H),1.08~1.05(m,11H),0.90~0.83(m,3H)。图2 中未发现羧基H 原子的峰位,说明配合物成功合成。1.29~1.21(m,11H)与1.08~1.05(m,11H)处的峰,是由于锌离子两侧对称分布的配体离子产生异构现象而导致氢原子发生不同的化学位移而造成。由图2 可明显看出锌原子两侧的配体为非对称分布,两配体之间成一定的夹角。其他两种配合物同理。Zn(oct-phe)2:1H NMR(600 MHz,DMSO-d6)δ 7.60(s,1H),7.23~7.15(m,5H),4.37(s,8H),3.17~3.04(m,1H),2.88~2.79(m,1H),2.07~1.93(m,2H),1.40~1.15(m,10H),1.08~1.05(m,13H),0.88~0.82(m,3H)。存在于7.23~7.15(m,5H)处的峰为苯环取代基的特征峰,从图2 中可看出该峰为 Zn(oct-phe)2所特有的峰,并且氢的数目也符合苯环取代基所含的氢原子数目。Zn(oct-ser)2:1H NMR(600 MHz,DMSO-d6)δ 7.60~7.52(m,1H),4.45~4.31(m,6H),4.28~4.14(m,1H),3.70~3.55(m,2H),2.24~2.04(m,2H),1.57~1.42(m,2H),1.34~1.16(m,10H),1.07~1.05(m,13H),0.90~0.84(m,3H)。
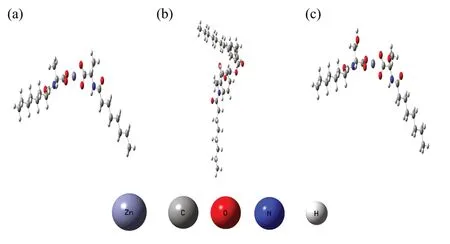
图1 辛酰类氨基锌配合物的理论结构图Fig.1 Theoretical structure of the zinc complexes

图2 辛酰类氨基酸锌配合物核磁氢谱图Fig.2 1H NMR spectra of the zinc complexes
辛酰类氨基酸锌配合物的结构图是根据密度泛函理论,由Gaussview 构建后经Gaussian 09W 软件计算优化而来,优化过程中使用函数为M062X,基组为6-311G。红外光谱中有机物各个官能团的出峰位置受有机物分子结构及官能团自身结构的影响。故通过图3 中计算红外光谱与测试光谱对比可知,该理论结构图具有一定的准确性。
2.3 红外分析
从红外光谱图(图3)中可以看到酰胺基峰位的存在,说明成功合成辛酰基类氨基酸配体,并且COO-与Zn-O 结合部位产生的峰位,证明氨基酸配体与金属离子结合形成氨基酸金属配合物;对比图3 中(a)、(b)、(c)可发现(b)图中水的O-H 峰较为平缓,是由于Zn(oct-phe)2的疏水性较强,较为干燥;Zn(oct-phe)2的红外谱图在1 250~1 542 cm-1存在的两个峰,属于COO-的对称收缩振动和反对称伸缩振动,由于对称伸缩振动的强度弱于反对称伸缩振动,所以1542 cm-1处大的峰属于反对称伸缩振动峰;在1000~1500 cm-1出现的峰间距相等的特征吸收峰组,属于长亚甲基链-CH2的面外摇摆吸收。主要官能团及其对应峰见表2。由元素分析、核磁共振氢谱、红外光谱等测试结果可知辛酰基类氨基酸锌配合物合成成功。
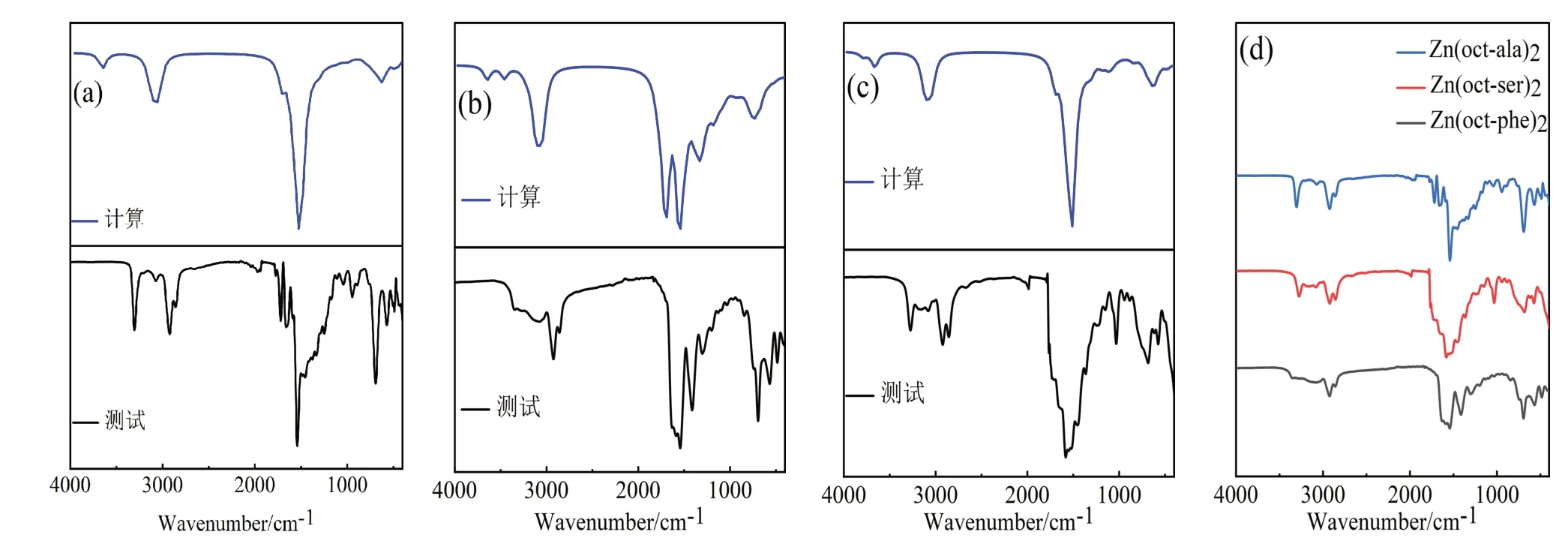
图3 辛酰类氨基酸锌配合物红外光谱图Fig.3 FT-IR spectra zinc complex with octanoyl amino acids
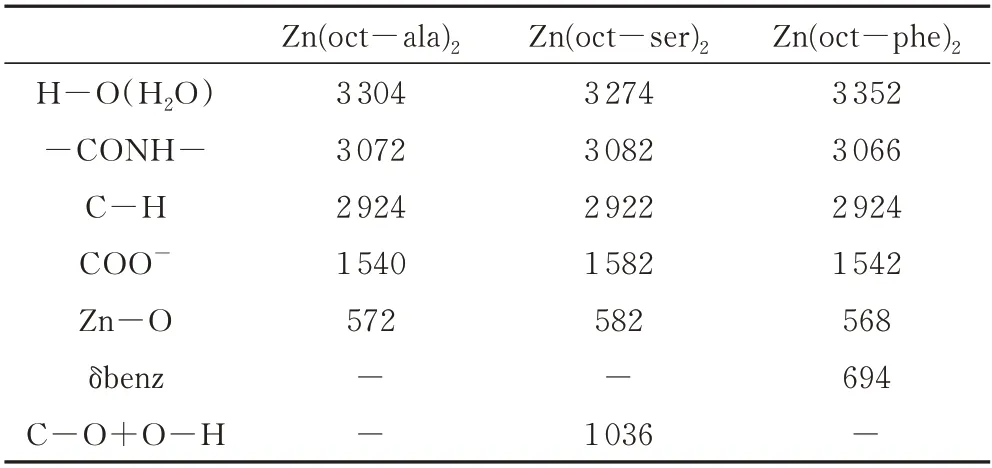
表2 辛酰基氨基酸锌配合物主要官能团对应峰Tab.2 Main vibrational parameters for zinc complexes
2.4 光吸收性能测试
用紫外-可见光吸收光谱仪对三种配合物进行光吸收测试,检测波长范围200~1 000 nm,结果如图4所示。从图4 可知,三种氨基酸配合物在紫外线区域有明显的吸收现象,而可见光区域无吸收。据文献[16]可 知,Zn(oct-ala)2与Zn(oct-ser)2配合物在200~250 nm 之间存在的吸收峰属于发光色团C=O 的n-π*跃迁,Zn(oct-phe)2在200~300 nm存在两个吸收峰属于发光色团C=O 的n-π*跃迁以及苯环的π-π*跃迁,并且对比文献[10]和文献[17]中镁、钙、钇金属配合物光吸收的对比,可以发现辛酰基氨基酸锌配合物的光吸收范围、能力与氨基酸配体化合物结构中存在的发光色团有关,且Zn(oct-phe)2两发光色团之间不存在共轭关系,两发光色团的吸收峰位及范围互不影响。
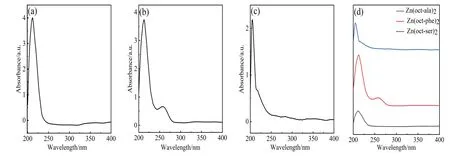
图4 氨基酸锌配合物的紫外-可见光吸收谱图Fig.4 UV-Vis spectra of zinc complex with octanoyl amino acid
2.5 溶解度分析
根据文献[18]中的测试方法,称取0.01 g 样品,在室温下,加入100 μL 纯溶剂,若样品溶解(溶解度>10%),记为“1”;若不溶解,则继续加入1 000 μL 溶剂,若溶解(10%>溶解度>1%),记为“2”,若不溶(溶解度<1%),记为“3”。
三种氨基酸锌配合物纯溶剂溶解度见表3。从表3 可知,三种辛酰基类氨基酸锌配合物中Zn(oct-phe)2的溶解性最佳,在大多有机纯溶剂中都可溶解,而Zn(oct-ser)2与Zn(oct-ala)2溶解性较差,在大多有机溶剂中都不溶。
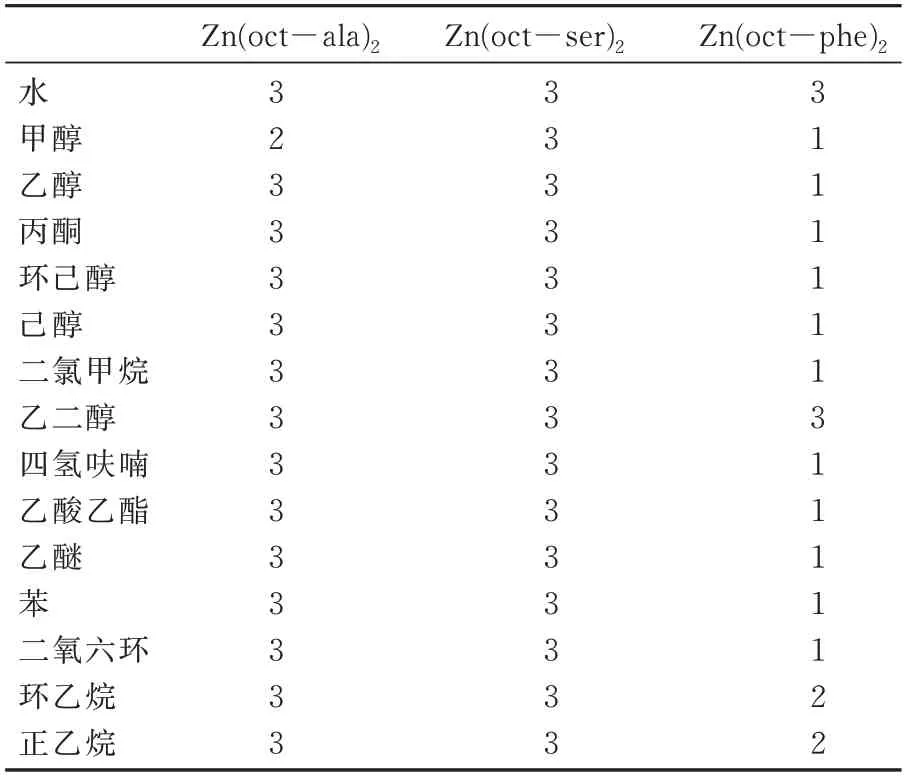
表3 辛酰基氨基酸锌配合物溶解度表Tab.3 Classification of solubilities for complexes in various solvents
2.6 SEM 表面形貌测试
辛酰类氨基酸锌配合物表面电镜扫描形状如图5 所示。从图5 可见配合物以块状或粉末状存在,可以明显看出配合物有团聚现象,并发现Zn(oct-ala)2与Zn(oct-ser)2的团聚性比Zn(oct-phe)2强,但由于配合物熔点较低,无法进行高倍观察来确定其是否具备晶体结构。考虑到三种配合物可能存在结晶现象,故采用X 射线衍射法判别配合物是否存在晶体结构。

图5 辛酰类氨基酸锌配合物扫描电镜图Fig.5 SEM spectra of zinc complex with octanoyl amino acids
2.7 XRD 测试
X 射线衍射法是用于判别样品为晶态及非晶态的主要方法之一[19],辛酰类氨基酸锌配合物的结晶程度衍射检测如图6 所示。三种金属配合物较之文献[8]中配体化合物的结晶状况有较大的改变,尤其是Zn(oct-phe)2。Zn(oct-ala)2与Zn(oct-ser)2的衍射峰多为尖锐峰,表明两种配合物都具有短程有序的晶元结构,有较好的结晶性,但不存在明确的晶体结构;而Zn(oct-phe)2衍射峰整体为非晶态宽峰,其中夹杂一些小的尖锐峰,表明其有非晶化的趋势,可见不同取代基团对有机物结构影响较大。由于Zn(oct-phe)2的结晶性较差,可能导致其熔点较低,同时从侧面表明Zn(oct-phe)2的团聚性差、溶解性能优越的原因。由于配合物具有结晶性,并且辛酰基苯丙氨酸配体化合物本身存在一定的液晶性能,考虑其金属配合物可能也具备液晶性能,所以对三种配合物进行偏光显微镜观察。

图6 辛酰类氨基酸锌配合物的XRD 图谱Fig.6 XRD patterns of zinc complexes
2.8 偏光显微镜观察
三种氨基酸锌配合物的偏光观察如图7 所示。在加热条件下,由透明的玻璃态转变为明亮多彩的液晶态物质,并发现Zn(oct-phe)2的熔点较之另外两种配合物低。检测结果表明三种配合物为良好的熔致液晶材料。熔致液晶材料有三个主要的结构因素:聚合物骨架、聚合物骨架与分子刚性结构之间的间隔体以及刚形体本身[20]。三种配合物以亚基链为柔性骨架,将熔化后的液晶小分子连在一起并限制其活动范围,使其拥有一定程度的流动性;酰胺键作为连接刚性结构与聚合物骨架的间隔体;Zn(oct-phe)2中的刚形体为分子中的苯环结构,而Zn(oct-ala)2与Zn(oct-ser)2中的环状结构可能是配体连接金属离子后产生分子间作用力,氢键的作用形成环状结构或者金属离子使两配体发生异构而形成环状结构,这解释了核磁共振中两配体的氢原子位置不对应的现象。从图7 可见,Zn(oct-phe)2的光学异性强于其他两种配合物,因刚性体为液晶材料中最重要的部分,环状结构的共轭程度决定液晶双折射现象的程度[20],因苯环具有良好的共轭性,所以表现出较强的光学异性,具有优良液晶性能。由于Zn(oct-phe)2具有良好的溶解性且液晶性能优越,可以作为熔致液晶材料应用于多个领域。
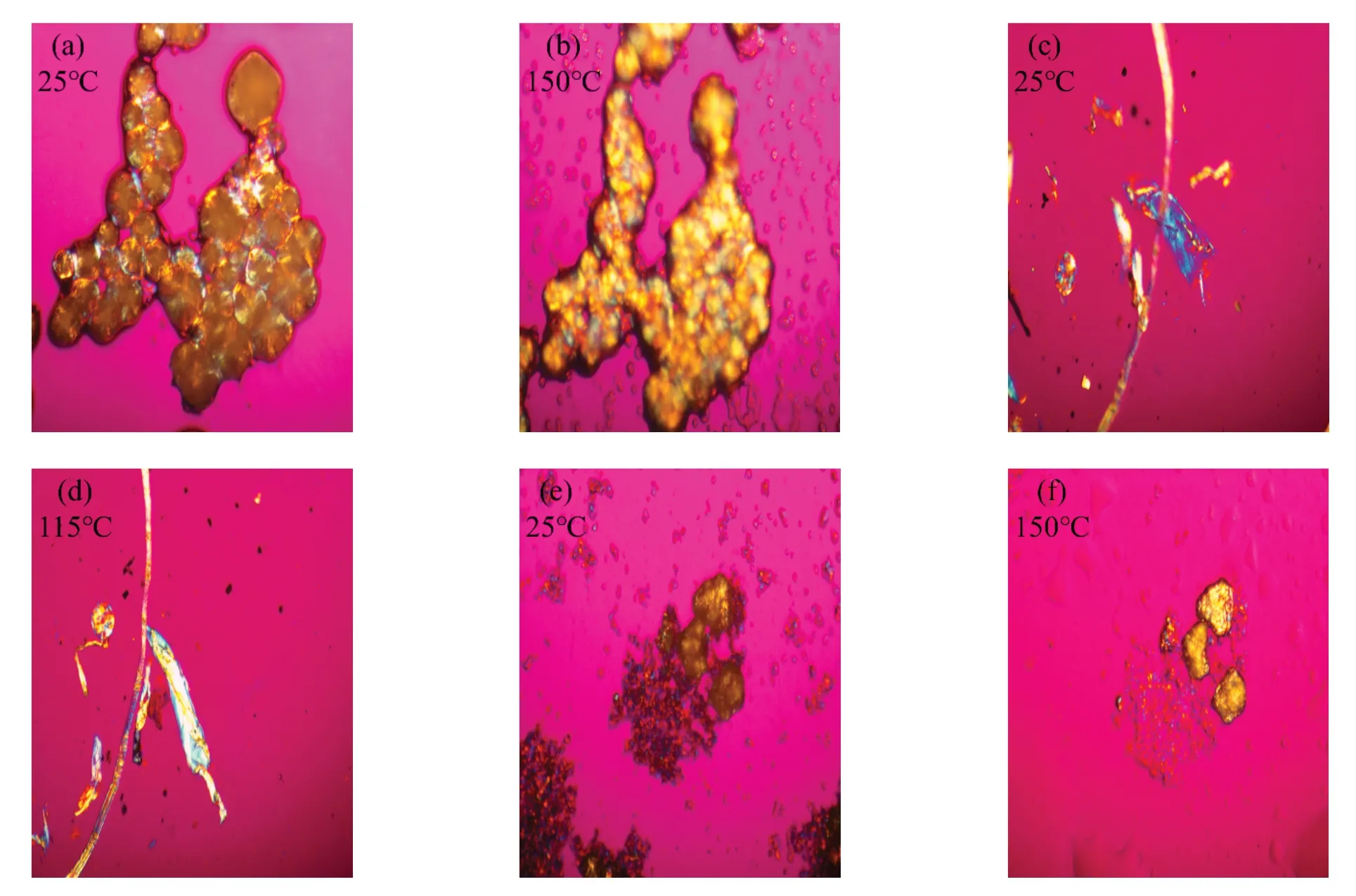
图7 辛酰类氨基酸锌配合物的偏光显微图Fig.7 Polarized light microscopy view of zinc complex with octanoyl amino acid
3 结论
本文以辛酰基类氨基酸化合物为配体与金属离子锌形成氨基酸锌配合物,通过红外光谱分析、元素分析、核磁共振氢谱推断化合物的分子结构。之后对其进行性能测试,得出以下结论:
(1)三种配合物中Zn(oct-phe)2的溶解性能最佳,可溶于大多常用有机纯溶剂中;
(2)Zn(oct-ala)2与Zn(oct-ser)2存在短程有序的结晶结构,而Zn(oct-phe)2则发现出非晶化趋势,非晶化可能是Zn(oct-phe)2溶解性较好的原因;
(3)通过光吸收性能测试可看出三种配合物都存在C=O 发光色团的n-π*吸收,由于Zn(oct-phe)2存在苯环的π-π*的特征吸收,且两发光色团无共轭关系、互不影响,使其光吸收能力较为优越;
(4)三种配合物在熔融状态下都表现出良好的光学异性,拥有液晶性能;但由于共轭性良好的刚形体-苯环的存在,Zn(oct-phe)2的液晶性能最为优越。
鉴于Zn(oct-phe)2具有良好的光吸收能力、液晶性能以及良好的溶解性,在未来有望运用于太阳能薄膜材料或者液晶材料领域。

