继发性甲状旁腺功能亢进症来源的甲状旁腺原代细胞的培养及鉴定
甲状旁腺主细胞在机体甲状旁腺素(PTH)的分泌和体内钙磷代谢等方面发挥着重要作用,进而参与包括继发性甲状旁腺功能亢进症(SHPT)在内的多种疾病的病理过程。SHPT的主要特征为PTH升高,而PTH的合成和分泌受到甲状旁腺细胞膜上钙敏感受体(CaSR)的调节。既往研究表明,在甲状旁腺的发育过程中神经胶质细胞缺失因子2(GCM2)特异性表达,是关键的调控因子。目前,对SHPT的相关研究多局限于动物实验和离体的病理学检查等,关于人来源的原代甲状旁腺细胞模型仅存在于原发性甲状旁腺功能亢进(PHPT)中,尚缺乏SHPT人来源的原代甲状旁腺细胞模型,存在实验受限于多种复杂因素影响、细胞内相关机制难以阐明、实验动物与人类存在先天差异性及病理学检查存在实验局限性等诸多缺点。因此,建立SHPT原代细胞模型对进一步的研究至关重要。本研究通过对培养的SHPT细胞进行PTH、CaSR和GCM2的检测,成功分离并建立了原代甲状旁腺细胞模型,为进一步研究SHPT的发病机制、药物疗效、调控机制等提供了前期基础。
1 材料和方法
1.1 材料
人甲状旁腺原代细胞(中南大学湘雅三医院)。DMEM/F12培养液(赛默飞世尔公司)。细胞胶原酶I(BIOSHARP),胎牛血清(Gibco),荧光标记二抗(湖南艾佳生物公司),PTH兔源多抗(ABclonal),CaSR兔源多抗(Bioss),GCM2兔源多抗(Bioss),Odyssey双色红外荧光成像系统(Li-Cor),LightCycler-4800II PCR仪(Roche)等。
在环境检验实验室数据处理的相关研究中,以往研究多注重在检测结果的自动处理[10].构建检测数据处理系统,通过测试系统数据库模块、数据处理系统模块和综合评价系统模块,实现实验室检测环境数据的自动处理、汇总及分析评价系统,避免中间环节中数据人为记录、汇总的误差,提高了工作效率.高效、准确的环境检测数据对认清环境现状和相关部门的正确决策有重要意义.
1.2 方法
1.2.1 样本采集 收集2019年6~12月中南大学湘雅三医院10例接受外科手术治疗的SHPT患者的异常甲状旁腺组织。实验组纳入标准:18岁以上;慢性肾脏病患者,常规行超声和99mTcMIBI甲状旁腺显像的继发甲状旁腺功能亢进症患者;已知情同意;所有SHPT患者都有多个的甲状旁腺增生,SHPT是根据血清钙和完整的PTH水平诊断的,没有其他可能的高钙血症的原因;患者常规行超声和核素显像以定位甲状旁腺,并通过手术病理确定其是否为结节样增生甲状旁腺。实验组排除标准:全身活动性感染、严重肝病、活动性恶性肿瘤(甲状腺癌除外)、甲状旁腺切除术史、妊娠和免疫抑制剂治疗。
陡河水库大坝坐落在砂层地基上,大坝全长 7 364 m,其中主坝长1 700 m,位于河床一级台地上;副坝长5 664 m,位于二级台地上。主坝地基普遍分布有轻壤土,地基表面高程25.0~26.0 m, 下有4.0~5.0 m轻壤土,再下为细砂层。
2.2.3 细胞生长曲线及PTH测定 甲状旁腺细胞生长较匀速且缓慢,其细胞群体倍增时间约为71.61 h。PTH检测结果显示,培养的甲状旁腺细胞持续分泌PTH,并随时间推移浓度逐渐降低,P0代及P1代原代细胞的PTH分泌相对稳定,P2代PTH分泌则下降明显(图2)。
1.2.4 细胞的传代 当细胞长满时进行细胞传代,使用与培养基等量的PBS缓冲液洗涤细胞2~3遍后,加入0.25%胰酶,倾斜培养皿使其遍布培养皿的底部区域,置于恒温培养箱中消化2 min左右,在显微镜下观察可见贴壁的细胞脱落后呈圆形透亮,悬浮其中,加入配置好的完全培养基终止消化,使用灭菌后的吸头反复吹打培养皿底部区域使细胞完全脱落,转移至15 mL离心管中离心5 min,设置转数1000 r/min,r=16 cm,弃掉上清液后加入预热好的新鲜的完全培养基,吹打重悬后置入恒温培养箱中继续培养。隔日换液,每次换液后留取上清液检测PTH含量,剩余冻存于-80 ℃冰箱中。
1.2.3 原代细胞的提取 使用胶原酶法提取甲状旁腺细胞。在培养基中用眼科剪将甲状旁腺组织标本切碎成约0.5~1.0 mm的碎片,PBS溶液洗涤3遍,然后转移至离心管中加入足量的0.2%胶原酶I溶液,添加1.5%小牛血清和1.25 mmol/L CaCl,震荡消化30 min,离心5 min,吸出弃上清液。加入PBS缓冲液重悬消化的组织后,经100 μm滤网中过滤,滤过的消化残留物可根据情况加入胶原酶I再次消化。将过滤后的细胞悬液再次离心5 min,吸出上清液。加入配置好的适量RPMI 1640完全培养液,使用血球计数仪进行细胞计数后,调整细胞浓度至1×104/mL,并将细胞悬液转移至培养皿中,置于恒温培养箱中培养,此为P0代细胞。隔日换液,每次换液后留取上清液检测PTH含量,剩余冻存于-80 ℃冰箱中。
在食品、制药和化学工业中,乳酸的作用和应用日益广泛,同时在许多化合物的合成中,乳酸也是重要的中间体或者组成部分[49]。菊芋作为生产乳酸的原料,成本更低。同时利用菊芋也有可能产生多种化学物质[50-52],如琥珀酸、丁酸、2,3-丁二醇、柠檬酸和山梨糖醇等。
1.2.5 PTH 检测 使用嘉慧生物人甲状旁腺(PTH)ELISA试剂盒进行P0、P1及P2代甲状旁腺细胞培养液的PTH检测。用酶标仪在450 nm波长依序测量各孔的光密度值。
1.2.6 测定细胞生长曲线 将培养的P0代甲状旁腺细胞消化,调节细胞浓度为1×10/mL,接种于24孔培养板,约1 mL/孔,置于培养箱内培养,每隔24 h收集3孔细胞并计数,取均值。将均值取log10的对数进行线性拟合,描绘细胞的生长曲线,计算细胞群体倍增时间。
使用Graphpad Prism 6软件对数据进行统计学分析,计量资料用均数±标准差表示,组间比较采用检验或者配对检验,<0.05为差异有统计学意义。
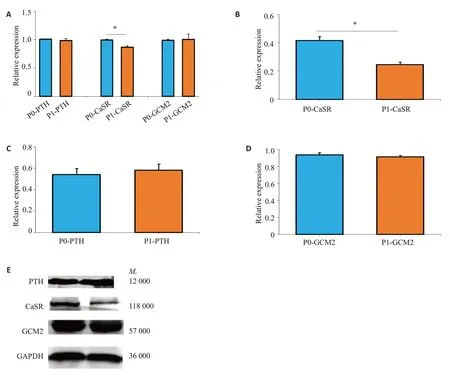
2.3.1 基因及蛋白表达检测 qRT-PCR结果显示,P0代细胞中CaSR 表达高于P1 代细胞(0.996±0.0130.865±0.027,=0.017),而PTH(1.010±0.0040.985±0.033,=0.572)与GCM2(0.987±0.0241.004±0.092,=0.892)在P0及P1代细胞中的表达差异均无统计学意义(图3A)。Western blot结果显示,P1代细胞CaSR蛋白表达水平较P0代细胞下降(0.417±0.0270.247±0.017,=0.006),而PTH(0.541±0.0560.581±0.058,=0.625)与GCM2(0.934±0.0280.912±0.018,=0.689)蛋白表达水平在P0及P1代细胞中表达差异均无统计学意义(图3B~E)。

1.2.9 Western blot测定细胞特异蛋白的表达 收集P0及P1代分离纯化后的细胞,用蛋白裂解液在冰上裂解细胞。加入样本进行SDS-PAGE电泳,转膜,封闭,再加入一抗过夜。第2天TBST洗涤3次后,加入二抗常温孵育1 h。TBST清洗后,加入显影液拍照。
1.3 统计方法
1.2.7 免疫荧光染色 取P1代甲状旁腺细胞,冰冻切片,PBS洗片3×5 min。消除非特异性背景染色:滴加正常山羊血清封闭液(PBS稀释)室温20 min后甩去液体,PBS洗片3×5 min。滴加一抗:4 ℃过夜,之后37 ℃复温30 min或37 ℃孵育1 h,PBS洗片3次,5 min/次。滴加荧光素标记的二抗37 ℃孵育60 min。PBS洗片3次,5 min/次。抗荧光淬灭剂封片,镜检。
2 结果
2.1 SHPT患者临床特征
2.2.1 细胞形态学观察 使用胶原酶法提取甲状旁腺细胞并进行传代培养。P0代细胞消化过滤后混匀时细胞呈圆形透明,散在分布,细胞贴壁后呈多角形或者纺锤形,细胞缓慢增殖。待细胞长满整个培养皿后传代,第1次传代的细胞为P1,贴壁后与原代细胞大致相似,绝大多数呈梭形,少部分细胞呈多角形,胞浆均质透明,且生长缓慢。直至第3次传代细胞P3,贴壁后细胞形态与原代细胞依旧大致相似(图1A)。
2.2 SHPT细胞生物学特点
本研究纳入的10例SHPT组织样本的患者均为女性,年龄30~63岁,甲状旁腺病理类型:SHPT患者均为结节状甲状旁腺增生,对照组患者均为正常甲状旁腺,且PTH在SHPT患者中增高。
2.2.2 P1代细胞免疫荧光染色 使用PTH兔源一抗和荧光标记二抗以及DAPI染液标记P1代细胞后,可见所有细胞核显示蓝色荧光(图1B),胞质显示绿色荧光,细胞核周围荧光浓度相对较高(图1C)。

1.2.2 标本处理 甲状旁腺切除术中切取标本腺体中央的部分甲状旁腺组织,生理盐水冲洗后挤出血液,将腺体立即放入装有4 ℃无血清DMEM/F12培养溶液的离心管中,在30 min内送往实验室提取原代细胞,其余的甲状旁腺常规送病理活检。
许多刑事案件的被害人与犯罪嫌疑人、被告人之间冲突的爆发往往是由于双方在交往的过程中,彼此存在着个性的差异或利益分配不均衡等因素导致了矛盾的产生,而此种矛盾又没有及时得到正确、有效的处理所致。因此运用证伪思维审查被害人陈述,可以更好地通过全面认识被害人陈述来帮助办案人员排除被害人的虚假陈述,指明侦查方向,正确分析案件情况,排除被害人陈述的虚假部分,及时纠正办案过程中的偏差,节省办案资源,提高办案质量。

2.3 P0代细胞和P1代细胞基因和蛋白表达检测
1.2.8 实时定量PCR(qRT-PCR)检测差异表达的mRNAs 表达水平,采用染料法(SYBR Green I)用LightCycler-4800II PCR仪进行Real-time定量PCR分析,内参选用GAPDH,所有引物由锐博生物公司设计并合成(表1)。
临床药物剂量可以根据理想体质量、总体质量、瘦体质量计算得出。但目前关于产妇的全麻药物剂量的最佳计算方法尚无共识。研究[2]认为,根据瘦体质量计算的丙泊酚诱导剂量不足以引起意识丧失;而总体质量更适用于肥胖患者[3]。本研究采用总体质量来计算产妇的诱导剂量。
3 讨论
CKD 患者由于肾脏功能改变导致体内钙、磷及1,25(OH)D等代谢紊乱,进而导致体内PTH水平增加,逐步进展为SHPT,关于其发病机制的研究尚处于早期阶段,目前缺乏人类来源的甲状旁腺细胞系。国内外学者使用了牛、人、大鼠等不同物种的甲状旁腺进行了原代细胞的提取,发现甲状旁腺细胞在体外生长缓慢,难以长期培养。现国内对于人甲状旁腺原代细胞的提取多以PHPT患者来源为主,而部分学者认为SHPT患者增生的甲状旁腺可能更适合体外培养,但实验需要在短期内进行。
本研究探讨了SHPT患者甲状旁腺原代细胞进行体外培养的可行性,使用10例SHPT患者的手术标本进行甲状旁腺细胞的培养,最终成功分离了SHPT甲状旁腺原代细胞。在P0代细胞培养期间,分散的细胞贴壁后显微镜下观察大致呈现多角形或者纺锤形;而P3代细胞贴壁后与原代细胞大致相似,绝大多数呈梭形,少部分细胞呈多角形,这与既往研究所培养的细胞形态大致相似。相比之下,本研究的培养方法更加完善,原代细胞的纯度、传代数、传代时间较前均有提升。实验显示,在P0和P1代细胞中GCM2、PTH、CaSR蛋白均有表达。而PTH是甲状旁腺主细胞特异性分泌的激素,GCM2只在甲状旁腺细胞中特异性表达,说明本研究培养的细胞为甲状旁腺来源。本研究成功培养的SHPT来源甲状旁腺原代细胞的意义在于准确把握体外培养可靠的有效期,实验证明在P0、P1代细胞具有体细胞相似性,有效培养时间为14 d左右,证明可通过体外培养P0、P1代甲状旁腺细胞期间进行后续实验研究,达到探讨SHPT分子机制研究的目的。
进一步实验表明,甲状旁腺细胞PTH分泌的浓度随时间呈逐渐减少的趋势,且在传代后分泌减慢,GCM2在P0代细胞与P1代细胞的表达无明显差异,结合其mRNA及蛋白水平研究,提示传代后的细胞PTH分泌的减少可能是由于分泌水平或者PTH降解途径的变化,而细胞合成PTH可能未受到影响。然而有研究使用大鼠甲状旁腺提取的原代细胞分散培养发现,随着培养时间的延长,大鼠甲状旁腺细胞GCM2 的mRNA及蛋白表达逐渐升高。这与本研究的结果不一致,可能是不同物种细胞在体外分子表达水平变化情况不一致,因为他们研究使用的是正常大鼠,而本研究使用的是SHPT患者的样本,GCM2本身已存在表达异常。
4)污水流速增大,换热面积减小,当污水流速为0.2 m/s时,换热面积为472 m2,减小约19%;而提高到0.25 m/s时,换热面积减小7%.三个速度中,0.2 m/s是较为适宜的设计速度.
既往研究显示,随着患者肾功能不全时间推移,SHPT病情进展,患者甲状旁腺从弥漫性增生逐渐进展到腺瘤样增生,甲状旁腺细胞的CaSR表达也逐渐减少,在SHPT患者体内甲状旁腺细胞CaSR表达较正常人下调约60%。其确切机制尚未阐明,日本学者使用大鼠进行5/6加高磷饮食进行SHPT造模,发现实验组大鼠的甲状旁腺CaSR mRNA及蛋白表达均下降,且CaSR DNA甲基化程度较对照组更高,然而这种甲基化水平仍然很低(只有1%~2%),不足以解释CaSR mRNA及细胞膜上CaSR蛋白表达下降,可能还有其他原因导致SHPT大鼠甲状旁腺细胞CaSR的下调。有研究向大鼠腹膜内注射1,25(OH)D后15 h,甲状旁腺和肾脏的CaSR mRNA水平增加了2倍,表明在CaSR基因两个启动子中均存在维生素D反应元件,这一证据提示SHPT甲状旁腺细胞膜CaSR的表达下降可能与体内1,25(OH)D的减少有关。这与本研究的结果变化趋势一致,P0代细胞传代至P1代后细胞CaSR mRNA和蛋白的表达水平均下降了,其机制有待进一步研究。
改进后,依从性评分高于改进前,8分率高于改进前,0~5 分率低于改进前,差异有统计学意义(P<0.05)。见表2。
本实验中影响甲状旁腺细胞原代培养成功与否的因素有:(1)样本离体时间及组织块的活性:离体后30 min内处理的样本,组织块活性较高,细胞接种至培养皿后贴壁良好,细胞贴壁后呈多角形或者纺锤形,细胞增殖均匀而缓慢,细胞群体倍增时间约为71.61 h;(2)组织块的大小:将样本剪碎为0.5~1.0 mm组织块时,利于用胶原酶法提取组织块内甲状旁腺细胞,此时组织块边缘毛糙,利于细胞的游出;(3)无菌操作:严格遵循无菌原则进行细胞培养过程中的各项操作。
本研究采用胶原酶法成功分离了SHPT来源的甲状旁腺细胞,细胞呈多角形或者纺锤形,细胞界限明显,符合甲状旁腺细胞的形态学表现。此方法简便、高效,且获得的细胞纯度较高,具有良好的生物学特性。可在体外培养P0、P1代甲状旁腺原代细胞约14 d短期内进行后续实验研究,达到探讨SHPT分子机制的目的。