高糖对体外培养视网膜Müller细胞自噬及凋亡的影响
王立 颜世传 牛兰俊 朱曼辉 孙晓东 徐迅 宋鄂
作者单位:1苏州大学附属理想眼科医院,苏州 215021;2上海市第一人民医院,上海 200080
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病最严重的微血管并发症之一,DR发病率、致盲率随着糖尿病病程的延长而增加[1]。研究表明,氧化应激、糖基化代谢产物堆积、视网膜神经细胞退行性病变、血管生长因子及炎症因子释放增多等机制共同参与DR的发病[2-3]。近年来,探讨DR的发病机制,并抑制其发生发展已成为DR研究的前沿与焦点。在哺乳动物中,视网膜胶质细胞分为小胶质细胞和大胶质细胞,Müller细胞是一种特化的大型星型胶质细胞,Müller细胞贯穿于视网膜全层,是视网膜细胞的主要组成部分[4]。它能维持视网膜的正常代谢,调节神经成分和血管成分之间的相互作用,在病理状态下,其异常活化与DR[5]、视网膜变性、缺血性疾病有着密切关系。
自噬是细胞内物质的降解途径之一,自噬参与维持细胞内稳态[6-7],介导细胞内蛋白和部分细胞器的降解,对维持细胞内环境稳态具有重要的生理意义,在病理情况下可诱导自噬,尤其是缺氧应激反应[8],然而缺氧应激反应恰恰是DR的一个重要发病机制,既往研究也表明高糖环境下培养Müller细胞,其自噬功能出现紊乱[9],错误折叠蛋白逐渐增多,同时检测发现血管内皮生长因子(Vascular endothelial growth factor,VEGF)含量明显增高,Müller细胞过度胶质增生。自噬与凋亡是细胞代谢的2 种不同方式,二者相互制约,处于动态平衡,共同维持细胞内稳态。如果细胞自噬通路出现障碍,细胞反应效率和功能受损,生命活动失衡后启动凋亡通路[10]。因此,DR的发病机制和细胞凋亡、细胞自噬、自噬和凋亡水平失衡密切相关,其具体机制有待进一步研究,这极有可能是导致DR发生发展的重要因素。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验动物为出生后5~7 d的SD大鼠,由苏州大学医学院动物中心提供,雌雄不限,本实验遵循视力与眼科研究协会(ARVO)关于在眼科和视力研究中使用动物的声明。
1.1.2 试剂 自噬抑制剂3-甲基腺嘌呤(3-MA,美国Sigma公司);胎牛血清(FBS,美国Gibico公司);DMEM/F-12 培养基(美国Gibico公司);胰蛋白酶(美国Gibico公司);青链霉素双抗溶液(美国Gibico公司);beclin-1单克隆抗体(美国Santa Cruz公司);LC3单克隆抗体(美国Abcam公司);LC3慢病毒(上海汉恒公司);P62 单克隆抗体(美国Abcam公司);GAPDH单克隆抗体(美国santa Cruz公司)等。
1.2 方法
1.2.1 原代Müller细胞培养及分组 将出生5~7d的SD大鼠浸泡于75%的乙醇中处死,并在无菌状态下取出眼球,置超净工作台无菌操作,在显微镜下沿角膜缘剪开,去除角膜、晶状体及玻璃体,分离出视网膜组织,然后收集于培养皿中。先加入0.25%胰蛋白酶37 ℃消化7 min,然后加入含15%FBS的DMEM/F-12培养基终止消化。用移液枪轻轻吹打,在倒置显微镜下观察细胞吹打的程度,见视网膜组织已消化成10~20个细胞的组织团块,70%的细胞从中游离时停止吹打。接种于培养瓶中,放入37 ℃、体积分数为5%CO2的培养箱培养。定时观察细胞的生长情况,2~3 d换液1次。当细胞长满培养板的80%以上时进行消化传代:吸出培养液,PBS充分冲洗3次,每个培养瓶中加入0.25%胰蛋白酶1 ml,37 ℃温箱中消化20~30 s,显微镜下观察细胞触角稍皱缩后,去除胰酶,加入完全培养基终止消化,反复轻轻吹打将细胞完全脱壁,移入离心管,1 000 r/min离心5 min,去除上清液,加入含15%FBS的DMEM/F-12培养基重悬细胞,按1∶2传代,由于通过传代培养,第三代Müller细胞具有较高的纯化率,通过谷氨酰胺合成酶(Glutamine synthetase,GS)鉴定(见图1E)并被用于实验研究,移入放有细胞爬片的6孔培养板,置于5%CO2恒温培养箱中培养。实验前将纯化的Müller细胞用无血清的DMEM/F-12培养基饥饿24 h进行同步化处理。纯化后的Müller细胞随机分为5.5 mmol/L葡萄糖组[正常组(Normal glucose,NG)]以及20、30、40、50 mmol/L高糖组;使用40 mmol/L高糖培养时随机分为不同时间组:3、6、12、24、36 h高糖组;3-MA组(3-甲基腺嘌呤,自噬特异性抑制剂,5 mmol/L)作为阴性对照组以观察高糖对视网膜Müller细胞自噬的抑制作用水平。
1.2.2 Western Blot蛋白质印迹法 收集各组Müller细胞加入含蛋白酶抑制剂cocktail,不含乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)的RIPA细胞裂解液提取总蛋白,BCA法测蛋白浓度,等量蛋白上样,10%SDS-PAGE电泳,湿转至聚偏二氟乙烯膜(PVDF),5%脱脂牛奶室温封闭2 h,LC3兔单克隆(1∶1 000)、beclin-1鼠单克隆(1∶500)、P62鼠单克隆(1∶1 000)、GAPDH(1∶2 000)抗体孵育,4 ℃过夜,第2天取出室温复温1 h,PVDF膜于摇床上洗涤3次,每次5 min,加入二抗,室温摇床孵育2 h。红外成像系统(美国LI-COR odyssey)显影后应用Image J软件进行积分吸光度(A)分析。
1.2.3 免疫荧光 取对数期Müller细胞按5×105个/孔的细胞量接种于6 孔板中,按不同实验分组处理24 h后,利用4%多聚甲醛固定Müller细胞20 min,再用1% Triton X-100通透细胞后以5%血清封闭,加入1∶200稀释的LC3、P62抗体于4 ℃孵育过夜。以PBS洗3次,加入1∶1 000稀释的荧光二抗于室温避光孵育2 h,Hoechst染核15 min。以PBS洗3 次,封片后荧光显微镜观察拍照。随机选择10个视野计数自噬细胞数。
1.2.4 TUNEL实验 对于正常组、6 h高糖组、24 h高糖组及3MA组的12孔板细胞,PBS洗涤1次,4%多聚甲醛固定细胞30 min。加入含0.3% Triton X-100的PBS,室温孵育5 min。在样品上加50 μl TUNEL检测液,37 °C避光孵育60 min,PBS或HBSS洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察。
1.2.5 透射电子显微镜观察 将Müller细胞接种于直径10 cm的培养皿中,于37 ℃、5%CO2细胞培养箱中培养过夜,至细胞密度达到90%,换新鲜培养基。后用不含EDTA胰酶消化细胞,4 ℃、1 000 r/min离心5 min后收集细胞,冷PBS洗涤2遍,加入3%(体积分数)戊二醛溶液,4 ℃固定过夜,送样检验。
1.2.6 GFP-LC3慢病毒转染 取原代Müller细胞培养第3代纯化的视网膜Müller细胞,制备24孔板细胞爬片,每孔板细胞数约1.25×105/孔,在倒置显微镜下确定每个孔的细胞爬片上的细胞均生长良好;丢弃原培养液,每孔加入新鲜培养液约1.2 ml,并分别加入病毒液,设置无病毒转染的细胞孔作为阴性对照组。每孔加入新鲜的不同处理条件培养基:正常组、6 h高糖组、24 h高糖组。观察Müller细胞生长状况及GFP-LC3荧光蛋白表达情况。
1.3 指标选择及观察
微管相关蛋白轻链3(Microtubule-associatedproteinlight-chain-3,LC-3)是目前检测自噬的标志蛋白,定位于自噬体分隔膜上,在自噬体形成各阶段的内外膜及自噬溶酶体膜上也可见到。本实验通过使用外源性绿色荧光蛋白来示踪自噬形成,细胞发生自噬后,LC3表达增加并转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,斑点的个数被用来评价自噬活性的高低。用Western Blot法检测细胞内LC3蛋白的相对含量(LC3Ⅰ/LC3Ⅱ)、Beclin-1(自噬相关蛋白,BECN1)及P62(自噬代谢底物标志蛋白,SQSTM1/p62),评价自噬水平。同时透射电子显微镜的超微结构观察也一直被认为是检测自噬的金标准,在透射电子显微镜下,可以观察到自噬小体(双层膜结构、膜内包裹有胞浆成分)及自噬溶酶体(单层膜结构)的形态及数量变化。
1.4 统计学方法
实验研究。数据分析采用统计学软件GraphPad Prism 7(GraphPad Prism Software,美国CA)。各检测指标的数据经Shapiro-Wilk检验证实呈正态分布,以均数±标准差表示,经过Levene检验证实方差齐。各组间视网膜Müller细胞自噬相关蛋白(Beclin-1、P62蛋白、LC3Ⅰ/LC3Ⅱ)相对表达量差异比较,高糖不同刺激时间对Müller细胞自噬相关蛋白、自噬小体及凋亡细胞率的差异比较采用单因素方差分析,组间两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组Müller细胞质内自噬相关蛋白的表达变化
使用Western Blot法分别检测正常组及20、30、40、50 mmol/L高糖组培养下视网膜Müller细胞质内自噬相关蛋白的表达情况。检测结果显示正常组及20、30、40、50 mmol/L高糖组中Müller细胞质的Beclin-1、P62及LC3Ⅰ/LC3Ⅱ蛋白相对表达量总体比较,差异均有统计学意义(F=131.21,P=0.029;F=197.25,P=0.012;F=100.02,P=0.045)。与正常组比较,各浓度高糖组Müller细胞质内Beclin-1、LC3Ⅰ/LC3Ⅱ蛋白均明显降低(P<0.05),P62 蛋白相对表达量明显增加(P<0.001)。40 mmol/L与50 mmol/L高糖组Müller细胞质内Beclin-1、P62、LC3Ⅰ/LC3Ⅱ蛋白相对表达量相似,差异均无统计学意义(P=0.092、0.158、0.429)。由此可见,视网膜Müller细胞在一定浓度范围内高糖培养(高糖浓度≤50 mmol/L)时,高糖对自噬的抑制作用具有浓度依赖性。见图1。
2.2 不同高糖刺激时间对视网膜Müller细胞的自噬影响
使用Western Blot法分别检测正常组及6、12、24、36 h高糖组LC3Ⅰ/LC3Ⅱ、P62、Beclin-1蛋白的表达,结果显示正常组有明显自噬标志蛋白LC3-Ⅱ及Beclin-1 蛋白表达,底物标志蛋白P62 表达较少。正常组及6、12、24、36 h高糖组中Müller细胞质的自噬相关蛋白Beclin-1、P62及LC3Ⅰ/LC3Ⅱ蛋白相对表达量总体比较,差异均有统计学意义(F=98.46,P=0.015;F=109.48,P=0.004;F=99.27,P=0.032),其中与正常组比较,3 h高糖组LC3Ⅰ/LC3Ⅱ、Beclin-1、P62蛋白变化差异无统计学意义(P>0.05),6 h高糖组LC3Ⅰ/LC3Ⅱ、Beclin-1 蛋白明显增加(P=0.002、0.015),但P62 蛋白变化较小,差异无统计学意义(P=0.214),12、24、36 h高糖组与正常组相比较LC3Ⅰ/LC3Ⅱ、Beclin-1 蛋白明显下降(P<0.05),但P62 蛋白明显增加(P<0.001),24 h、36 h高糖组组间比较差异无统计学意义(P=0.176)。见图2。
2.3 不同时间高糖培养对视网膜Müller细胞LC3-Ⅱ和P62的表达及细胞定位
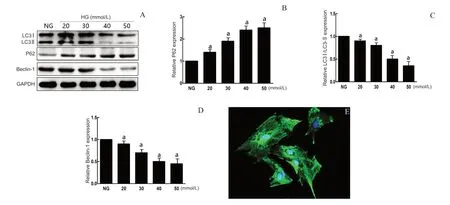
图1.各组Müller细胞质内自噬相关蛋白的表达情况A:正常组及20、30、40、50 mmol/L高糖组细胞质中LC3Ⅰ/LC3Ⅱ、P62、Beclin-1蛋白的表达。B、C、D:分别为Beclin-1、P62、LC3Ⅰ/LC3Ⅱ蛋白条带密度比值柱状图,不同实验组Müller细胞质的Beclin-1、P62及LC3Ⅰ/LC3Ⅱ蛋白相对表达量总体比较差异有统计学意义。a,与正常组比较,P<0.01Figure 1.Expression changes in autophagy-related proteins in the cytoplasm of Müller cells in different groups.A:Western blot was used to detect the expression of LC3Ⅰ/LC3Ⅱ,P62 and Beclin-1 proteins in the cytoplasm of the normal group and high glucose groups at 20,30,40 and 50 mmol/L.B,C,D:Densitometric analysis of Beclin-1,P62 and LC3Ⅰ/LC3Ⅱ levels relative to their respective standards.a,compared to NG,P<0.01.HG,high glucose group;NG,normal group.
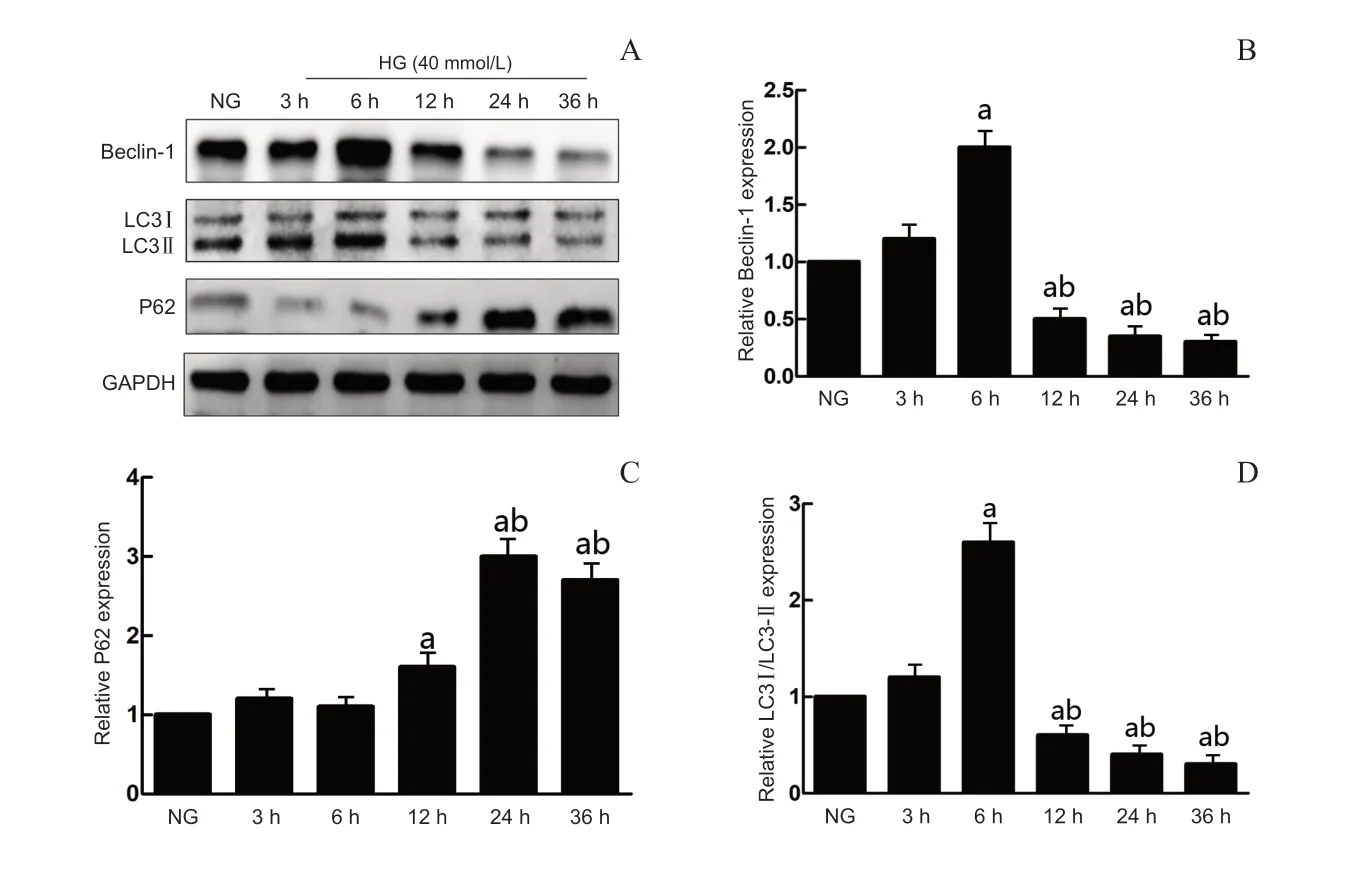
图2.不同高糖刺激时间对视网膜Müller细胞的自噬影响A:使用Western Blot法分别检测正常组及6、12、24、36 h高糖组细胞质中Beclin-1、P62、LC3Ⅰ/LC3Ⅱ蛋白的表达。B,C,D:分别为Beclin-1、P62、LC3Ⅰ/LC3Ⅱ蛋白条带密度比值柱状图,不同实验组Müller细胞质的自噬相关蛋白Beclin-1、P62及LC3Ⅰ/LC3Ⅱ蛋白相对表达量总体比较差异有统计学意义。a,与正常组比较,P<0.01,b,与6 h高糖组比较,P<0.01Figure 2.Effects of different high glucose stimulation times on the autophagy of retinal Müller cells.A:Western blot was used to detect the expression of Beclin-1,P62 and LC3Ⅰ/LC3Ⅱ proteins in the cytoplasm of the normal group and high glucose groups at 6,12,24 and 36 h.B,C,D:Densitometric analysis of Beclin-1,P62 and LC3Ⅰ/LC3Ⅱ levels relative to their respective standards.a,compared to NG,P<0.01;b,compared to HG (6 h),P<0.01.HG,high glucose group;NG,normal group.
我们对高糖刺激6 h(自噬水平明显增强时间点)及24 h(自噬水平明显减弱时间点)这2个时间节点,使用细胞免疫荧光观察40 mmol/L高糖对LC3-Ⅱ和P62 的表达量影响及细胞定位情况,结果显示LC3-Ⅱ和P62这2个与自噬密切相关的蛋白质主要在细胞质中表达,3-MA组作为阴性对照组,对比24 h高糖培养对Müller细胞LC3-Ⅱ和P62的表达量的影响。正常组、6 h高糖组及24 h高糖组LC3-Ⅱ和P62在细胞质的表达总体比较,差异均有统计学意义(F=240.49,P=0.014;F=198.98,P=0.001)。与正常组比较,6 h高糖组中LC3Ⅱ表达明显增加,差异有统计学意义(P=0.003),P62 蛋白变化差异无统计学意义(P=0.176),24 h高糖组中LC3Ⅱ表达明显下降(P=0.013),P62蛋白变化增加(P=0.040),24 h高糖组与3MA组对比,LC3-Ⅱ和P62的表达量变化差异均无统计学意义(P=0.091),说明高糖刺激Müller细胞24 h后具有明显的自噬抑制作用。见图3。
2.4 高糖对视网膜Müller细胞自噬小体形成的影响
本研究采用透射电镜及GFP-LC3 慢病毒转染正常组及6、24 h高糖组视网膜Müller细胞,观察细胞中自噬小体及自噬溶酶体的变化。结果显示正常组及6、24 h高糖组视网膜Müller细胞中GFP-LC3转染阳性颗粒、自噬小体相对数量组间差异有统计学意义(F=78.47,P=0.039;F=89.01,P=0.021),其中6 h高糖组与正常组比较,GFP-LC3转染阳性颗粒、自噬小体相对数量明显增加(P=0.002、0.029),24 h高糖组与正常组比较,GFP-LC3 转染阳性颗粒、自噬小体相对数量明显降低(P=0.019、0.036),然而正常组及6、24 h高糖组视网膜Müller细胞中自噬溶酶体的相对数量变化不明显(F=24.47,P=0.315)。见图4。
2.5 TUNEL染色观察高糖对视网膜Müller细胞凋亡的影响
对正常组、6 h高糖组、24 h高糖组及3MA组进行TUNEL染色分析,并计算细胞凋亡指数。结果发现正常组、6 h高糖组、24 h高糖组及3MA组视网膜Müller细胞凋亡指数分别为3.14±1.01、15.34±3.87、25.82±4.96、24.79±4.01,4 组间Müller细胞凋亡指数总体差异有统计学意义(F=234.12,P=0.003),其中与正常组比较,6 h及24 h高糖组TUNEL阳性细胞增多(P=0.022、0.039);与6 h高糖组比较,24 h高糖组TUNEL阳性细胞进一步增加(P=0.017);与正常组比较,3MA组细胞凋亡数增加(P=0.020);与3MA组比较,24 h高糖组细胞凋亡指数差异无统计学意义(P=0.187)。见图5。
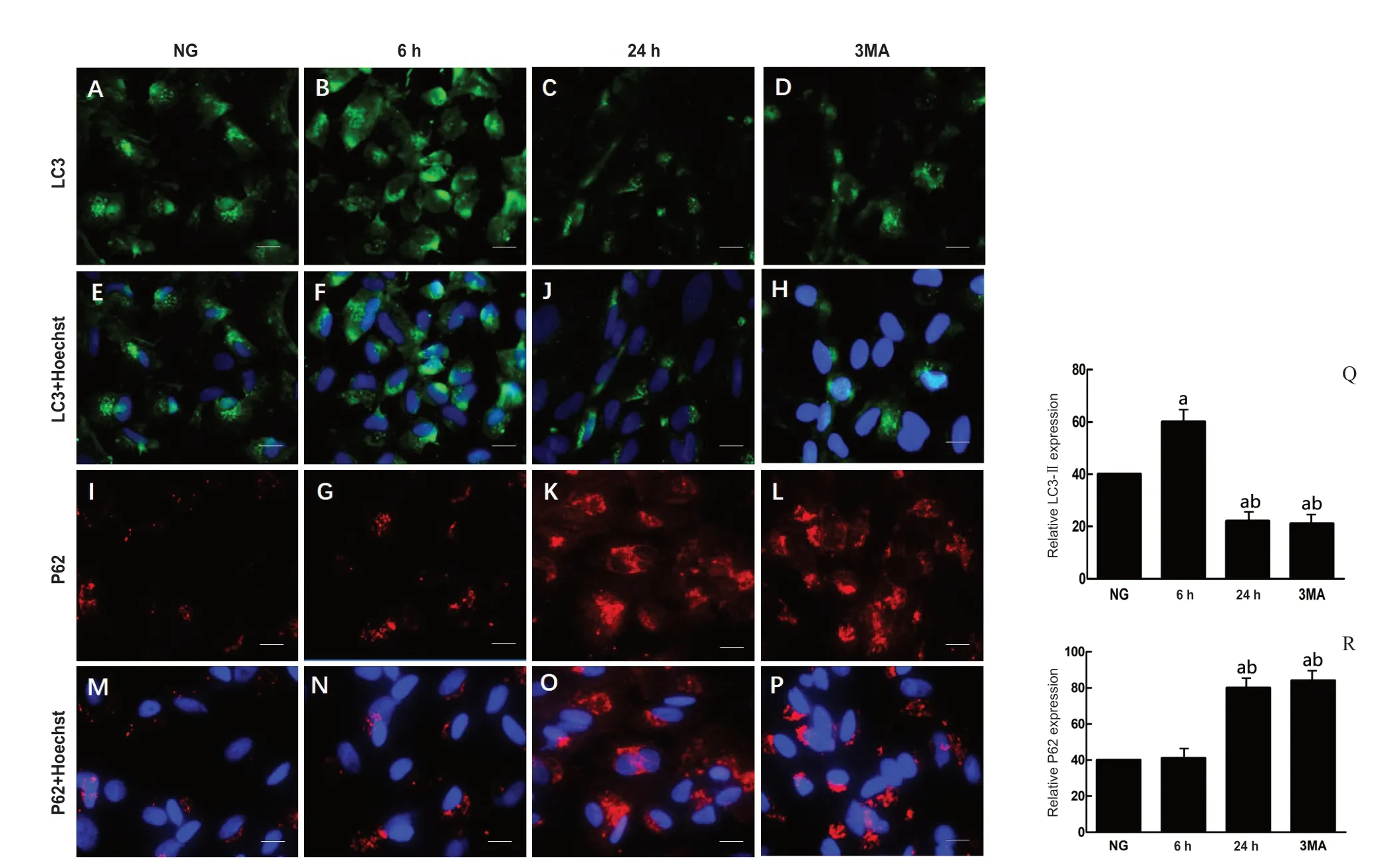
图3.不同时间高糖培养对视网膜Müller细胞LC3-和P62的表达及细胞定位A─D:绿色通道表示LC3-Ⅱ蛋白表达;E─H:除了绿色通道的LC3-Ⅱ,蓝色通道代表细胞核位置;I─L红色通道表示P62蛋白表达;M─P中除了红色通道的P62,蓝色通道代表细胞核位置;Q和R:正常组及6 h、24 h高糖组LC3-Ⅱ和P62在细胞质的表达总体差异有统计学意义。标尺为20 μm。a,与正常组比较,P<0.01,b,与6 h高糖组比较,P<0.01Figure 3.A representative photomicrograph of LC3 and P62 immunofluorescence in Müller cells cultured for different time points in HG.A─D:Nuclear staining with LC3 (green).E─H:Hoechst (blue) are shown in addition to the green channel (LC3-Ⅱ).I─L:P62 (red).M─P:Hoechst (blue)are shown in addition to the red channel (P62).Q and R:The overall comparison of LC3-Ⅱ and P62 expression in cytoplasm of the normal group,6 h and 24 h groups showed statistically significant differences.Scale bars:20 μm.a,compared to NG,P<0.01;b,compared to HG (6 h),P<0.01.HG,high glucose group;NG,normal group.
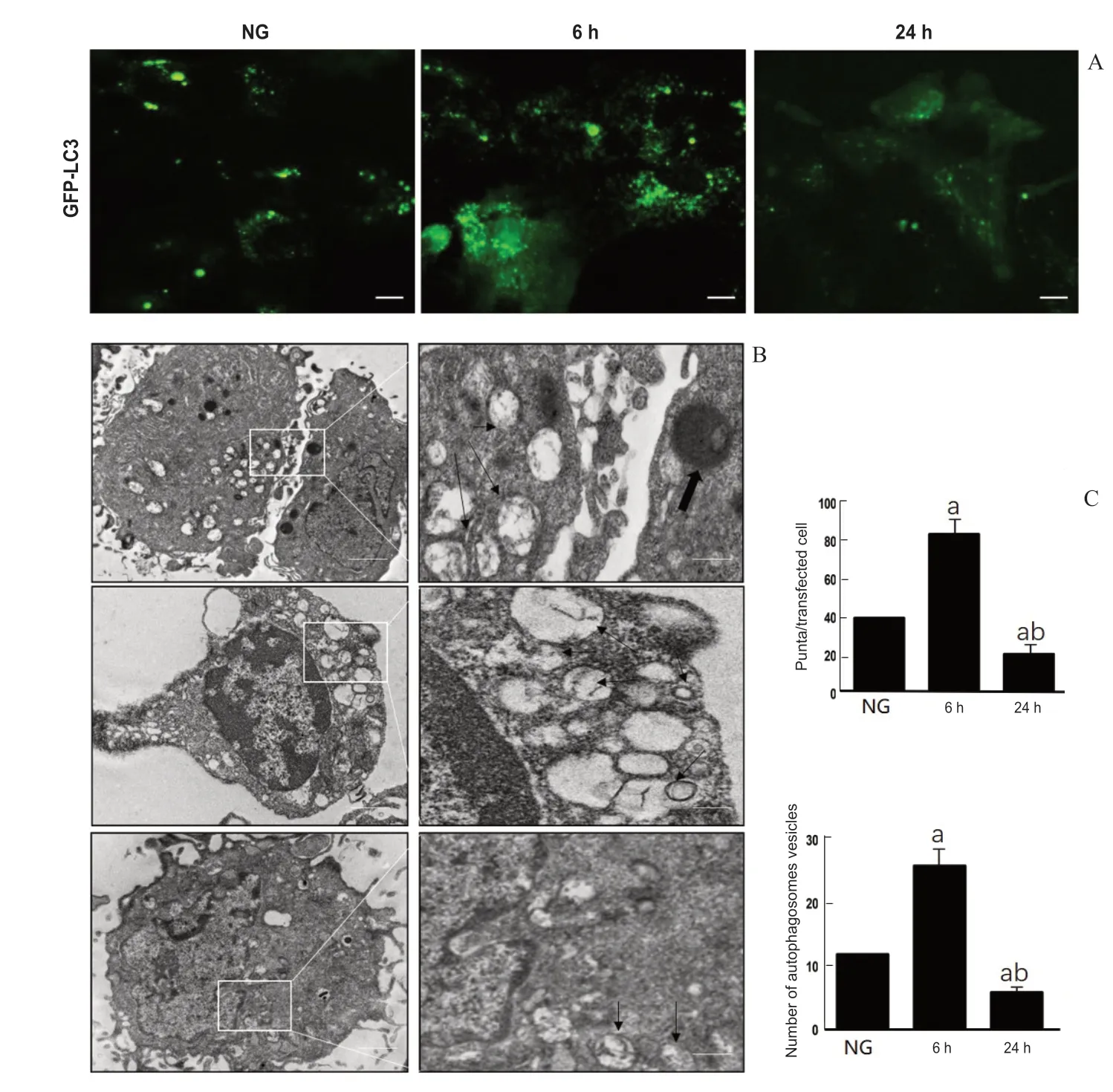
图4.高糖对视网膜Müller细胞自噬小体形成的影响A:绿色通道表示GFP-LC3转染阳性颗粒(自噬小体),标尺为20 μm;B:透射电镜显示自噬小体(黑色小箭头)及溶酶体(黑色粗箭头),标尺为1 μm;C:正常组及6 h、24 h高糖组视网膜Müller细胞中GFP-LC3转染阳性颗粒、自噬小体相对数量组间比较差异有统计学意义。a,与正常组比较,P<0.01;b,与6 h高糖组比较,P<0.01Figure 4.Effects of high glucose on autophagosome formation in retinal Müller cells.A:A representative image and quantification of GFP-LC3 puncta in transfected Müller cells.Scale bars:20 μm.B:Electron micrograph images of the Müller cells.AP (fine arrow) and electron-dense APL (coarse arrow).Scale bars:1 μm.C:The comparison of the number of GFP-LC3 puncta transfected positive particles,and autophagosomes in transfected Müller cells in cytoplasm of the normal group,6 h and 24 h groups showed statistically significant differences.a,compared to NG,P<0.01;b,compared to HG (6 h),P<0.01.AP,autophagosomes;APL,autophagosomes lysosome;HG,high glucose group;NG,normal group.
3 讨论
DR是糖尿病微血管和神经并发症,根据视网膜微血管病变和缺血程度分为非增殖期糖尿病视网膜病变(Non-proliferative diabetic retinopathy,NPDR)和增殖期糖尿病视网膜病变(Proliferative diabetic retinopathy,PDR),可伴有糖尿病黄斑水肿(Diabetic macular edema,DME)[11]。自噬与全身多个系统的疾病都有密切联系,且与氧化应激关系密切[12],然而氧化应激是DR的重要发病机制,其病理机制还包括内质网应激、硝基化应激、基质金属蛋白酶(Matrix metalloproteinase,MMP)升高、晚期糖基化终产物(Advanced glycation endproducts,AGEs)堆积、蛋白激酶C激活和多元醇通路激活等[13-14],我们推测自噬异常可能是导致高糖环境下视网膜Müller细胞功能改变的一个重要因素。目前已经在体内实验[15]及体外实验(高糖培养的视网膜微血管内皮细胞、周细胞、神经节细胞、视网膜色素上皮细胞[16-20])中观察到自噬被激活,有趣的是,也有部分研究显示高糖条件下,自噬上游信号被激活而下游蛋白活性被抑制[21],甚至发现自噬水平未见变化[22]的情况。所以自噬是一个极其复杂的过程,任何条件发生变化都将导致不同的自噬改变,目前研究较多的氧化应激可造成自噬功能受损,而自噬可以通过清除氧化损伤的蛋白质、脂质和细胞器等抑制氧化应激反应[23],由此可见,在与氧化应激密切相关的DR发病过程中,Müller细胞自噬功能异常可能是其重要启动因素。
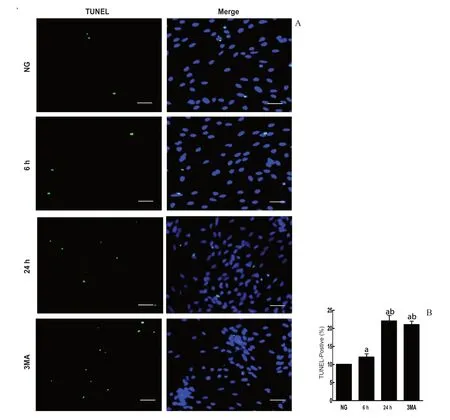
图5.TUNEL 染色分析正常组、6 h高糖组、24 h高糖组、3MA组凋亡细胞数量A:绿色荧光为TUNEL阳性细胞,DAPI染色为细胞核,标尺为20 μm;B:各组视网膜Müller细胞凋亡指数总体比较差异有统计学意义。a,与正常组比较,P<0.01;b,与6 h高糖组比较,P<0.01Figure 5.TUNEL staining analysis of the number of apoptotic cells in NG,6 h HG,24 h HG and 3MA.A:The positive cells are shown in green,and Hoechst for nuclear staining is shown in blue.Scale bars:20 μm.B:The bars represent the mean±SD of positive cells corrected by the number of total cells.a,compared to NG,P<0.01;b,compared to HG,P<0.01.NG,normal group;HG,high glucose group.
自噬是DR的研究热点,目前已经在多种细胞模型中观察到自噬水平改变。在本研究中我们发现,高糖刺激视网膜Müller细胞早期,可造成Müller细胞自噬增加,自噬相关蛋白(LC3Ⅱ/LC3Ⅰ比值、Beclin-1)增加,自噬小体形成增多,Müller细胞中自噬反应被激活,增强Müller细胞对代谢底物或者受损细胞器的消化处理能力,底物标志蛋白P62在高糖处理早期未见明显异常,随着高糖培养时间不断增加,自噬水平出现下降,P62 堆积,代谢底物增多,故早期高糖刺激Müller细胞自噬激活,对维持细胞正常生理活性起到重要作用。我们推测,在高糖刺激视网膜Müller细胞早期,自噬被激活,代谢底物未出现明显增加,但是随着时间的不断延长,自噬水平下降,自噬出现抑制现象,进而造成代谢底物堆积,视网膜Müller细胞自噬功能出现异常。
细胞自噬既是一种广泛存在的正常生理过程,又是细胞对不良环境的一种防御机制[24],但是自噬也犹如双刃剑,自噬在DR(尤其是糖尿病视神经退行性疾病)中到底扮演着怎样的角色仍未明确定论。研究发现,糖尿病大鼠的坐骨神经轴突横断面和背根神经节的感觉神经元[25]均可发生自噬的异常。同样,在胰岛素导致的低血糖模型大鼠中,早期病变和晚期的再生轴突中均出现了明显的自噬相关结构的改变[26]。因此,自噬是参与血糖改变引起的神经病变发生发展过程中的一个重要环节,糖尿病引起的神经病变多伴随一系列的自噬调节失衡现象。近年来,随着人们对自噬功能的不断认识和研究发现[27],高糖环境下培养Müller细胞,随着高糖的不断刺激,虽然Müller细胞自噬被激活,但是自噬功能紊乱,错误折叠蛋白逐渐增多,最终造成Müller细胞体损伤,同时检测培养液中各种生长因子(如VEGF)含量明显增高,Müller细胞过度胶质增生,这提示高糖可通过刺激Müller细胞自噬功能发生紊乱,继而破坏Müller细胞活性,最终导致DR的进一步发展。还有一些研究也显示[28],在糖尿病动物模型中,活性氧增多,氧化应激反应增强,非折叠蛋白质增多造成内质网压力增大,从而导致自噬机制紊乱,在糖尿病大鼠视网膜中也发现了内质网压力标记蛋白(如自噬转录因子同源蛋白、磷酸-eif2a)改变。由此可见因糖尿病引起的神经病变多伴随一系列的自噬调节失衡现象,因此,自噬可能是参与血糖改变引起的视网膜病变的发生发展过程中的一个重要环节。
自噬与凋亡共同维持细胞内环境稳态,既往研究发现,抗凋亡蛋白Bcl-2和自噬蛋白Beclin-1之间的相互作用可能是调节自噬和凋亡之间转换的重要机制[29]。某些细胞在应激条件下,细胞启动细胞自噬通路,刺激活跃的自噬反应发生,代偿性处理凋亡状态的细胞,以帮助细胞中各种功能正常运行[30]。而另一方面,如果细胞自噬通路出现障碍将导致错误折叠蛋白堆积,细胞反应效率和功能受损,生命活动失衡后启动凋亡通路[31]。为了进一步验证高糖培养的Müller中自噬改变对Müller细胞凋亡的影响,我们检测了Müller细胞的凋亡水平,结果发现在高糖早期,自噬状态增强,但是细胞凋亡水平较低,高糖培养晚期,自噬水平下降,自噬功能异常,凋亡细胞百分比明显提高,这充分说明,激活自噬可以改善由高糖刺激的Müller细胞的凋亡水平,对细胞具有保护作用,反之,抑制视网膜Müller细胞自噬反应可增加细胞凋亡。
综上所述,本研究显示在DR早期可能诱导自噬激活,降低视网膜Müller细胞凋亡,但是随着时间不断延长,自噬功能被抑制,底物堆积,凋亡水平增加,这可能是高糖对视网膜Müller细胞损伤的一种致病机制,所以对DR的防治一定要在早期予以控制,尽可能减少高糖对视网膜的损伤。本研究数据在细胞水平上对DR的发病机制提供了较好的理论支持,但是DR的病理机制复杂,后续详尽的动物实验仍有待进一步研究。

