长链非编码RNA M 通过作为miRNA-1的中心诱导血管平滑肌细胞增殖和迁移①
艾文伟 张 明 胡 杰 章志玲 邬 甦(江西省人民医院,南昌 330006)
血管平滑肌细胞(vascular smooth muscle cell,VSMC)是血管膜的唯一细胞成分,处于血管中层,能够调节血管张力以及维持血管功能[1-2]。随着人们生活习惯的改变,动脉粥样硬化等内膜增厚性疾病的发病率呈现逐渐上升的趋势,其主要病理因素是VSMC 的异常增殖及迁移,因而研究VSMC 异常增殖及迁移有关的分子机制是治疗心血管等疾病的重要途径[3-5]。LncRNA 除了能够作为基因组中的一种调控分子,还可以作为竞争性内源RNA与miRNA结合进行调控表达[6-7],而微小RNA是一类较小的内源性非编码单链RNA,能够调控各种病理有关的基因表达,包括细胞增殖、迁移或分化等过程[8-9]。但是目前对LncRNA 竞争性结合miRNA 调控细胞内有关因子的研究还不多,因而对这一机制进行研究,探讨其对VSMC细胞增殖及迁移的影响。
1 材料与方法
1.1 材料 VSMC(上海赛百慷生物技术股份有限公司);胎牛血清、DMEM 培养液、0.25%胰蛋白酶(成都西亚化工股份有限公司);MTT 检测试剂盒(上海酶联生物);Transwell 小室(北京萌壮科技有限公司);pmirGLO 载体(北京华越洋生物);Lipo⁃fectamineTM2000(北京科展生物科技有限公司);逆转录试剂盒、RT-PCR 试剂盒、RT-PCR 引物(北京厚生博泰科技有限公司);PDGF-BB(上海经科化学科技有限公司)。
1.2 方法
1.2.1 细胞培养 将VSMC 在含有10%胎牛血清的DMEM 培养液中进行培养,在37℃、5%CO2条件下培养,放置于恒温培养箱中,2 d 换1 次培养液,3~5 d 时使用0.25%的胰酶进行消化传代,当细胞培养至3~5代并且处于对数生长期时收集以进行后续实验。
1.2.2 细胞转染 将培养的VSMC 细胞分为:空白对照组(VSMC 细胞株)、转染有LncRNA M 的VSMC细胞组(si-VSMCM)和阴性对照细胞组(si-VSMCM-NC),当细胞生长至融合度为70%~80%时,将其接种到细胞瓶中,按照LipofectamineTM2000 试剂说明书进行转染,构建LncRNA M 的野生型及突变型质粒,使其与miRNA-1 共同转染VSMC 细胞,将其分组为mi-RNA-1 NC+WT-M;miRNA-1 mimic+WT-M;miRNA-1 inhibitor+WT-M;miRNA-1 NC+MUT-M;miRNA-1 mimic+MUT-M;miRNA-1 inhibitor+MUT-M。转染2 d 后,将细胞培养液倒掉,使用PBS清洗细胞,使用20 μl细胞裂解液将细胞裂解。
1.2.3 生物信息学预测LncRNA 竞争性结合的miRNA 通过生物信息学数据库Starbase 预测Lnc-RNA M和miRNA-1之间是否存在结合关系。
1.2.4 双荧光素酶报告基因检测 根据双荧光素酶报告基因检测试剂盒的有关说明,通过Dual-Luciferase 报告基因检测系统来检测有关的荧光素酶活性。
1.2.5 RT-PCR 检测LncRNA M 和miRNA-1的表达情况 按照试剂盒说明书使用Trizol 法提取细胞总RNA,将其进行纯化定量,后按照逆转录试剂盒说明书的指示合成cDNA,再按照RT-PCR 试剂盒的步骤进行LncRNA M 和miRNA-1 表达情况的检测,取U6为miRNA-1内参,18S为LncRNA M 内参,并使用2-ΔΔCt公式分析其表达情况,引物序列如下:miRNA-1 F:5′-TACACCATGGCAACGTAGAAT-3′,R:5′-AT⁃GTGGTACCGTCGCATCTTA-3′;U6 F:5'-GCTTCG⁃GCAGCACATATACTAAAA-3',R:5'-CGCTTCACGAATTTGGGTGTCAT-3';LncRNA M F:5'-AAGAAAACCCGAAGAGGCC-3',R:5'-GTGGGGCGCCCCAGGCACCA-3';18S F:5'-GGCCTCCAAGGAGTAAGAAA-3',R:5'-GCCCCTCCTGTTATTATGG-3'。
1.2.6 流式细胞仪对VSMC 的细胞周期进行检测 将各组细胞使用0.25%的胰酶进行消化,离心后收集,PBS洗涤3次后重悬,保持密度在1×106个/ml,与无水乙醇混合后在4℃、避光条件下固定过夜,然后洗去乙醇,加入PI染液,于常温下避光反应30 min,使用流式细胞仪检测488 nm处的荧光强度。
1.2.7 MTT 实验检测VSMC 细胞的增殖情况 从有关文献中选择VSMC 细胞增殖相关基因iNOS 来进行其增殖及迁移活性的有关检测[10]。将转染的各组VSMC 细胞接种至96 孔板中,贴壁后进行收集,时间点分别是0 h、24 h、48 h、72 h,严格按照MTT 试剂盒说明书进行操作,并通过酶标仪检测A490值。
1.2.8 Transwell 检测VSMC 细胞的迁移情况 将各组细胞使用培养基重悬,调整密度至2×105个/ml,接种至Transwell 小室的上室,在下室加入培养基,然后在培养箱中培养1 d,培养后将细胞用PBS冲洗3 次,擦净上室表面,90%无水乙醇中固定后使用结晶紫染色,显微镜下观察细胞个数(1 个小室5 个视野)。
1.3 统计学分析 采用SPSS24.0对数据进行统计分析,数据资料通过表示,各组间采用单因素方差分析,使用t检验。
2 结果
2.1 miRNA-1 能够靶向调控LncRNA M 的表达为了对miRNA-1与LncRNA M之间的关系进行验证,采用双荧光素酶报告基因实验来进行检测。如图1所示,与空白对照组相比,miRNA-1 mimic+WT-M 组的双荧光素酶活性明显降低(P<0.05),miRNA-1 inhibitor+WT-M 组的双荧光素酶活性明显升高(P<0.05),而对于Lnc-RNA M 的突变型来说,各组之间无显著性差异。可以发现在VSMC 细胞中,过表达miRNA-1 可以有效提高LncRNA M 有关的双荧光素酶活性,提示LncRNA M 可能是miRNA-1 的一个靶向调控基因,miRNA-1 能够和LncRNA M 结合调控其在VSMC中的表达。
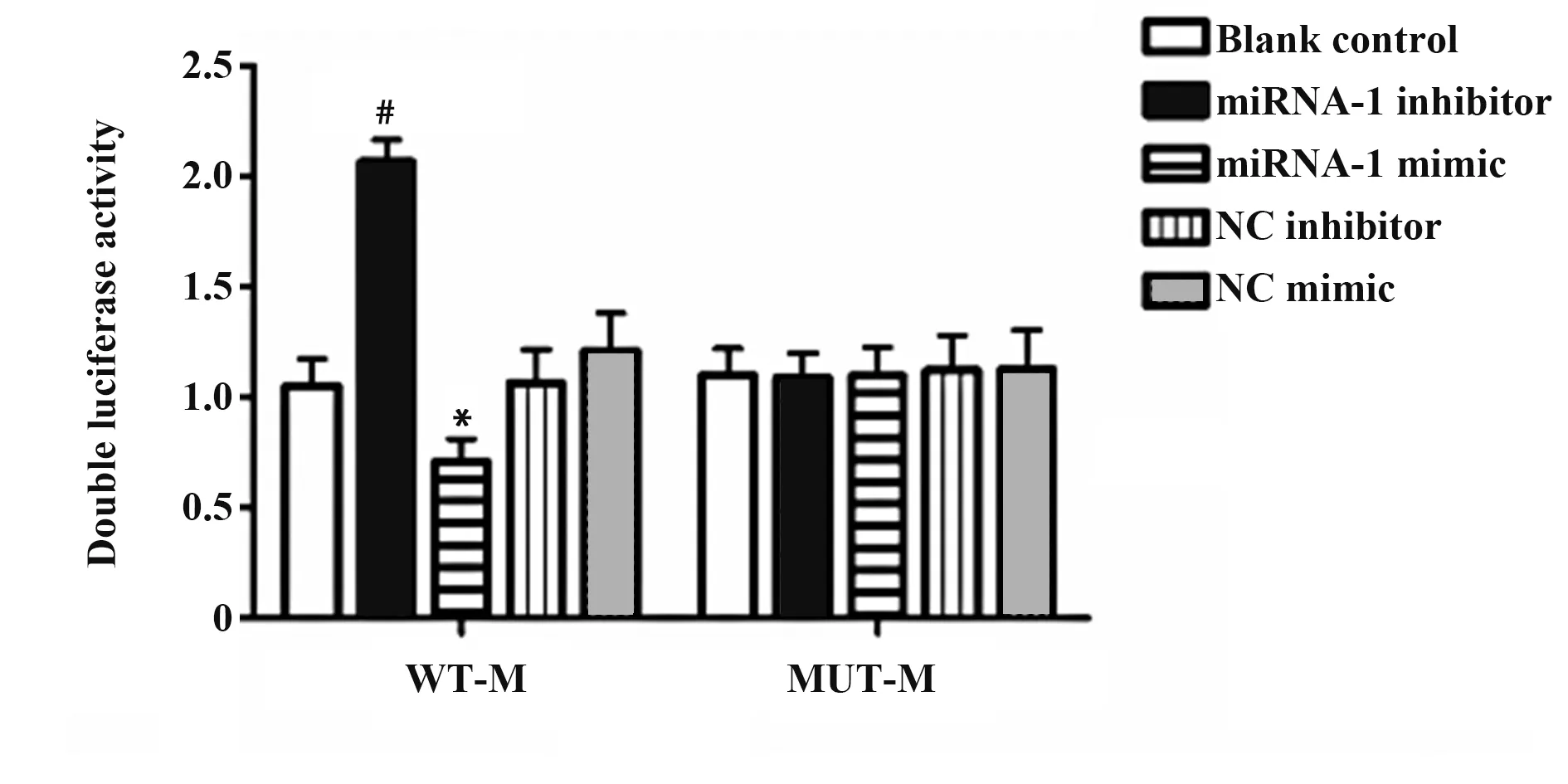
图1 各组间双荧光素酶活性的对比Fig.1 Comparison of double luciferase activity among groups
2.2 敲低LncRNA M 可能上调miRNA-1 诱导VSMC增殖 为了进一步研究LncRNA M与miRNA-1之间的调控关系在VSMC 增殖中的作用,在VSMC细胞中使用shRNA 技术来敲低LncRNA M,然后对其表达及细胞增殖能力进行检测。如图2 所示,与LncRNA M 敲低前相比,VSMC 细胞的G0/G1 期细胞比例由(76.32±2.61)%下降到(53.42±2.13)%(P<0.05),S 期细胞比例由(21.34±1.49)%上升 到(36.64±2.56)%(P<0.05),表明敲低LncRNA M 可显著促进VSMC的增殖;使用RT-PCR检测LncRNA M与miRNA-1 之间的调控关系,如表1 所示,与Lnc-RNA M 敲低前相比,LncRNA M 敲低后的VSMC 细胞中LncRNA M的表达明显降低(P<0.05),miRNA-1的表达明显升高(P<0.05),通过Pearson 相关性分析得知VSMC 细胞中的LncRNA M 与miRNA-1 的表达之间呈负相关(r=-0.412,P<0.05),也证明敲低LncRNA M 可能通过上调miRNA-1 的表达来促进VSMC细胞的增殖。
表1 LncRNA M敲低前后VSMC中LncRNA M和miRNA-1的表达情况(,n=20)Tab.1 LncRNA M and miRNA-1 in VSMC before and after lncRNA M knockdown(,n=20)
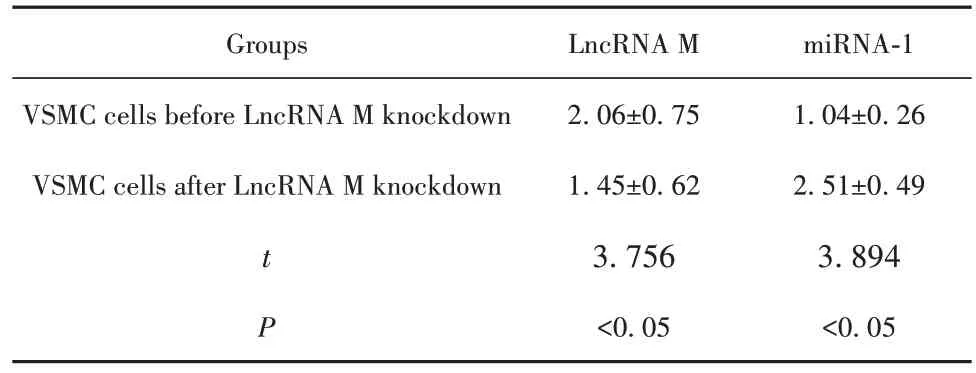
表1 LncRNA M敲低前后VSMC中LncRNA M和miRNA-1的表达情况(,n=20)Tab.1 LncRNA M and miRNA-1 in VSMC before and after lncRNA M knockdown(,n=20)
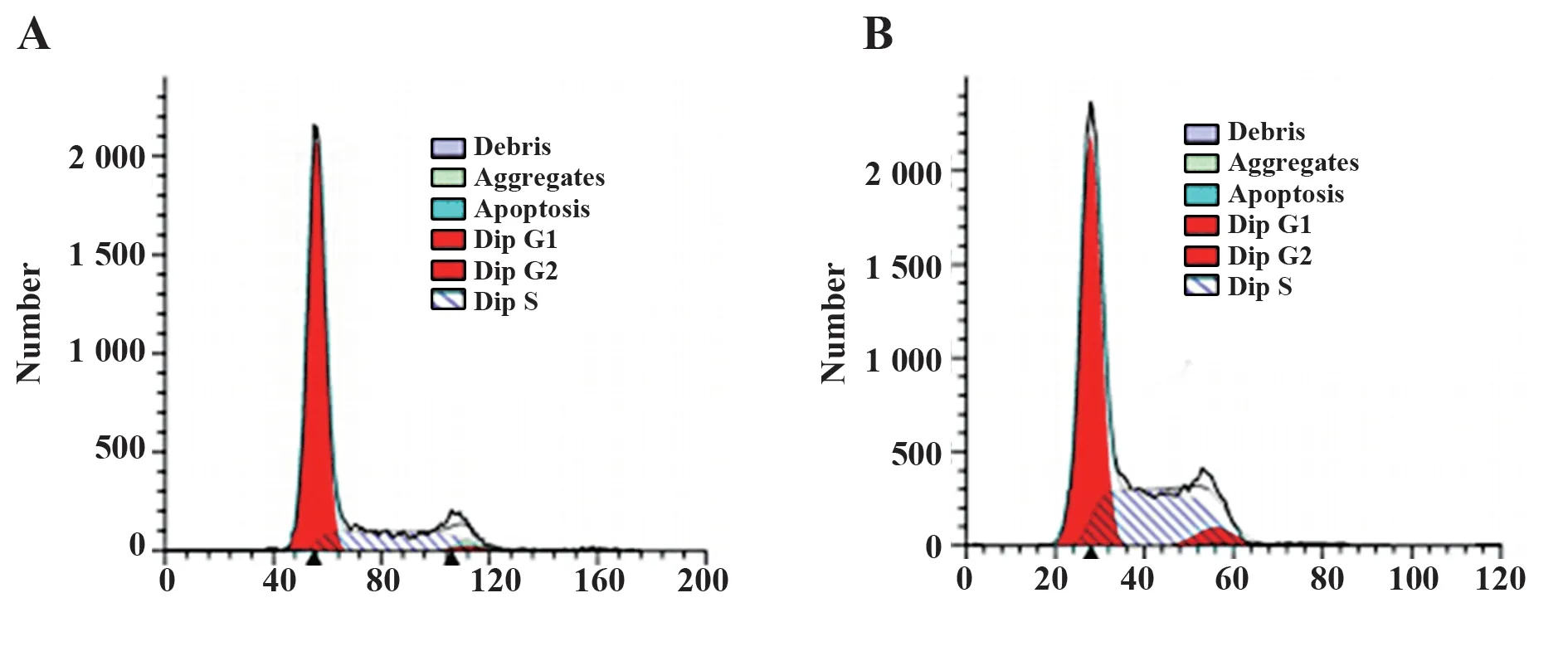
图2 LncRNA M 敲低前后VSMC的增殖情况Fig.2 Proliferation of VSMC before and after lncRNA M knockdown
2.3 LncRNA M 通过 结合miRNA-1 促进VSMC 细胞的增殖 MTT结果显示,与对照组相比,miRNA-1 mimics 组、miRNA-1 mimics+pmirGLO 组的细胞活力明显上升(P<0.05),继续过表达LncRNA M后,与对照组及miRNA-1 mimics 组相比,其细胞活力明显下降(P<0.05);并且其细胞基因iNOS及其对应mRNA也有这样的趋势。说明过表达LncRNA M 可能抑制VSMC细胞的增殖,miRNA-1可能促进VSMC细胞的增殖,并且LncRNA M 通过结合miRNA-1 可能上调miRNA-1 的表达来促进VSMC 细胞的增殖。如图3所示。
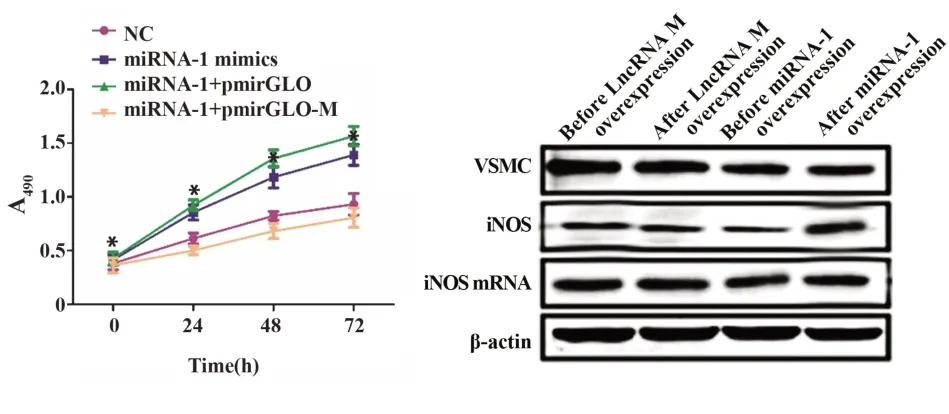
图3 不同条件下VSMC中有关基因及因子的增殖情况Fig.3 Proliferation of related genes and factors in VSMC under different conditions
2.4 LncRNA M 通过 结合miRNA-1 促进VSMC 细胞的迁移 Transwell 对各组的迁移能力进行检测,与对照组相比,miRNA-1 mimics组、miRNA-1 mimics+pmirGLO 组的细胞迁移率明显上升(P<0.05),继续过表达LncRNA M 后,与对照组及miRNA-1 mimics组相比,其细胞迁移率明显下降(P<0.05),并且VSMC 细胞基因iNOS 及其对应mRNA 也有相同的趋势。如图4、5所示。
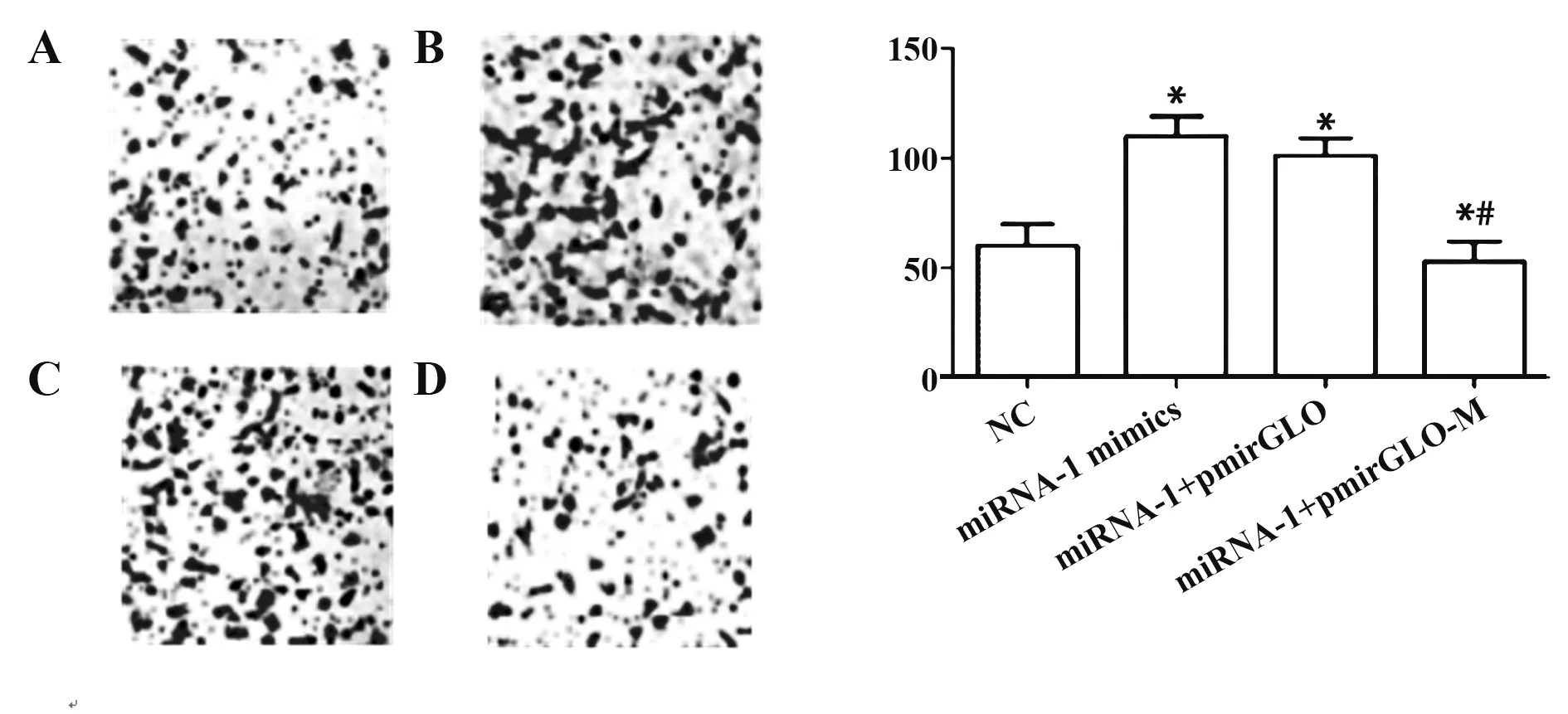
图4 LncRNA M 通过结合miRNA-1促进VSMC的迁移Fig.4 LncRNA M promotes migration of VSMC by bind⁃ing miRNA-1

图5 不同条件下VSMC中有关基因及其mRNA的迁移情况Fig.5 Migration of related genes and their mRNA in VSMC under different conditions migration situation
3 讨论
作为血管壁的主要成分,VSMC 的增殖、迁移等和血管重塑性疾病紧密相连,更是血管重塑性疾病的病理基础,在主动脉粥样硬化疾病发生发展的过程中具有重要作用[11-13]。目前已有多项研究证明miRNA 和LncRNA 在血管平滑肌细胞的增殖和迁移中发挥着不可代替的作用。
miRNA 是一种由约22 nt 组成的内源性非编码微小RNA,它可以促进mRNA 的转录,也可以在转录后的水平上抑制翻译来调控多个靶基因的表达,在各生物体的生长发育中发挥着重要的调控作用,尤其是在增殖性疾病方面[14-16]。如吴翔等[17]在了解miRNA 及Wnt/β-catenin 信号通路的基础上,通过RT-PCR、Western blot 检测转染大鼠中有关核酸的表达,以及相关性分析得出抑制miRNA-21 时会降低抑制剂的表达,增强其他核酸的表达,因而通过调控DKK1 及Wnt/β-catenin 信号通路可以对miRNA-21 的表达进行早期干预以此来促进血管平滑肌的增殖,从而有可能成为检测PH 的新靶点。又如杨云山[18]将SD 级大鼠的VAMC 细胞作为研究对象,将其转染miRNA-146a,通过对其增殖及凋亡的检测得到上调miRNA-146a 可通过增高κBp65、PCNA 的表达水平来增殖核抗原表达,从而使血管平滑肌细胞增殖和迁移。而LncRNA 是一类长度超200 nt的非编码RNA,它可以在血管损伤、血管重塑的病理过程中参与对血管平滑肌细胞功能和表型的调节[19-20]。王峥等[21]在明确高血糖是引起VSMC过度增殖因素的基础上提出研究相关机制这一论点,通过对小鼠进行分组、转染实现lncRNA-MIAT和miRNA-145 的过表达和沉默,进而通过CellTiter-Blue 实验、RT-qPCR 以及双荧光素酶报告基因实验来检测细胞活力,lncRNA-MIAT 和miRNA-145 的表达水平、靶向调控关系,从而得出高糖培养对VSMC中lncRNA-MIAT 表达具有上调作用,对miR-145 表达具有下调作用,并且lncRNA-MIAT 和miR-145 能够进行互补结合,得出lncRNA-MIAT 可能通过抑制miR-145从而参与高糖引起的VSMC活力异常。
为了探讨LncRNA M 竞争性结合miRNA-1 对VSMC 增殖的影响,本研究选用VSMC 分组进行实验,进行生物信息学得到可以与LncRNA M 结合的miRNA 后,进行双荧光素酶报告基因检测,报告检测结果显示,与空白对照组及miRNA-1 NC+WT-M组相比,miRNA-1 mimic+WT-M 组的双荧光素酶活性明显降低(P<0.05),miRNA-1 inhibitor+WT-M 组的双荧光素酶活性明显升高(P<0.05),而对于Lnc-RNA M 的突变型来说,各组之间无显著性差异。提示LncRNA M 可以与miRNA-1 结合来调控其在VSMC 中的表达;使用RT-PCR 和流式细胞仪来对细胞中LncRNA M 敲低前后LncRNA M 和miRNA-1 的表达进行检测,通过Pearson 相关性分析得知VSMC细胞中的LncRNA M 与miRNA-1的表达之间呈负相关,证明敲低LncRNA M可能通过上调miRNA-1的表达来促进VSMC细胞的增殖;又为了证明Lnc-RNA M通过结合miRNA-1 可以促进VSMC 的增殖和迁移,使用MTT 实验和Transwell 实验来对细胞的增殖和迁移变化进行检测,并对细胞中的iNOS基因进行检测,与对照组相比,miRNA-1 转染组的iNOS 基因的表达、细胞活力及迁移率都有所上升(P<0.05),在miRNA-1 的基础上继续转染LncRNA M 后,发现与其他组别相比,其iNOS 基因的表达、细胞活力及迁移率又有所下降(P<0.05),提示LncRNA M 可以通过结合miRNA-1使其表达上升进而促进VSMC的增殖和迁移。
综上所述,LncRNA M 可能通过作为miRNA-1的中心诱导VSMC 的增殖和迁移,其机制是敲低LncRNA M 可能上调miRNA-1 的表达来促进VSMC的增殖和迁移,对心脑血管疾病的防治具有重要的病理学意义。

