血清TK1 和sCD30 水平与T 细胞淋巴瘤患者临床特征的相关性
王欣,梁艳丽,李艳秋
T 细胞非霍奇金淋巴瘤(T-non-Hodgkinlymphoma,T-NHL)是血液科常见恶性肿瘤,病因复杂,多认为与感染、遗传、免疫功能异常等因素有关,且流行病学调查显示,T-NHL 发病率逐年增高[1]。目前,全身化疗是T-NHL 主要治疗手段,可延长患者生存时间,但相关研究显示,肿瘤临床分期、免疫学等多种因素与患者预后有关[2]。因此,明确T-NHL患者临床特征,对指导个体化治疗意义重大。胸苷激酶1(thymidine kinase 1,TK1)是一种细胞周期相关酶,主要表达于分裂细胞胞质中,当正常细胞组织增殖或恶变时,TK1 会被大量释放入血,导致血清TK1 水平升高[3]。有研究显示,TK1 在胃癌、肺癌等多种恶性肿瘤中均有重要作用,且可结合其他肿瘤标志物评估患者预后[4]。可溶性CD30(sCD30)是重要免疫活性指标,可反映机体免疫情况,相关研究表明,sCD30 过表达可能是T-NHL 发生的危险因素[5]。结合上述研究猜测,TK1 和sCD30 可能与T-NHL 患者临床特征存在一定关系。本研究通过观察T-NHL 患者血清TK1 和sCD30 表达情况,分析血清TK1 和sCD30 表达与T-NHL 患者临床特征的关系,以指导未来对疾病的早期合理干预。
1 资料与方法
1.1 一般资料
收集遂宁市中心医院2016 年9 月至2019 年10 月收治的32 例T-NHL 患者资料进行回顾性分析。 32 例患者中男17 例,女15 例;年龄(61.65±3.68)岁,范围44~78 岁;体质量指数(body mass index,BMI)为21.13±1.34,范围17.3~24.8。本研究的实施经过遂宁市中心医院医学伦理委员会批准。
1.2 入选标准
(1)纳入标准:①T-NHL 符合《内科学(第8版)》[6]中疾病相关诊断标准,且经穿刺活检或手术病理检查确诊;②均为初次检查发现;③影像学检查、病理检查、实验室检查等资料均完整。(2)排除标准:①合并其他恶性肿瘤;②哺乳或妊娠期患者;③合并免疫系统疾病。
1.3 方法
1.3.1 临床特征判断 收集所有T-NHL 患者穿刺活检或手术病理检查结果和病例资料等,观察患者临床特征,包括:临床分期(参照Ann Arbor 分期标准[7]评估,Ⅰ期:肿瘤侵犯单个淋巴结区域或侵犯单个结节外部位;Ⅱ期肿瘤侵犯≥2 个淋巴结区域,但侵犯部位均在膈肌同侧,或同侧存在局限性结外侵犯;Ⅲ期:肿瘤侵犯膈肌上下淋巴结,同时存在局限性结外侵犯或侵犯脾脏;Ⅳ期:肿瘤侵犯淋巴结、脾脏、咽淋巴环,同时侵犯一个或多个结外器官,伴有或不伴有淋巴结肿大表现)、淋巴结外浸润(经增强CT 或PET-CT 检查得知,肿瘤细胞侵袭至淋巴结外器官或组织)、全身症状[存在发热(不明原因体温≥38℃)、消瘦(6 个月内体重不明原因降低≥10%)、盗汗(入睡后汗出异常,醒后汗泄)等]。
1.3.2 血清TK1 和sCD30 水平检测 采集TNHL 患者入院时清晨空腹肘部静脉血5 ml,置于4℃冰箱内静置1 h 后,采用全自动低速离心机(上海卢湘仪离心机仪器有限公司,型号:TD5M)以3 000 r/min 转速离心10 min(离心半径8 cm),取上层血清待检;采用免疫增强化学发光法检测血清TK1 水平,采用酶联免疫吸附试验法检测血清sCD30 水平,检测试剂盒均购自上海江莱生物科技有限公司,检验流程严格按照试剂盒说明书进行。
1.4 统计学处理
采用SPSS 23.0 软件进行数据处理,全部计量资料均经Shapiro-Wilk 正态性检验,符合正态分布的计量资料采用均数±标准差(±s)表示,不同临床分期、淋巴结外浸润、全身症状T-NHL 患者血清TK1 和sCD30 水平比较采用独立样本t检验;不同T 细胞淋巴瘤病种分类T-NHL 患者血清TK1 和sCD30 水平比较采用单因素方差分析检验;经单项Logistic 回归分析,并建立Logistic 多元回归模型,分析血清TK1 和sCD30 水平对T-NHL 患者临床分期的影响;绘制受试者工作曲线(ROC),并计算曲线下面积(AUC),以检验血清TK1 和sCD30 水平预测临床高分期风险的价值,AUC 值>0.9 表示预测性能较高,0.70~0.90 表示有一定预测性能,0.50~0.70 表示预测性能较差。P<0.05 表示差异有统计学意义。
2 结果
2.1 临床特征情况
32 例T-NHL 患者中临床分期Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期分别为4 例、2 例、16 例、10 例,淋巴结外浸润11 例(其中Ⅲ期5 例,Ⅳ期6 例),伴有全身症状22 例(其中Ⅲ期9 例,Ⅳ期13 例),T 细胞淋巴瘤包括血管免疫母T 细胞淋巴瘤8 例(Ⅰ期4 例,Ⅱ期2 例,Ⅲ期2 例),外周T 细胞淋巴瘤,非特指16 例(Ⅲ期10 例,Ⅳ期6 例),间变性淋巴瘤激酶(ALK)阳性间变T 细胞淋巴瘤1 例(Ⅲ期1 例),ALK 阴性间变T 细胞淋巴瘤2 例(Ⅲ期2 例),NK/T 细胞淋巴瘤5 例(Ⅲ期1 例,Ⅳ期4 例)。见表1。
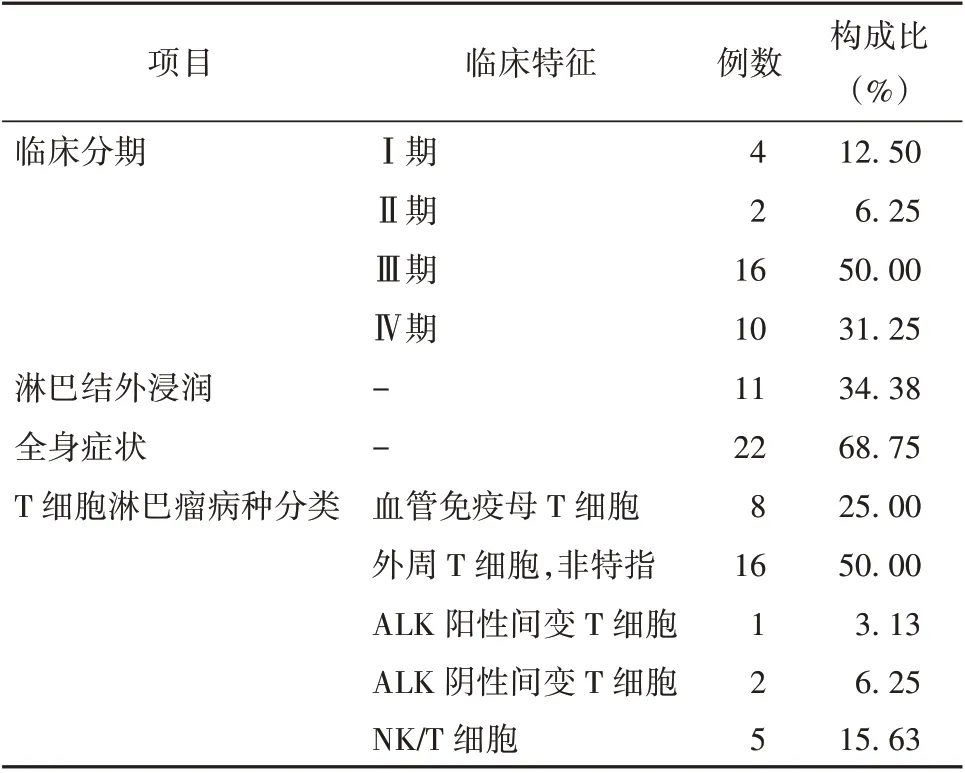
表1 32 例T-NHL 患者临床特征情况
2.2 不同临床特征T-NHL 患者血清TK1 和sCD30 水平比较
有淋巴结外浸润、全身症状、不同病理类型T细胞淋巴瘤患者血清TK1 和sCD30 水平比较差异无统计学意义(P>0.05);Ⅲ/Ⅳ期患者血清TK1 和sCD30 水平均高于Ⅰ/Ⅱ期患者,差异有统计学意义(P<0.05)。见表2、3。
表2 不同临床特征T-NHL 患者血清TK1 水平比较(pmol/L,± s)

表2 不同临床特征T-NHL 患者血清TK1 水平比较(pmol/L,± s)
注:T-NHL 为T 细胞非霍奇金淋巴瘤,TK1 为胸苷激酶1,ALK 为间变性淋巴瘤激酶,NK/T 细胞为自然杀伤细胞/T 淋巴细胞
项目临床分期临床特征Ⅰ/Ⅱ期Ⅲ/Ⅳ期t/F 值3.869 P 值0.001淋巴结外浸润1.986 0.056全身症状有无有无1.309 0.201 T 细胞淋巴瘤病种分类血管免疫母T 细胞外周T 细胞,非特指ALK 阳性、阴性间变T 细胞NK/T 细胞例数6 26 11 21 22 10 8 16 0.014 0.998 3 5 TK1 1.33±0.68 2.56±0.71 2.67±0.73 2.15±0.69 2.44±0.73 2.08±0.70 1.24±0.65 1.28±0.64 1.25±0.67 1.22±0.68
2.3 血清TK1 和sCD30 表达对T-NHL 患者临床分期的影响
经单项Logistic 回归分析并建立Logistic 多元回归模型分析结果显示,血清TK1 和sCD30 过表达可能是T-NHL 患者临床分期的影响因素(OR>1,P<0.05)。见表4。
表3 不同临床特征T-NHL 患者血清sCD30 水平比较(kU/L,± s)

表3 不同临床特征T-NHL 患者血清sCD30 水平比较(kU/L,± s)
注:T-NHL 为T 细胞非霍奇金淋巴瘤,T 细胞为T 淋巴细胞,NK/T 细胞为自然杀伤细胞/T 淋巴细胞,ALK 为间变性淋巴瘤激酶
项目临床分期临床特征Ⅰ/Ⅱ期Ⅲ/Ⅳ期t/F 值4.309 P 值<0.01淋巴结外浸润2.010 0.054全身症状有无有无1.490 0.147 T 细胞淋巴瘤病种分类血管免疫母T 细胞外周T 细胞,非特指ALK 阳性、阴性间变T 细胞NK/T 细胞例数6 26 11 21 22 10 8 16 0.086 0.967 3 5 sCD30 131.52±10.24 153.24±11.30 154.51±11.33 146.37±10.65 153.24±11.62 146.81±10.58 128.54±10.62 129.65±11.32 132.25±10.34 130.25±11.32

表4 血清TK1 和sCD30 表达对T-NHL 患者临床分期的影响
2.4 血清TK1 和sCD30 水平预测T-NHL 患者临床高分期价值
绘制ROC 曲线,结果显示,当血清TK1 和sCD30 的截断值(cut-off 值)分别取1.375 pmol/L、130.245 kU/L 时,预测T-NHL 患者临床高分期风险价值的AUC 分别为0.872、0.888,有一定预测价值。相关预测参数见图1、表5。

表5 血清TK1 和sCD30 水平预测T-NHL 患者临床高分期风险价值分析结果

图1 血清TK1 和sCD30 单独及联合预测T-NHL 患者临床高分期风险价值的ROC 曲线图
3 讨论
T-NHL 恶性程度高,尽早明确疾病的临床特征,对拟定个体化治疗方案、促进患者康复具有重要意义[8]。随着分子生物学的深入研究,多种细胞因子被证实在恶性肿瘤发生、发展过程中发挥重要作用[9]。因此,积极找出可评估T-NHL 肿瘤恶性增殖程度的相关指标,对指导早期干预意义重大。
TK1 是一种特殊激酶,该酶可将胸苷催化为1-磷酸胸苷酸,促进肿瘤细胞DNA 合成,正常情况下,TK1 表达量受细胞周期调控,且与肿瘤细胞DNA 合成情况呈正比[10-11]。但研究显示,正常细胞组织代偿增生或肿瘤细胞恶性增殖时,血清TK1 水平会大幅升高,甚至超过TK1 正常水平的2~10 倍,而在无增殖性的细胞中,血清TK1 几乎不表达[12]。Zhu 等[13]研究发现,胰腺导管细胞癌组织中TK1 含量高于癌旁组织,且TK1 含量与胰腺导管细胞癌临床分期、单一T 分期存在一定关系。2014 年,Niaman 等[14]研究显示,小细胞肺癌与非小细胞肺癌患者血清TK1 水平存在差异,且血清TK1 可用于评估2 种肺癌患者预后。结合上述研究结果猜测,血清TK1 可能与T-NHL 患者临床特征存在联系。本研究结果显示,高分期的T-NHL 患者血清TK1 水平均高于低分期T-NHL 患者。经Logistic 回归分析结果显示,血清TK1 过表达可能是T-NHL 患者临床分期的影响因素。原因是TK1 水平会随着机体出现大量增殖细胞而快速升高,是临床评估肿瘤细胞增殖度的标志物,具有较高的特异度和灵敏度,而T-NHL 患者临床分期越高,肿瘤细胞增殖越严重,TK1 水平也越高。进一步绘制ROC 曲线发现,血清TK1 预测T-NHL 患者临床高分期风险有一定价值,当血清TK1 取1.375 pmol/L 时,提示T-NHL 患者临床高分期高风险,且随水平升高风险增加。
sCD30 是一种分布在活化T 细胞、自然杀伤细胞等细胞表面的Ⅰ型膜贯通性糖蛋白,正常情况下,sCD30 低表达,但T 细胞大量激活时,sCD30 表达量显著增高,且可能会导致机体免疫应答障碍[15-16]。因免疫失调是多种恶性肿瘤发生的主要因素,且可能与T-NHL 发生存在一定关系,故考虑可将sCD30 用于评估T-NHL 发生风险[17]。2015 年,Purdue 等[18]研究发现,随着血清sCD30 水平升高,T-NHL 发生风险显著增加。谢瑜等[19]研究发现,sCD30 对T-NHL 具有一定诊断价值,且不同临床特征T-NHL 患者血清sCD30 水平存在差异。由此猜测,血清sCD30 对T-NHL 发生风险评估具有较高价值,且可能与T-NHL 患者临床特征存在一定关系。本研究结果显示,Ⅲ/Ⅳ期T-NHL 患者血清sCD30 水平均高于Ⅰ/Ⅱ期患者;经Logistic 回归分析结果显示,血清sCD30 过表达是T-NHL 患者临床分期的影响因素。进一步绘制ROC 曲线发现,血清sCD30 预测T-NHL 患者临床Ⅲ/Ⅳ期风险有一定价值,当血清sCD30 取130.245 kU/L 时,提示T-NHL 患者临床高分期高风险,且随水平升高风险增加,证实了上述猜测。本研究还发现,血清TK1 和sCD30 联合检测预测T-NHL 患者临床高分期风险价值高于各项单一预测,故临床可考虑将2者联合检测,以提高临床对T-NHL 患者临床特征分析鉴别的准确性,并指导临床干预。还有研究显示,T-NHL 患者预后与肿瘤侵袭程度息息相关[20]。但本研究并未探讨不同肿瘤侵袭度患者血清TK1和sCD30 水平差异,这是本研究的局限性,未来仍需开展大样本量的前瞻性研究加以验证。
综上所述,T-NHL 患者临床分期可能与血清TK1 和sCD30 过表达有关,未来可考虑通过检测血清TK1 和sCD30 水平变化,指导T-NHL 患者的早期临床特征分析与合理干预,可能对改善T-NHL 患者的预后有积极意义。

