西方蜜蜂发育基因AmWnt1的克隆鉴定及时空表达分析
梁立强,郭永康,朱雅楠,李秋方,李正汉卿,王若虹,候梦赏,龚 娇,李 标,曾何泉,聂红毅,苏松坤
(福建农林大学动物科学学院(蜂学学院),福州 350002)
Sharma等(1976)发现影响果蝇翅膀发育的关键基因wingless,由于该基因突变的果蝇成虫表现出翅膀消失的特征,因此,wingless基因又称为无翅基因。Nusse等(1982)发现了影响癌症的关键基因int-1,该基因被小鼠乳腺肿瘤病毒激活后可以导致肿瘤。后来研究者发现小鼠int-1基因在果蝇中的同源基因就是wingless,因此把这类基因统一命名为Wnt基因,int-1(wingless)基因重新命名为Wnt1基因(Rijsewijketal., 1987; Nusseetal., 1991)。Wnt蛋白结构域为Wnt1,富含半胱氨酸,属于分泌型糖蛋白(Cadigan and Nusse, 1997)。Wnt基因分子功能在生物体中高度保守,从低等动物的海葵到高等动物的人类,基因组中均存在Wnt基因(Miller, 2001; Kusserowetal., 2005)。在人类和小鼠中,Wnt蛋白参与多种肿瘤发生、细胞命运决定和内稳态调节等多种生命活动,研究Wnt蛋白有利于人类进一步了解癌症的发生和细胞的生长、分化规律(Miller, 2001)。与脊椎动物相比,昆虫中很多Wnt家族基因发生了丢失(Muratetal., 2010)。目前已经在鳞翅目、双翅目、鞘翅目、半翅目、膜翅目等多种昆虫中系统的鉴定了Wnt基因家族成员,如家蚕Bombyxmori、果蝇Drosophilamelanogaster、冈比亚按蚊Anophelesgambiae、赤拟谷盗Triboliumcastaneum、豌豆蚜Acyrthosiphonpisum、西方蜜蜂基因组鉴定中分别鉴定了8、7、7、9、6、7个Wnt基因(Shigenobu, 2006; Bolognesietal., 2008; Shigenobu, 2010; Muratetal., 2010; Dingetal., 2019)。
在昆虫中,果蝇的Wnt基因家族的生理功能研究最为深入。在果蝇中,Wnt1缺失会导致成虫翅膀消失,还会引起胚胎神经系统发育受阻和胚胎体节分布异常等表型缺陷(Sharma and Chopra, 1976; Bejsovec, 2006);DmWnt5基因功能较为复杂,该基因在颚节、腹神经索、上唇、中胚层和肢体原基均有表达,且参与胚胎唾液腺迁移、中枢神经系统轴突成术等生物学过程(Muratetal., 2010);DmWnt7调控气管发育、雄性生殖器官形成和唾液腺迁移等重要生理过程(Kozopasetal., 1998; Llimargas and Lawrence, 2001; Harris and Beckendorf, 2007);高表达或低表达DmWnt8均会导致腹侧内凹受阻、背部表皮增加,并且DmWnt8突变还会导致免疫功能降低(Gordonetal., 2005);DmWnt6只在胚胎和幼虫肠道微弱表达;DmWnt10主要在3龄幼虫的成虫盘、胚胎的中胚层、中枢神经系统、肠道表达,且在3龄幼虫的成虫盘表达量较高(Jansonetal., 2001)。其它昆虫关于Wnt家族研究主要集中在Wnt1基因。在家蚕中,利用CRISPR/Cas9敲除Wnt1后,突变体表现出胚胎孵化困难、足发育异常、无法着色和体节缺失等典型表型,并且还会导致ultrabithorax、abdominal-A、abdominal-B等HOX家族基因表达量急剧下调;对HOX基因进一步敲除后,出现色素沉积和腹节分节异常等相似表型,表明BmWnt1可能通过调控家蚕HOX基因控制家蚕胚胎时期体节发育和幼虫时期色素沉积(Zhangetal., 2015)。在乳草长蝽Oncopeltusfasciatus中,通过RNA干扰敲低Wnt1基因的表达量,处理组出现眼睛变小和胚带截断的发育缺陷(Angelini and Kaufman, 2005)。在马尾松毛虫Dendrolimuspunctatus中,缺失Wnt1会导致色素分布异常、四肢缺失和头部发育畸形等与家蚕BmWnt1突变体的相似表型(Liuetal., 2017)。在赤拟谷盗Triboliumcastaneum中,利用RNAi沉默TcWnt1基因的表达,导致了胚胎腹节边界线、胸部附节、颌和侧头叶的缺失(Ober and Jockusch, 2006)。迄今为止,虽然已经有研究者成功鉴定了西方蜜蜂的Wnt基因家族中的7个基因(Wnt1,Wnt4,Wnt5,Wnt6,Wnt7,Wnt10,Wnt11)(Dearden, 2006),然而这些Wnt基因在西方蜜蜂中发挥的生理功能尚未报道。基于Wnt1基因在果蝇、家蚕和赤拟谷盗等模式昆虫胚胎发育过程中的重要作用,本研究克隆鉴定西方蜜蜂AmWnt1基因,并对该蛋白氨基酸序列进行生物信息学预测,同时利用荧光定量PCR检测该基因在不同发育时期和刚出房工蜂不同组织的基因表达量,有利于为后续深入研究蜜蜂和其它膜翅目昆虫Wnt1功能提供参考。
1 材料与方法
1.1 实验材料及主要试剂
1.1.1实验材料
西方蜜蜂样品取自福建农林大学动物科学学院(蜂学学院)实验蜂场。选择群势强、蜜粉充足且健康的1群作为试验蜂群。为了准确收集不同发育时期的实验材料,利用限王产卵的方法控制蜂王产卵时间,主要步骤如下:利用方形王笼(72 mm × 51 mm)将蜂王控制在一张新巢脾上使之产卵,3 h后,取下限王框,待蜂王爬到巢脾另一处后,再次进行限王产卵,3 h后重复以上步骤,直到收取足够的实验材料。同时,准确记录每处限王的位置与相对应的时间。当胚胎分别发育至第1日龄(24 h)、2日龄(48 h)和3日龄(72 h)时,用小刀割下相对应区域的巢脾,在显微镜下用不锈钢移虫针把卵收集至1.5 mL离心管中,用液氮浸泡20 s后,放置-80℃储存;根据限王产卵时间,准确收集幼虫(1日龄、3日龄和5日龄)、预蛹(1日龄和3日龄)、蛹(0日龄、2日龄、4日龄、6日龄和8日龄)的材料。将封盖子脾置于35℃培养箱中,每间隔 6 h收集出房的工蜂作为刚出房蜜蜂。将头部插入幼虫巢房中持续时间超过10 s的工蜂作为哺育蜂;在巢门口,抓取后足携带花粉团的返巢工蜂作为采集蜂。在干冰上,分别解剖刚出房工蜂的头、胸部、腹部、肠道、螫针、触角、足和翅膀。每个采样点(或组织)取3个实验重复,采集的样本用液氮浸泡20 s后,放置-80℃储存,用于后续RNA提取。
1.1.2主要实验仪器和试剂
Trizol试剂、克隆载体pEASY-Blunt Zero、大肠杆菌感受态细胞Trans1-T1 Phage Resistant Competent cell、琼脂糖、TAE缓冲液、Trans2K、6x Loading Buffer、GelStain染色剂购自北京全式金生物技术有限公司;Phanta Max Super-Fidelity DNA Polymerase、ChamQ SYBR Color qPCR Master Mix、HiScript II Q RT SuperMix for qPCR (+gDNA wiper)购自南京诺维赞生物科技有限公司,切胶回收试剂盒Gel Extraction购自Omega公司;LB培养基、氨苄青霉素购自生工生物工程(上海)有限公司;RNA提取液购自北京索莱宝生物技术有限公司。
1.2 引物设计
在NCBI网站下载西方蜜蜂AmWnt1mRNA序列(GenBank登录号:XM_026444306.1),用Primer 6.0设计用于克隆AmWnt1CDS序列和qRT-PCR的特异性引物(表1)。
1.3 AmWnt1基因的克隆及生物信息学分析
1.3.1总RNA提取和反转录
将不同发育时期样本和刚出房工蜂各组织分别充分研磨,按照Trizol试剂盒说明书方法提取RNA。取1 μg RNA为模板,参照HiScript II Q RT SuperMix for qPCR (+gDNA wiper)说明书,合成cDNA的第1链。
1.3.2基因克隆与测序
将刚出房蜜蜂cDNA稀释3倍后作为模板,以AmWnt1_c为引物,扩增获得AmWnt1基因的CDS序列。PCR反应体系(50 μL):2×Phanta Max Buffer 25 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,dNTP Mix (10 mM each) 1 μL,上下游引物(10 μM)各2 μL,cDNA 5 μL,ddH2O14 μL。PCR反应条件:95℃预变性3 min,95℃变性15 s,60℃退火15 s,72℃延伸1 min,循环数35;72℃终延伸,5 min。反应结束后,按照Gel Extraction说明书进行胶回收纯化,产物用紫外分光光度计进行定量,调整产物浓度为50 ng/μL。将纯化后的PCR产物与Blunt Zero载体连接,转化至Trans1-T1感受态细胞,送生物公司测序。
1.3.3生物信息学分析
BioEdit软件预测AmWnt1基因编码的氨基酸序列,ProtParam (https://web.expasy.org/protparam/)预测蛋白理化性质;分别利用NetPhos 2.0 (http://www.cbs.dtu.dk/services/NetPhos-2.0/)、NetOGlyc 4.0 Server (http://www.cbs.dtu.dk/services/NetOGlyc/)和NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/)预测蛋白的N磷酸化位点、O糖基化位点和N糖基化位点;TMHMM-2.0 (http://www.cbs. dtu. dk/services/TMHMM/)分析跨膜结构;ProtScale (https://web.expasy.org/protscale/)预测疏水性;SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)预测信号肽;SMART(http://smart.embl-heidelberg.de/)预测结构域。用BioEdit和GENEDOC软件进行多序列比对,通过MEGA 6.0软件,使用邻接法构建系统进化树。
1.4 西方蜜蜂AmWnt1基因在不同发育时期和刚出房工蜂各组织中表达量检测
以1.4.1节反转录获得的西方蜜蜂不同发育时期和刚出房工蜂各组织的cDNA为模板,进行荧光定量PCR。荧光定量PCR反应(10 μL体系):2×ChamQ SYBR Color qPCR Master Mix (Low ROX Premixed) 5 μL,正反向引物各0.2 μL,cDNA 1 μL,ddH2O 3.6 μL。反应条件为95℃ 3 min;95℃ 10 s,60℃ 30 s,39个循环。按照如下条件测定熔解曲线:65℃升温到95℃,每5 s升高0.5℃。反应结束后,统计不同样本的Ct值,用2-△△Ct法计算目的基因的相对表达量。定量分析均设置3个生物学重复和3个技术重复。
1.5 数据分析
所有数据用SPASS 7.0软件中的单因素方差分析进行实验数据的统计学分析,用GraphPad Prism 6.0作图。
2 结果与分析
2.1 AmWnt1基因的扩增、克隆和测序
以刚出房蜜蜂的cDNA为模板,扩增包含AmWnt1基因完整的CDS序列。PCR产物切胶纯化后片段经2%琼脂糖凝胶电泳检测,在约1 500 bp处检测到单一条带,扩增片段大小符合预期(图1)。该产物与Blunt zero载体连接,送生物公司测序。利用BioEdit软件将测序的序列进行拼接,去除载体序列,预测对应的氨基酸序列(图2)。与NCBI上预测的AmWnt1序列基本一致,CDS序列全长为1 239 bp,编码412个氨基酸。序列已上传NBCI,登录号为MT993937。

图1 AmWnt1基因PCR产物切胶回收后的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of purified PCR product of AmWnt1 gene注:泳道M为DNA Marker DL 2000;泳道1为AmWnt1切胶回收纯化后的PCR产物。Note: Lane M was DNA Marker DL 2000; Lane 1 was purified PCR product of AmWnt1 gene.
2.2 理化特性预测
通过ProtParam分析预测,AmWnt1蛋白等电点为9.48,分子量为46.40313 kDa,分子式为C1991H3158N630O579S38,共6 396个原子组成。脂肪指数为61.31,不稳定指数为43.20,大于40,表明该蛋白不稳定(Guruprasadetal., 1990)。不同氨基酸的占比不同,精氨酸含量最高,为9.5%(表2)。疏水性分析表明:AmWnt1蛋白第40位氨基酸得分最低为-2.978,第24位氨基酸得分最高为3.533,属于亲水性蛋白。
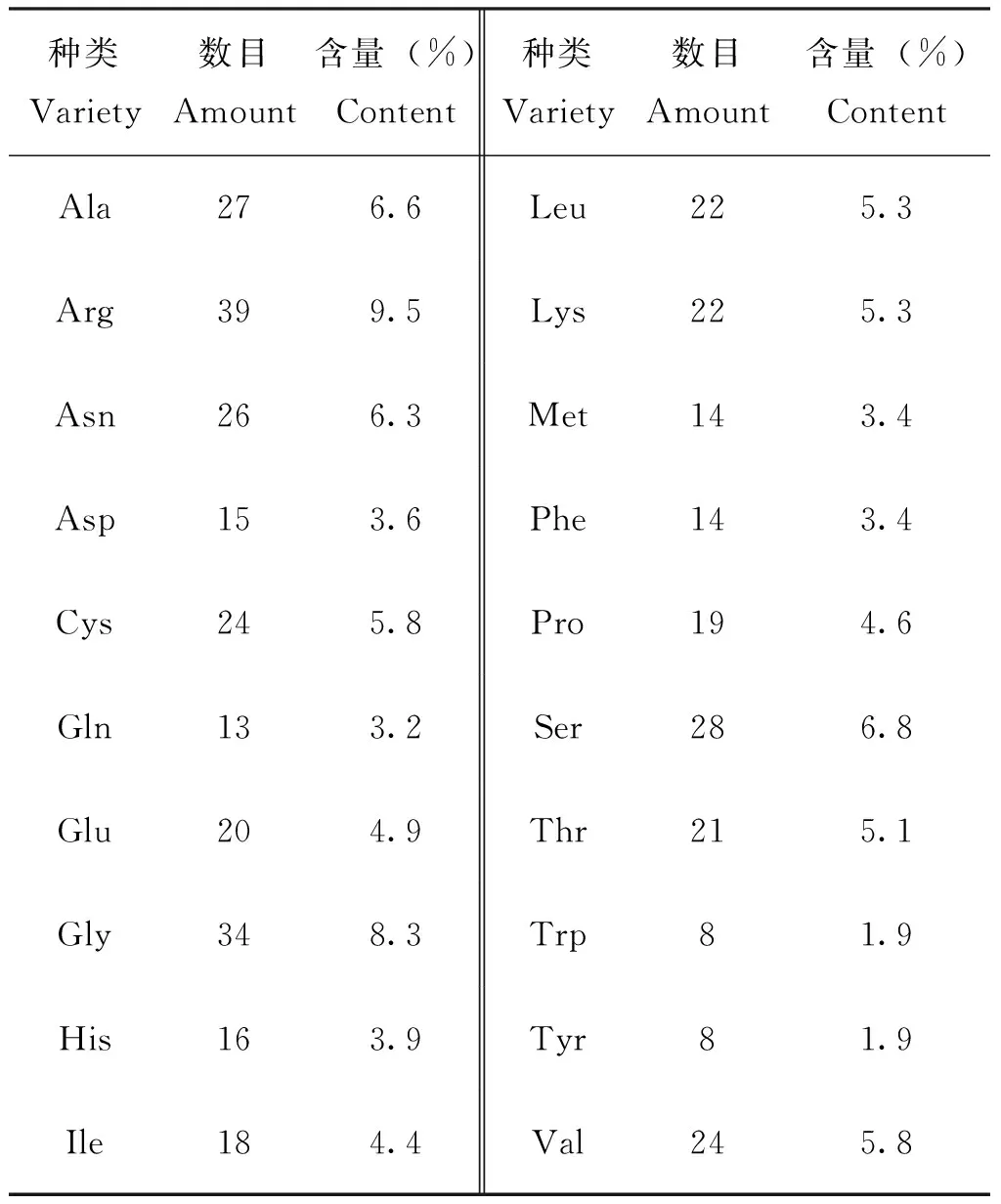
表2 西方蜜蜂AmWnt1蛋白的氨基酸种类和数目

图2 西方蜜蜂AmWnt1基因及其推导的氨基酸序列Fig.2 Nucleotide and amino acid sequences of AmWnt1 of Apis mellifera注:划线部分为Wnt1结构域。Note: Wnt1 domain was underlined.
2.3 结构预测
结构域预测表明:AmWnt1蛋白在第73和第412个氨基酸之间有一个Wnt1结构域,属于Wnt家族成员。该蛋白无信号肽,共有1个跨膜结构,位置为17~36,N端在细胞膜内。AmWnt1蛋白包含12个O糖基化位点,位置分别为第6、72、76、172、175、179、180、181、292、294、296和298位氨基酸;共2个N糖基化位点,位置为第116、第358位氨基酸;磷酸化位点共有19个,其中1个酪氨酸位点、7个苏氨酸位点和11个丝氨酸位点。
2.4 序列比对
通过在线软件NCBI的BLASTP和BioEdit比对,与西方蜜蜂Wnt1蛋白同源度最高的物种为东方蜜蜂,相似度为99.50%;其次为小蜜蜂、欧洲熊蜂、切叶蜂、造纸胡蜂,相似度分别为99.26%、96.56%、97.24%、83.71%,表明Wnt1结构域在膜翅目昆虫中进化的较为保守(图3)。

图3 西方蜜蜂AmWnt1氨基酸序列和其它膜翅目昆虫同源序列比对Fig.3 Amino acid sequence alignment of AmWnt1 proteins from Apis mellifera and other Hymenoptera insects注:Wnt1蛋白来源及GenBank登录号。AmWnt1:西方蜜蜂Apis mellifera,MT993937;AcerWnt1:东方蜜蜂Apis cerana,XP_016904766.1;AfloWnt1:小蜜蜂Apis florea,XP_031776435.1;BterWnt1:欧洲熊蜂Bombus terrestris,XP_003393164.1;MrotWnt1:切叶蜂Megachile rotundata,XP_003707885.1;PdomWnt1:造纸胡蜂Polistes dominula,XP_015178534.1。
2.5 系统进化分析
利用西方蜜蜂Wnt1蛋白氨基酸序列在NCBI上进行Blast检索,得到包括膜翅目、蜚蠊目、双翅目、直翅目、鳞翅目和鞘翅目等16种昆虫Wnt1蛋白的氨基酸序列,将各种昆虫的氨基酸序列导入到MEGA 6.0进行序列比对,然后利用邻接法构建系统进化树。系统进化树分析显示:膜翅目、鞘翅目和鳞翅目分别单独聚为一个分支,但双翅目的埃及伊蚊和黑腹果蝇,分别与蜚蠊目的美洲大蠊和直翅目的双蟋蟀聚为一群,置信度分别为50和38。西方蜜蜂Wnt1蛋白与膜翅目东方蜜蜂亲缘关系最近,与鞘翅目赤拟谷盗亲缘关系最远(图4)。
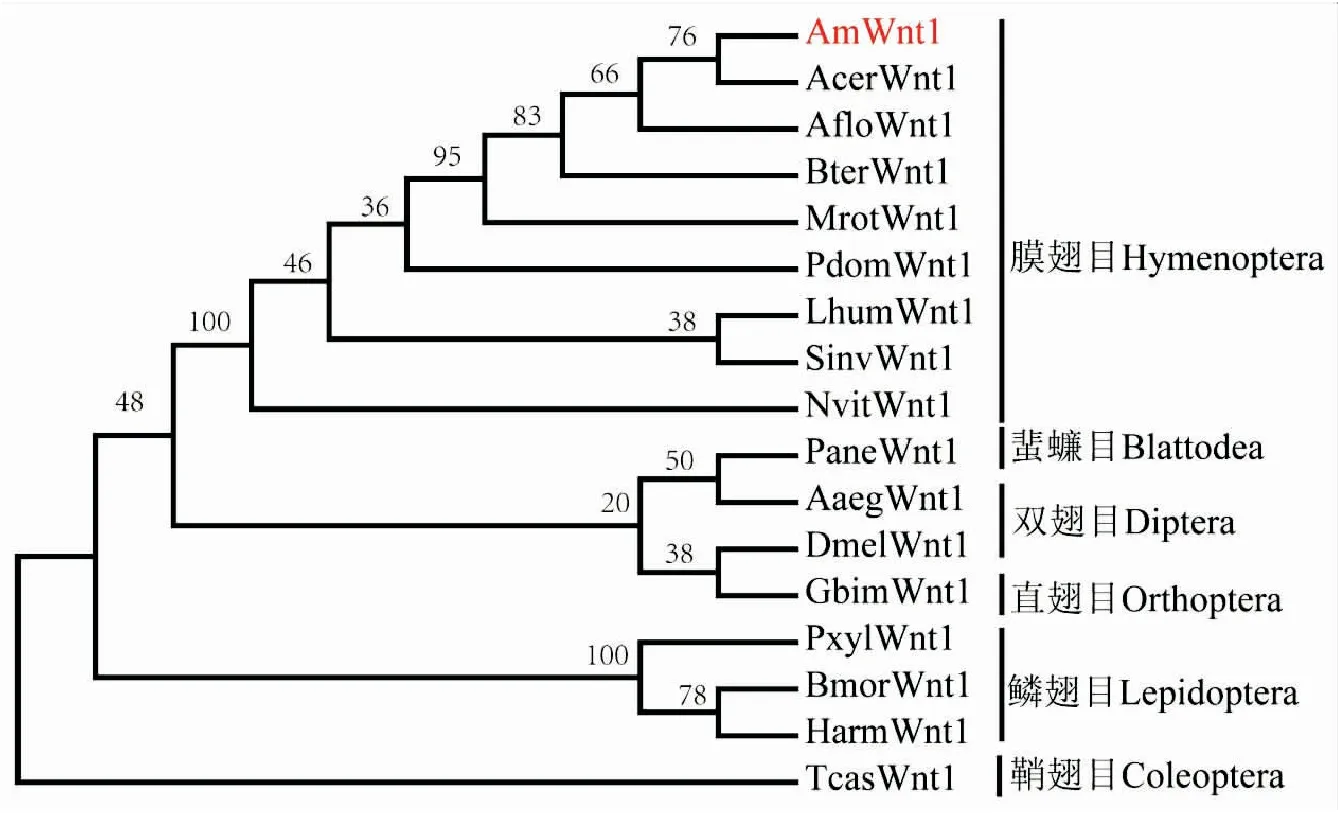
图4 基于西方蜜蜂和其它昆虫Wnt1氨基酸序列构建的系统进化树Fig.4 Phylogenetic tree of Wnt1 from Apis mellifera and insects reconstructed based on amino acid sequences注:Wnt1蛋白来源及对应的GenBank登录号AmWnt1:西方蜜蜂Apis mellifera,MT993937;AcerWnt1:东方蜜蜂Apis cerana,XP_016904766.1;AfloWnt1:小蜜蜂Apis florea,XP_031776435.1;BterWnt1:欧洲熊蜂Bombus terrestris,XP_003393164.1;MrotWnt1:切叶蜂Megachile rotundata,XP_003707885.1;PdomWnt1:造纸胡蜂Polistes dominula,XP_015178534.1;LhumWnt1:阿根廷蚂蚁Linepithema humile,XP_012229142.1;SinvWnt1:红火蚁Solenopsis invicta,XP_025994453.1;NvitWnt1:金小蜂Nasonia vitripennis,XP_001603388.3;PaneWnt1:美洲大蠊Periplaneta Americana,AGG14205.1;AaegWnt1:埃及伊蚊Aedes aegypti,XP_021702999.1;DmelWnt1:黑腹果蝇Drosophila melanogaster,NP_523502.1;GbimWnt1:双蟋蟀Gryllus bimaculatus,BAB19660.1;TcasWnt1:赤拟谷盗Tribolium castaneum,EFA04660;PxylWnt1:小菜蛾Plutella xylostella,XP_011568230.1;BmorWnt1:家蚕Bombyx mori,NP_001037315.1;HarmWnt1:棉铃虫Helicoverpa armigera,AHN95659.1。
2.6 AmWnt1基因表达量分析
采用荧光定量PCR获得AmWnt1基因在不同发育时期的相对表达量(图5)。结果表明:AmWnt1基因在西方蜜蜂各个发育时期均有表达。在胚胎期,该基因在1日龄胚胎中表达量较低,随着胚胎的发育,表达量持续增加,且在3日龄胚胎时该表达量达到整个发育时期的最大值;幼虫阶段,该基因表达量相对较低;在预蛹期,该基因的表达量显著升高;在蛹期,该基因在0日龄的蛹的表达量继续增加,呈现第二个峰值的趋势,然后表达量逐渐降低。AmWnt1基因在刚出房蜜蜂不同组织的表达谱表明:AmWnt1基因在刚出房蜜蜂头、胸、腹、肠道、翅膀、蛰针、触角、足中均有表达,其中在胸部、头、触角中高表达(图6)。

图5 AmWnt1基因在西方蜜蜂不同发育时期的相对表达量Fig.5 Relative expression levels of AmWnt1 in different developmental stages of Apis mellifera注:E1-3,分别是1~3日龄卵;L1,L3,L5分别为第1天、3天和5天的幼虫;PP1,1日预蛹;P0,P2,P4,P6,P8分别为第0,2,4,6,8日龄的蛹;NE,刚出房工蜂;Nur,哺育蜂;For,采集蜂。图中数据表示平均值+标准误,不同字母代表不同发育时期AmWnt1相对表达量具有显著性差异(P<0.05,Dunnett’s T3检验)。Note: E1-3, 1~3-day-old egg, respectively; L1, L3, L5, larvae of 1-day-old, 3-day-old and 5-day-old, respectively; PP1, 1-day-old pharate pupae; P0, P2, P4, P6, P8, pupae of 0-day-old, 2-day-old, 4-day-old, 6-day-old, 8-day-old, respectively; NE, Newly emerged workers; Nur, Nurse bees; For, Foragers. Data in the figure were mean±SE, different letters indicated significant differences among different developmental stages (P<0.05, Dunnett’s T3 test).
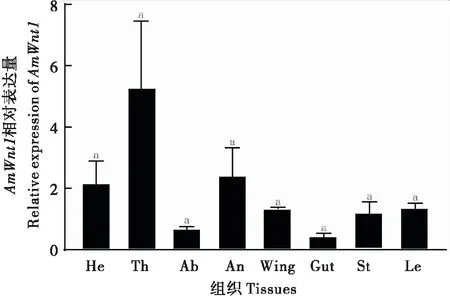
图6 AmWnt1基因在刚出房工蜂不同组织的相对表达量Fig.6 Relative expression levels of AmWnt1 in different tissues of newly emerged workers注:He,头(去触角);Th,胸(去翅膀和足);Ab,腹(去肠道);An,触角;Wing,翅膀;Gut,肠道;St,蛰针(带毒腺);Le,足leg。不同字母代表不同组织中AmWnt1相对表达量具有显著性差异(P<0.05, Dunnett’s T3检验)。Note: He, head (without antenna); Th, thorax (without wing and legs); Ab, abdomen (with gut removed); An, antenna; Wing, wing; Gut, gut; St, sting (with venom gland); Le, leg. Different letters indicated significant differences among different tissues (P<0.05, Dunnett’s T3 test).
3 结论与讨论
AmWnt1蛋白结构预测显示,与已经报道的Wnt蛋白一致,AmWnt1蛋白具有保守的Wnt1结构域(位于第73位到第412位氨基酸)。研究者认为,Wnt基因编码分泌型糖蛋白,而多数分泌型蛋白在N端具有信号肽(Cadigan and Nusse, 1997; Zhao, 2006)。根据SignalP 4.1信号肽预测结果,AmWnt1蛋白并未预测到信号肽。Ding等(2019)研究表明,在果蝇、家蚕、赤拟谷盗、冈比亚按蚊等模式昆虫中均可预测到Wnt1蛋白的信号肽序列,在小菜蛾Plutellaxylostella和黑脉金斑蝶Danausplexippus未预测到信号肽;与此同时,家蚕Wnt8和Wnt10蛋白未检测到信号肽,可能是这些蛋白包含隐藏部分的信号肽序列,使得SignalP 4.1软件无法识别,西方蜜蜂AmWnt1蛋白可能也因此无法检测到信号肽。
AmWnt1在西方蜜蜂不同发育时期均有表达,在胚胎期、预蛹期、蛹前期表达量高于其它时期,尤其随着胚胎发育的进行,表达量逐渐升高,并达到峰值。Zhang等(2015)检测了BmWnt1在家蚕胚胎期的表达量,该基因在胚胎发育前期的表达量高于后期。在西方蜜蜂中,AmWnt1在西方蜜蜂胚胎发育后期表达量最高,暗示AmWnt1可能主要参与胚胎的晚期发育。西方蜜蜂胚胎发育过程包括卵裂、胚盘形成与发育(7~33 h)、原肠胚形成(33~40 h)、胚带形成(40~55 h)和背部发育等5个过程,3日龄卵AmWnt1基因表达量最高,此时正处于胚带形成阶段,这个阶段主要发生卵膜、羊膜、中肠、神经系统和其它外胚层结构的形成(Fleig and Sander, 1986),AmWnt1可能参与调控其中一种或多种组织的形成,并且已有研究证明在果蝇Wnt1突变体中,神经系统发育异常(Chu-LaGraff and Doe, 1993)。2日龄卵AmWnt1基因表达量仅次于3日龄卵,此时处于胚盘形成与发育阶段。敲除家蚕、马尾松毛虫Wnt1基因,幼虫均会出现四肢和腹节缺失、色素分布异常等发育缺陷(Zhangetal., 2015; Liuetal., 2017);在西方蜜蜂中,四肢出现发生在蛹期前期,此时AmWnt1表达量处于第二个高峰期,猜测可能参与此时的四肢发育过程。荧光定量PCR结果表明:AmWnt1基因在刚出房工蜂头部的表达量高于其它组织,这与Wnt1基因在家蚕3日5龄幼虫头部高表达的结果是一致的(Dingetal., 2019)。
系统进化分析结果表明,AmWnt1与同属膜翅目昆虫Wnt1聚为一支,其中与东方蜜蜂亲缘关系最近,表明Wnt1蛋白在膜翅目昆虫之间进化的较为保守。在双翅目、鳞翅目和鞘翅目中,Wnt1基因功能已经研究的较为明晰,然而目前还没有关于膜翅目昆虫Wnt1基因相关报道。本研究首次在膜翅目昆虫中克隆鉴定了AmWnt1基因,明确了该基因在不同发育阶段和刚出房蜜蜂的不同组织的表达特征,推测其可能参与了西方蜜蜂胚胎晚期的神经系统发育和化蛹过程中的四肢发育等关键历程,为膜翅目其它昆虫Wnt1基因的研究提供了参考。在蜜蜂中研究发育相关基因,也将为膜翅目寄生蜂的生物防控提供理论参考。
近年来,随着CRISPR/Cas9基因编辑技术的日渐成熟,越来越多的运用于昆虫的基因功能研究中。在西方蜜蜂中,已经成功运用CRISPR/Cas9基因编辑技术成功敲除了mrjp1,mKast,pax6,doublesex,fruitless,feminizer和loc552773等6个基因(Kohnoetal., 2016; Kohno and Kubo, 2018; Huetal., 2019; Rothetal., 2019)。下一步,我们将会借助于本实验室前期已经建立的CRISPR/Cas9基因编辑技术构建AmWnt1突变体,进一步验证该基因在蜜蜂发育和行为中的功能,为验证Wnt家族的其它基因提供技术参考,为研究膜翅目其它昆虫的Wnt1基因功能奠定基础。

