α-取代硝基乙酸苯酯与醌酯类化合物的串联反应构建3-取代-3-硝基苯并呋喃酮类化合物
程少冰, 张晓梅
(1. 中国科学院 成都有机化学研究所, 四川 成都 610041; 2. 中国科学院大学,北京 100049)
在许多天然化合物中具有3,3-二取代苯并呋喃酮的结构,如Radulfoin B[1],Rosmadial[2]以及(+)-Hopeahainol A[3-5],如Chart 1所示,它们具有多种多样的生物活性。醌类化合物具有α,β-不饱和酮结构,能够作为亲电试剂,能发生共轭加成反应。目前已有利用醌类化合物与活性亚甲基酯类化合物经过加成-芳构化-环化构建3,3-二取代苯并呋喃酮类化合物的报道[6-7]。
另外已有许多文献报导了活性亚甲基化合物取代硝基乙酸酯与α,β-不饱和物发生Michael加成反应[8-15]。而取代硝基乙酸酯与醌类化合物的反应却未有文献报道。鉴于此,本文设计将取代硝基乙酸苯酯与醌酯类化合物进行加成-芳构化-环化的串联反应,期望获得3-取代-3-硝基苯并呋喃酮化合物类化合物(Scheme 1)。
1 实验部分
1.1 仪器与试剂
Bruker-300 MHz型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);Bruker-FT-MS型质谱仪。

Scheme 1
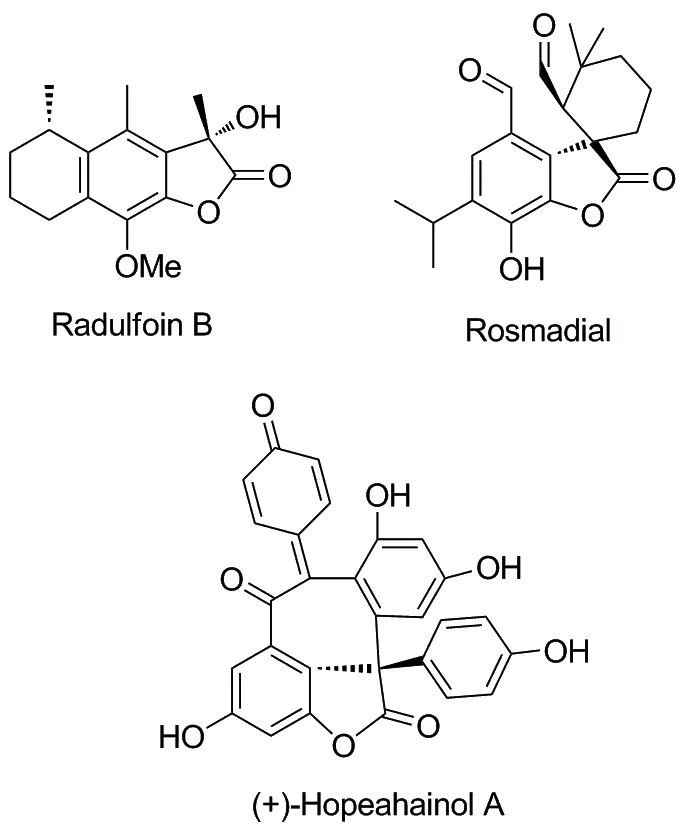
Chart 1
α-取代硝基乙酸苯酯1a~1i利用α-取代溴代乙酸苯酯硝化获得[16-18],醌酯类化合物2a~2i由相应的酚经过在无水条件下氧化获得[19-21];甲苯、甲基叔丁基醚、四氢呋喃用金属钠和二苯甲酮处理后蒸出;二氯甲烷、1,2-二氯乙烷、乙腈、乙酸乙酯用氢化钙处理后蒸出;其余试剂除特别说明外均为分析纯。
1.2 3aa~3ba, 3da~3ha, 3ab~3ai的合成
向1a~1b,1d~1h(0.1 mmol)与氮甲基吗啉(0.005 mmol)的混合体系中加入甲苯(2 mL), 然后将反应体系置于冰水浴中,待搅拌30 min后,将2a~2i(0.135 mmol)加入反应体系中,然后在冰水浴中搅拌4~48h(TLC检测)。反应毕,将反应液浓缩并以硅胶柱层析(洗脱剂:PE: DCM: EA=25:1:0.3~10:1:0.35)纯化得化合物3aa~3ba,3da~3ha,3ab~3ai。
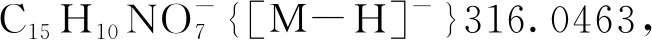
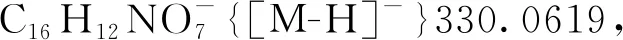
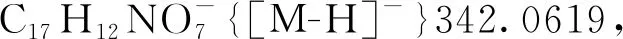
5-羟基-3-(3-甲氧基-3-氧丙基)-3-硝基-2-氧代-2,3-二氢萘[1,2-b]呋喃-4-羧酸甲酯(3ea): 淡黄色油状液体,收率89%;1H NMR(300 MHz, CDCl3)δ: 12.26(s, 1H), 8.53(d,J=10.3 Hz, 1H), 8.05(d,J=7.6 Hz, 1H), 7.87~7.73(m, 2H), 3.94(s, 3H), 3.41(s, 3H), 3.13(td,J=7.7 Hz, 1.4 Hz, 2H), 2.29(dt,J=16.7 Hz, 7.4 Hz, 1H), 1.96(dt,J=16.6 Hz, 7.7 Hz, 1H);13C NMR(75 MHz, CDCl3)δ: 171.26, 169.12, 168.33, 160.07, 145.02, 131.46, 129.14, 126.87, 125.04, 122.97, 121.83, 112.28, 100.19, 93.86, 52.18, 51.95, 29.40, 28.54; HR-MS(ESI-TOF)m/z: Calcd for C18H14NO9-{[M-H]-} 388.0674, found 388.0676。
5-羟基-3-(4-甲氧基-4-氧丁基)-3-硝基-2-氧代-2,3-二氢萘[1,2-b]呋喃-4-羧酸甲酯(3fa): 淡黄色油状液体,收率84%;1H NMR(300 MHz, CDCl3)δ: 12.27(s, 1H), 8.54(d,J=8.3 Hz, 1H), 8.05(d,J=8.1 Hz, 1H), 7.89~7.70(m, 3H), 3.91(s, 3H), 3.61(s, 3H), 2.88~2.75(m, 2H), 2.30(td,J=6.8 Hz, 3.0 Hz, 2H), 1.34(q,J=6.3 Hz, 2H);13C NMR(75 MHz, CDCl3)δ: 172.48, 169.23, 168.68, 160.26, 144.87, 131.40, 128.99, 126.88, 125.11, 123.11, 121.84, 112.88, 100.03, 94.52, 52.09, 51.71, 33.35, 32.75, 19.13; HR-MS(ESI-TOF)m/z: Calcd for C19H16NO9-{[M-H]-}402.0831, found 402.0814。
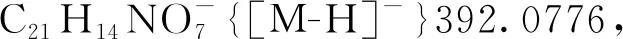
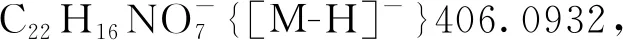
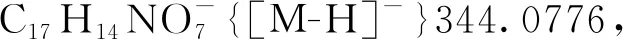
5-羟基-3-甲基-3-硝基-2-氧代-2,3-二氢萘[1,2-b]呋喃-4-羧酸-(3,5-二甲氧基苄基)酯(3ac): 淡黄色油状液体,收率73%;1H NMR(300 MHz, CDCl3)δ: 12.34(s, 1H), 8.53(d,J=8.3 Hz, 1H), 8.04(d,J=8.1 Hz, 1H), 7.88~7.68(m, 2H), 6.62(d,J=2.3 Hz, 2H), 6.48(t,J=2.3 Hz, 1H), 5.43(d,J=11.5 Hz, 1H), 5.20(d,J=11.6 Hz, 1H), 3.83(s, 6H), 2.13(s, 3H);13C NMR(75 MHz, CDCl3)δ: 169.00, 168.63, 161.03, 160.52, 144.06, 135.89, 131.37, 128.80, 126.32, 125.06, 123.26, 121.70, 115.15, 107.36, 101.38, 100.63, 90.68, 67.77, 55.45, 21.93; HR-MS(ESI-TOF)m/z: Calcd for C23H18NO9-{[M-H]-}452.0987, found 452.0976。
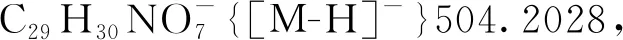
5-羟基-3-甲基-3-硝基-2-氧代-2,3-二氢萘[1,2-b]呋喃-4-羧酸-(2-甲氧基-2-氧乙基)酯(3ae): 淡黄色油状液体,收率94%;1H NMR(300 MHz, CDCl3)δ: 11.93(s, 1H), 8.52(d,J=8.7 Hz, 1H), 8.10~8.01(m, 1H), 7.87~7.72(m, 2H), 5.05(d,J=15.8 Hz, 1H), 4.60(d,J=15.8 Hz, 1H), 3.84(s, 3H), 2.29(s, 3H);13C NMR(75 MHz, CDCl3)δ: 169.04, 168.04, 167.10, 160.67, 144.32, 131.64, 128.94, 126.55, 125.13, 123.49, 121.79, 115.18, 99.21, 90.89, 60.67, 52.71, 21.45; HR-MS(ESI-TOF)m/z: Calcd for C17H12NO9-{[M-H]-}374.0518, found 374.0505。
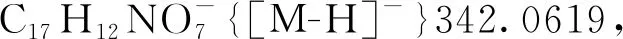
5-羟基-3-甲基-3-硝基-2-氧代-2,3-二氢萘[1,2-b]呋喃-4-羧酸-(4-硝基苄基)酯(3ag): 淡黄色油状液体,收率72%;1H NMR(300 MHz, CDCl3)δ: 12.13(s, 1H), 8.56~8.47(m, 1H), 8.26(d,J=8.8 Hz, 2H), 8.04(d,J=8.1 Hz, 1H), 7.86~7.71(m, 2H), 7.62(d,J=8.7 Hz, 2H), 5.44(s, 2H), 2.17~2.07(m, 3H);13C NMR(75 MHz, CDCl3)δ: 168.69, 168.53, 160.86, 148.35, 144.30, 140.67, 131.70, 130.34, 129.05, 126.64, 125.15, 124.07, 123.43, 121.82, 114.86, 99.39, 90.62, 66.10, 21.95. HR-MS(ESI-TOF)m/z: Calcd for C21H13N2O9-{[M-H]-}437.0627, found 437.0607。
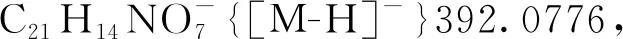
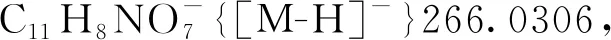
2 实验结果与讨论
首先合成了最简单的α-取代硝基乙酸苯酯化合物1a以及萘醌甲酯化合物2a。首先以甲苯作为溶剂,20 mol%的氮甲基吗啉(NMM)作为碱,化合物1a和化合物2a的投料比1∶1.35进行反应的尝试,如Scheme 2所示。通过对反应的产物进行分离分析,最终确认了产物为化合物3aa的结构,该化合物是我们设计的反应的目标产物。
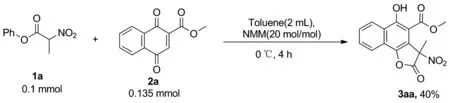
Scheme 2
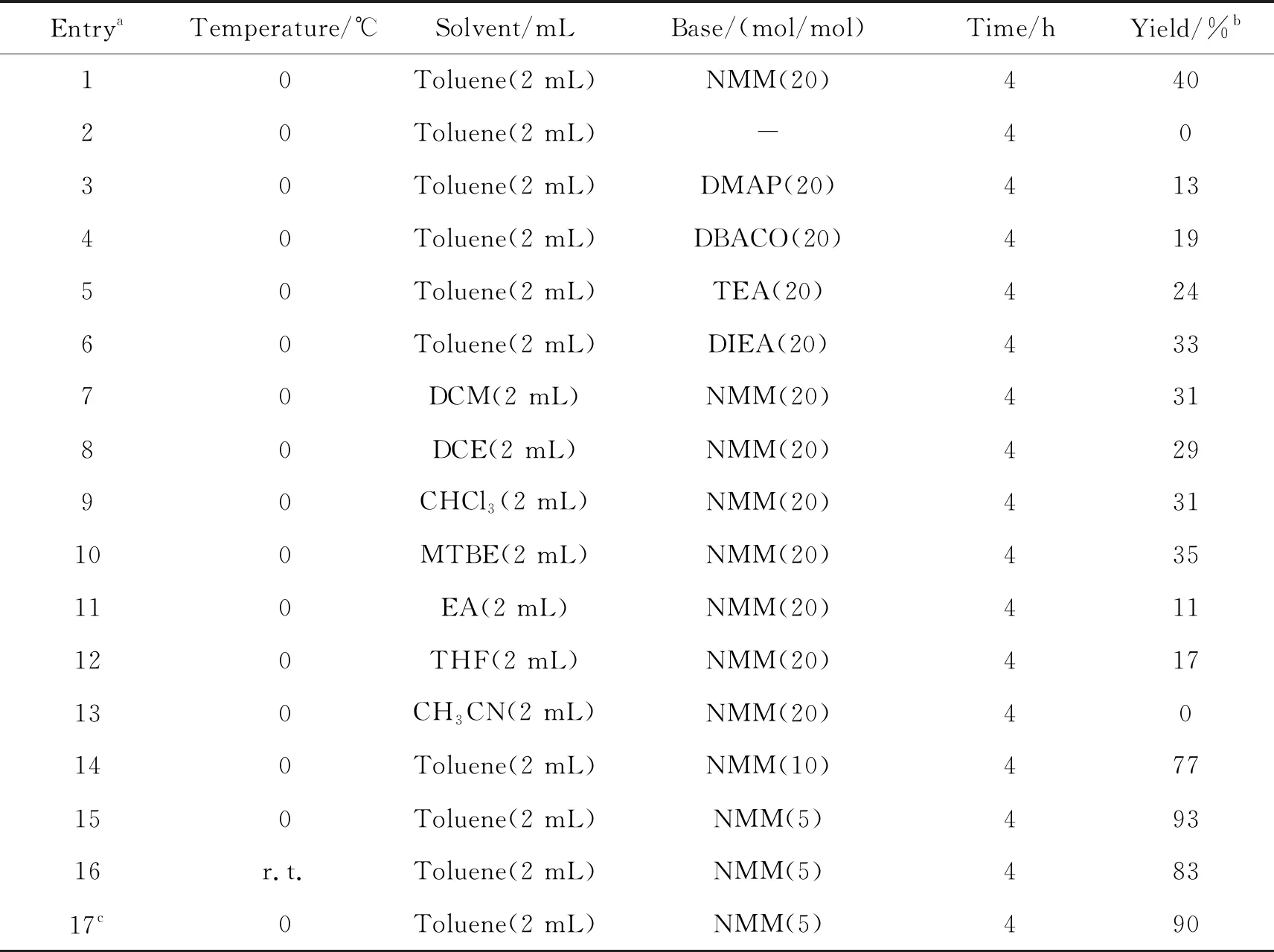
表1 化合物3aa反应的条件优化
2.1 反应条件的优化
以化合物1a和化合物2a作为底物,先后考察了不同有机碱、溶剂、碱的量、温度以及投料比对反应的影响(表1)。
从Entry 1~6可以发现,有机碱的存在对于反应的产物收率影响巨大,而在筛选的有机碱中,NMM较为适宜该反应;由Entry 7~13可知,极性亲水溶剂对于该反应十分不利,反应的溶剂以甲苯为最宜;而在考察有机碱用量时发现,降低NMM的量到5 mol/mol能够明显提高反应的收率,这可能是化合物2a在过多的碱存在时,容易发生变质;将该反应的温度升高至室温,反应的收率略有降低;另外,增加化合物2a的投料比并没有提升反应产物的收率。因此最优的反应条件如Entry 15所示,产物的收率可达到93%。
2.2 底物适应性研究
经过反应条件的优化,得到了化合物1a与化合物2a的加成-环化串联反应的最优反应条件: 5 mol/mol的NMM作为碱, 2mL/0.1mmol的甲苯作为反应溶剂,0 ℃作为反应的温度。随后我们在此反应条件进行了底物适应性的研究。
对于不同反应底物,位阻较大的α-取代硝基乙酸苯酯1c或1i与化合物2a完全不能发生反应,即便是位阻稍小的1g或1h能与化合物2a发生反应,其反应时间也较长且收率偏低。另外醌酯类化合物的位阻增大,对于反应产物的收率也是不利的,如化合物2d与化合物1a反应生成3ad的反应。
利用具有亲核活性的α-取代硝基乙酸苯酯与醌酯类化合物加成-芳构化-环化的串联反应成功构建了3-取代-3-硝基苯并呋喃酮类化合物共15个,其反应产物的收率多在中等偏上,并且反应产物的收率与底物的位阻大小正相关。

