阿莫西林结晶工艺研究
冷 凤,赵 静#,任风芝,李晓露,刘 月,张雪霞*,王秀英
(1.华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心,河北 石家庄 052165;2.华北制药股份有限公司北元分厂,河北 石家庄 050015)
阿莫西林又名羟氨苄青霉素,分子式C16H19N3O5S·3H2O,是临床上广泛使用的抗生素,对于大多数致病的G+菌和G-菌(包括球菌和杆菌)均有较强的抑菌和杀菌作用[1],用于治疗敏感菌引起的呼吸道感染、泌尿生殖道感染、皮肤软组织感染等。由于其具有广谱、耐酸、易吸收、稳定性好、安全性高等优点,在市场上一直占有重要地位,其制剂包括胶囊、颗粒、肠溶片、干混悬剂、注射剂等多种剂型与规格以及阿莫西林克拉维酸钾片等多种复方制剂[2]。
国内生产阿莫西林原料药的厂家有十余家,制剂厂家超过百家。由于各厂所用处方工艺不一样,虽然产品质量符合药典标准,但是制剂稳定性差,溶出行为与参比制剂存在差异。近年来,国家为规范仿制药市场,全面提高仿制药质量,推出了仿制药一致性评价制度,其中以参比制剂为对照,研究固体制剂的溶出行为是仿制药一致性评价的一项重要内容。固体制剂的溶出行为受诸多因素影响,其中原料药的晶型和粒度是主要影响因素之一[3-4]。因此,控制好原料药的晶型和粒度,保证自研产品与参比制剂溶出行为一致,对固体制剂通过仿制药一致性评价具有非常重要的意义。
药物的晶型不仅影响药物质量,还会影响药物的溶解性、可压性、流动性、稳定性等,进而影响药物的溶解行为和生物利用度[5]。阿莫西林原料药均匀性差,不能直接用来制粒,需要经过压制、整粒、混粉、过筛等物理过程才能满足制剂要求。在此过程中,阿莫西林的晶体结构容易被破坏,结晶水丢失,致使制剂产品稳定性下降,溶出行为批间差异增大。为解决上述问题,作者采用相似因子法考察阿莫西林原料药粒度对阿莫西林胶囊溶出行为的影响,并对阿莫西林结晶工艺进行优化,拟制备晶型稳定、粒度均匀的阿莫西林原料药,为阿莫西林胶囊、颗粒以及阿莫西林克拉维酸钾片等制剂品种的一致性评价提供技术保障。
1 实验
1.1 试剂与仪器
阿莫西林原粉,华北制药股份有限公司;纯化水,河北华维纯净水有限公司;乙腈,色谱纯,美国Fisher公司;其它试剂均为市售分析纯。
Optimax1001型结晶器(反应釜 500 mL),梅特勒-托利多仪器有限公司;DM500-ICC50型显微镜,德国Leica公司;LC-2030C 3D型高效液相色谱仪,日本岛津公司;DZF-6050型真空干燥箱,上海精宏实验设备有限公司;Mastersizer 2000型激光粒度仪,马尔文仪器有限公司。
1.2 结晶方法
称取一定质量的阿莫西林原粉置于结晶杯中,加入纯化水分散均匀,室温下滴加盐酸调节pH值使其溶解;以氨水调节溶液pH值,随着pH值的上升,阿莫西林的溶解度逐渐下降,析出晶体,调节pH值至5.0左右,再降温至2~10 ℃使析晶完全,抽滤结晶液,冷水洗涤滤饼,真空干燥,得到阿莫西林结晶粉。
1.3 含量测定
参照2015版《中华人民共和国药典》(第二部)阿莫西林检测方法测定阿莫西林含量。
2 结果与讨论
2.1 结晶浓度与析晶pH值对阿莫西林结晶效果的影响
阿莫西林是等电点结晶[6],其溶解度与溶液pH值的关系图呈U型,从等电点两侧(酸性、碱性)分别改变溶液pH值,均可以影响其溶解度,析出晶体。考察结晶浓度与析晶pH值对阿莫西林结晶效果的影响,结果见表1。
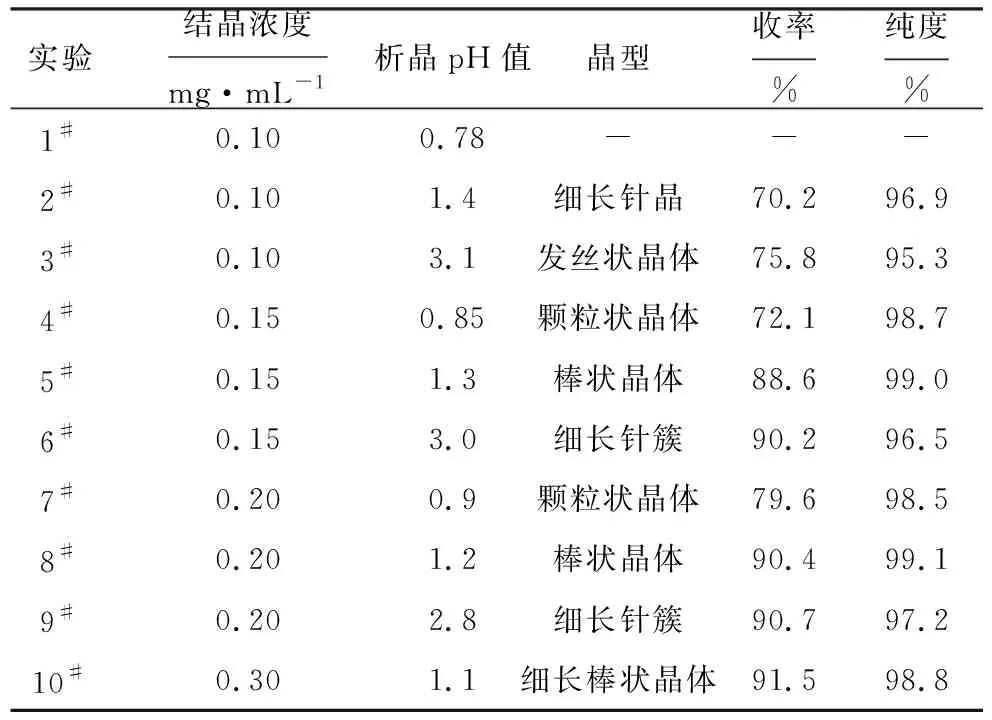
表1 结晶浓度与析晶pH值对阿莫西林结晶效果的影响Tab.1 Effect of crystallization concentration and crystallization pH value on Amoxicillin crystallization
由表1可知,阿莫西林的晶型与析晶pH值密切相关,在较低的pH值下会析出颗粒状晶体(实验4#、7#),粗大均匀,纯度尚可,但收率不高;在适宜的pH值(1.1~1.3)下会析出棒状晶体(实验5#、8#、10#);在较高的pH值(>2.8)下,由于体系的过饱和度太高,导致短时间内爆发成核,晶体沿着长度肆意生长,得到的晶体细长如针(实验6#、9#),甚至呈发丝状(实验3#),过滤和洗涤都很困难,且纯度较低。
结晶浓度不仅会影响其晶型,还会影响其纯度和收率。阿莫西林在浓度过低(0.10 mg·mL-1)时会析出细长的针状晶体(实验2#),收率低,晶体形态也不佳;在适宜浓度(0.20 mg·mL-1)时,析出棒状晶体,收率和纯度都较好;而浓度过高(0.30 mg·mL-1)时,因溶液过饱和度不易控制,晶体会长成细长棒状,粒度增大,流动性降低。
棒状阿莫西林晶体(实验8#)与原研阿莫西林的晶体形态见图1、PXRD图谱见图2。

图1 阿莫西林的晶体形态(×100倍)Fig.1 Crystal morphology of Amoxicillin(×100)

图2 棒状阿莫西林晶体(实验8#,a)与原研阿莫西林(b)的PXRD图谱Fig.2 PXRD patterns of rod-like Amoxicillin crystal and original Amoxicillin
由图1、2可知,棒状阿莫西林晶体(实验8#)与原研阿莫西林一致,为目标晶型。
综上可知,选择阿莫西林结晶浓度为0.20 mg·mL-1,析晶pH值为1.1~1.3,既可以获得和原研一致的晶型,又可以保证良好的质量和收率。
2.2 阿莫西林原料药粒度对阿莫西林胶囊溶出行为的影响
溶出曲线是衡量固体制剂与参比制剂在体内溶出行为是否相似的关键指标。原料药粒度是影响制剂溶出度的关键因素。为此,本实验制备了晶型一致、粒度不同的阿莫西林原料药,并按照相同的处方制成阿莫西林胶囊,研究其在4种介质中的溶出行为,取样点分别为5 min、10 min、20 min、30 min、45 min、60 min、90 min、120 min。采用f2相似因子法评价阿莫西林胶囊与参比制剂溶出曲线的相似性。按式(1)计算f2值,结果见表2。
(1)
式中:Rt为原研药的平均溶出度;Tt为仿制药的平均溶出度;n为溶出时间点的数量。
由表2可知,原工艺产品以及实验1#、5#、6#在4种介质中的溶出曲线相似因子f2值<50,根据溶出曲线相似性的指导原则和评价方法[7-8],判定不符合一致性评价要求。实验5#、6#因为平均粒度太大,使溶出速度受限,在4种介质中的溶出速度均比参比制剂慢;而实验1#因为粒度过小,也影响其与参比制剂的溶出相似性。为保证所制备的阿莫西林胶囊有良好的溶出行为,阿莫西林原料药D[4,3]宜控制在40~65 μm。
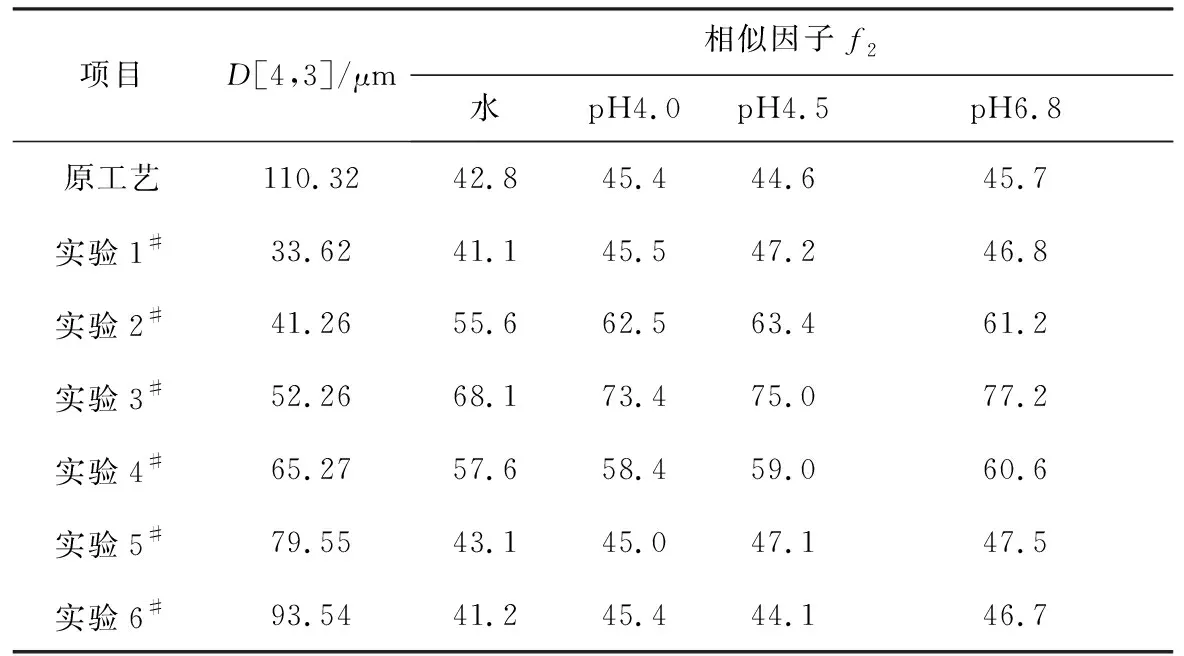
表2 阿莫西林原料药粒度对其制剂溶出行为的影响(75 r·min-1,n=12)Tab.2 Effect of particle size of Amoxicillin bulk drug on dissolution behavior of Amoxicillin preparation(75 r·min-1,n=12)
2.3 晶种加入量的选择
将阿莫西林精粉过筛,取120~160目的晶体作为晶种。按1.2结晶方法,配制4份浓度为0.20 mg·mL-1的阿莫西林溶液,用氨水调节pH值为1.20,分别加入2%、4%、6%、8%的晶种,养晶20~30 min,调节pH值至5.0左右,再降温至 2~10 ℃使析晶完全,抽滤结晶液,冷水洗涤滤饼,真空干燥,测定晶体粒度,结果见表3。

表3 晶种加入量对晶体粒度的影响Tab.3 Effect of addition amount of crystal seed on crystal particle size
由表3可知,晶种加入量过少(2%)时,消耗体系过饱和度的作用很微弱,体系还会爆发成核,导致产品粒度过小,且均匀性差,粒度分布曲线呈双峰;而晶种加入量过多(8%)时,析晶速度较快,晶体成长受限,也会导致产品粒度小,不满足制剂要求。因此,选择晶种加入量为4%~6%。
2.4 投加晶种pH值的选择
按1.2结晶方法,配制4份浓度为0.20 mg·mL-1的阿莫西林溶液,用氨水调节其pH值分别为1.10、1.15、1.20、1.25、1.30,加入5%的晶种,后续操作同2.3,结果见表4。
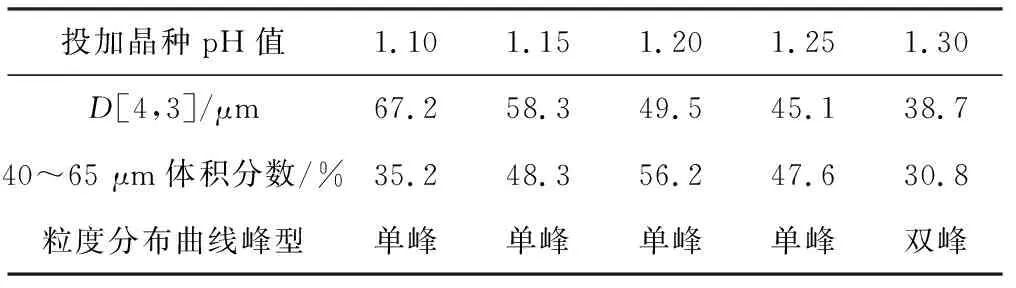
表4 投加晶种pH值对晶体粒度的影响Tab.4 Effect of pH value of adding crystal seed on crystal particle size
由表4可知,在pH值为1.30时投加晶种,由于体系处于相对较高的过饱和状态,加入晶种后部分聚集成核,破碎后又引发二次成核,使体系的总粒子数增加,最终导致晶体颗粒较小,而且均匀性较差,粒度分布曲线呈双峰;而在pH值1.15~1.25时投加晶种,可以得到理想的晶体粒度。因此,选择在pH值1.15~1.25投加晶种。
2.5 阿莫西林结晶工艺及其制剂溶出行为的验证
在最优结晶工艺条件下进行3批次验证实验,并以制得的阿莫西林原料药制成阿莫西林胶囊,对其溶出情况进行测定,结果见表5、图3。
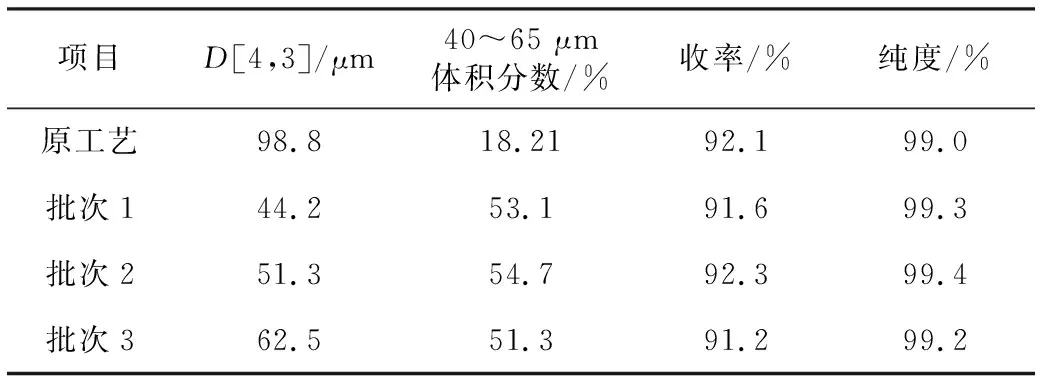
表5 阿莫西林最优结晶工艺的验证结果(n=3)Tab.5 Verification results of optimized Amoxicillin crystallization process(n=3)
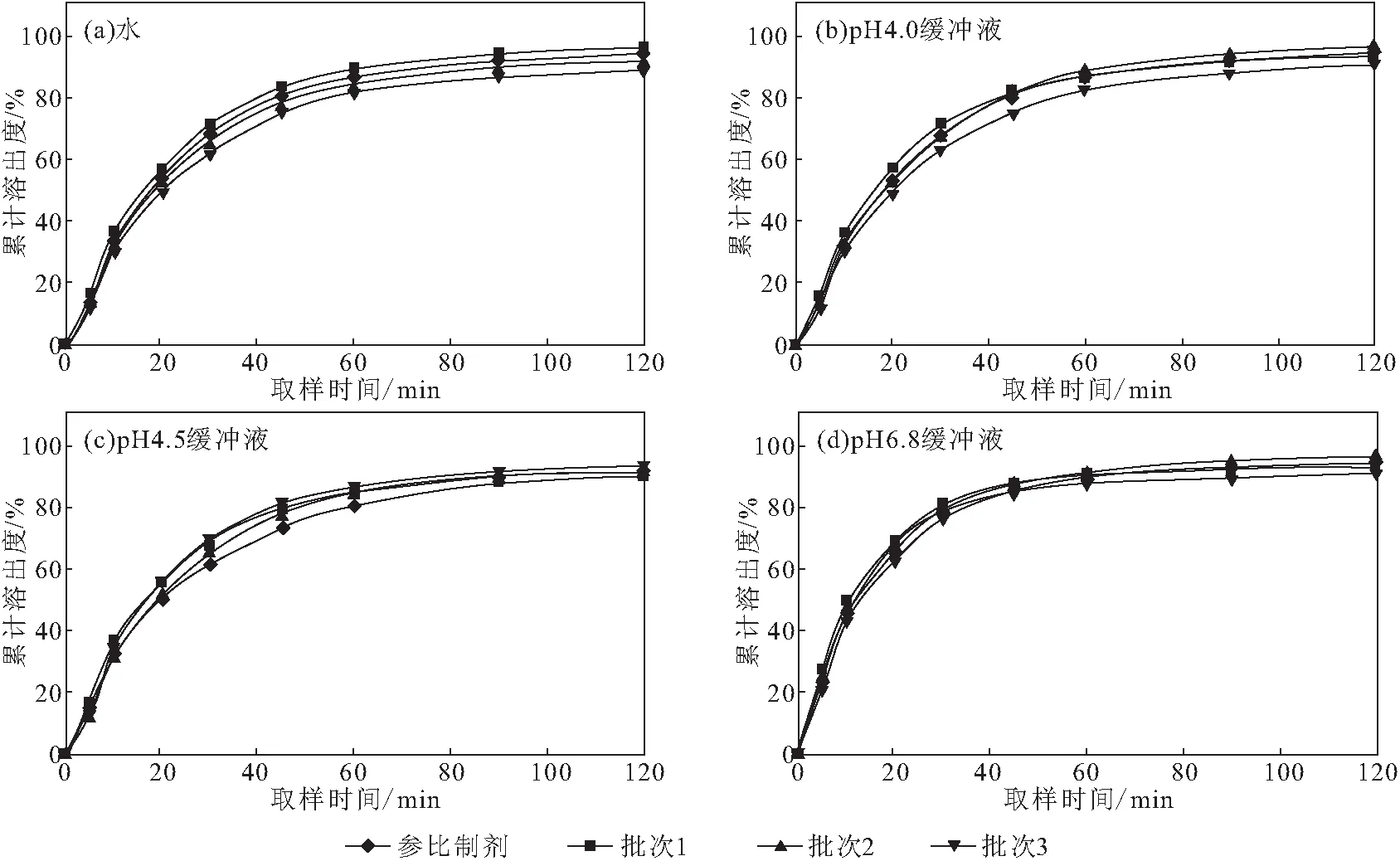
图3 阿莫西林胶囊与参比制剂在4种介质中的溶出曲线(n=12)Fig.3 Dissolution curves of Amoxicillin Capsule and reference preparation in 4 media(n=12)
由表5可知,最优结晶工艺下制得的阿莫西林原料药的D[4,3]均在40~65 μm之间,晶体均匀、粒度分布窄,产品无须经过整粒即可满足制剂要求。阿莫西林胶囊在转速75 r·min-1条件下90 min溶出度均达到85%以上,120 min溶出度达到90%以上(图3),符合《美国药典》标准限度要求。在转速75 r·min-1条件下,3批样品与同转速参比制剂相比,溶出曲线相似因子f2值>60,溶出行为相似。
3 结论
采用相似因子法考察了阿莫西林原料药粒度对阿莫西林胶囊溶出行为的影响,并对阿莫西林结晶工艺进行了优化。确定了阿莫西林原料药D[4,3]宜控制在40~65 μm,最佳结晶工艺如下:结晶浓度为0.20 mg·mL-1,晶种加入量为4%~6%,投加晶种pH值为1.15~1.25,养晶时间为20~30 min。优化后的结晶工艺能够实现对阿莫西林原料药晶型和粒度的精准控制,制备出优质、稳定的制剂产品,为阿莫西林胶囊、阿莫西林颗粒以及阿莫西林克拉维酸钾片等系列仿制药的一致性评价提供了技术保障。

